十全大補湯調整肉桂劑量對氧化損傷大鼠真皮成纖維細胞增殖的影響
郝鈺 唐瑩 王順梅 杜貫潮 代紅雨
十全大補湯調整肉桂劑量對氧化損傷大鼠真皮成纖維細胞增殖的影響
郝鈺 唐瑩 王順梅 杜貫潮 代紅雨
目的 從細胞分裂周期變化角度探討十全大補湯調整肉桂劑量促進創面修復及皮膚修復的機理。方法 采用體外培養成纖維細胞,造成氧化損傷成纖維細胞模型。以血清藥理學方法獲取大鼠血清,用以對成纖維細胞模型的干預。并運用四甲基偶氮唑鹽微量酶反應比色法(MMT法)及流式細胞儀檢測成纖維細胞增殖及分裂周期的變化。結果 MMT法結果顯示2倍肉桂組和4倍肉桂組對氧化損傷的大鼠真皮成纖維細胞具有促進增殖的作用,與模型組比較差異顯著(P<0.01);流式細胞術結果顯示經500μmol/L的H2O2刺激30分鐘的大鼠真皮成纖維細胞中G0/G1期細胞比例顯著增高,S期和G2/M期細胞比例顯著降低。在藥物干預24小時后,四個用藥組均可降低G0/G1期細胞比例,S期和G2/M期細胞比例升高;在藥物干預48小時后,除了去肉桂組以外,其余三個用藥組均能使G0/G1期細胞比例降低,S期和G2/M期細胞比例升高,與模型組相比差異具有統計學意義(P<0.05),而去肉桂組對細胞周期的影響與模型組相比無明顯差異。結論 十全大補湯對氧化損傷的大鼠真皮成纖維細胞具有調控成纖維細胞周期、促進增殖的作用,而適當增加肉桂劑量可以起到增效的作用。
氧化應激; 創面修復; 纖維細胞細胞; 十全大補湯; 肉桂
成纖維細胞是創面主要的修復細胞,其生物學行為決定了創面修復的轉歸[1]。當前研究表明慢性創面存在著氧化應激反應的失衡,過度的氧化損傷延遲了創面的愈合[2-3]。本實驗在成功建立大鼠真皮成纖維細胞氧化應激模型的基礎上,觀察十全大補湯調整肉桂劑量對氧化損傷大鼠真皮成纖維細胞增殖的影響,從抗氧化損傷角度探討中醫藥促進創面愈合的機制。
1 材料和方法
1.1 實驗動物
SPF/VAF級Wistar大鼠54只,雄性,體重280~300 g,由北京維通利華實驗動物技術有限公司提供。用隨機數字表法將大鼠分為6組,即正常對照組(無氧化損傷模型)、模型組、去肉桂組、原方組、2倍肉桂組和4倍肉桂組,每組8只大鼠。另6只大鼠用于原代培養真皮成纖維細胞。
1.2 中藥復方組成及配方顆粒的制備
十全大補湯的藥物原方組成為:當歸9 g、白術4.5 g、茯苓9 g、甘草3 g、熟地黃9 g、白芍4.5 g、人參3 g、川芎3 g、黃芪9 g、肉桂1.5 g(《醫學發明》)。去肉桂組藥物組成為:原方去肉桂;原方組藥物組成為:十全大補湯原方;2倍肉桂組藥物組成為:肉桂劑量為原方肉桂劑量的2倍;4倍肉桂組藥物組成為:肉桂劑量為原方肉桂劑量的4倍。由北京中醫藥大學東方醫院中藥房按照藥物用量制成配方顆粒。配方顆粒于開始灌胃的前一周制備完成,常溫保存。
1.3 主要試劑與儀器
DMEM培養基購自Gibco公司;胎牛血清購自天津TBD公司;過氧化氫(30%)購自西隴化工股份有限公司;四甲基偶氮唑藍[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]購自Sigma;二甲基亞砜(dimethyl sulfoxide,DMSO)購自美國Amresco;碘化吡啶(propidium iodide,PI)購自Sigma;磷酸鹽緩沖液(phosphate buffered saline,PBS)購自上海江萊生物科技有限公司。倒置光學顯微鏡:OLYMPUS 1X71型;SAFIREⅡ多功能全波長酶標儀:奧地利Digiscan SA 1000;流式細胞儀:美國BD公司(Becton,Dickinson and Company)產FAGSCalibur E1591型。
1.4 原代培養大鼠真皮成纖維細胞
健康大鼠6只,稱重后,用新配制的10%水合氯醛按0.4 m l/100 g腹腔注射麻醉大鼠。大鼠進入深麻醉狀態后,用硫化鋇脫毛劑將其背部皮膚脫毛,脫毛面積約為3 cm×5 cm。脫毛后,用75%酒精擦拭皮膚進行消毒,隨后將大鼠送入超凈工作臺內。再次用75%酒精消毒皮膚,剪取2 cm×4 cm大小背部皮膚,取皮后大鼠斷頸處死。將剪下的皮膚用PBS反復沖洗,洗去血液,剪除皮下筋膜、結締組織。將皮片置于含有DMEM培養液的平皿中,剪成數條皮條。真皮面向上,將真皮組織剪成1 cm× 1 cm大小的組織塊(剪取后會團縮到大約0.5 cm2左右大小)。將剪好的組織塊種入提前用培養液濕潤過的瓶底25 cm2的培養瓶中,每瓶種入25塊。植塊后,瓶底向上,置于37℃、5%CO2培養箱中。3小時后從培養箱中取出培養瓶,翻轉瓶底向下,每瓶中加培養液1ml。隨后將培養瓶置于培養箱中培養。倒置顯微鏡下觀察,經培養60小時可見部分組織塊周圍有少量成纖維細胞爬出。5天后貼壁細胞逐漸增多,多數組織塊周圍游離出成纖維細胞。更換培養液后,隨時間推移,組織塊周圍可見有大量成纖維細胞包繞。從形態上看,成纖維細胞呈梭形或不規則三角形,放射狀或漩渦狀走行。12天后組織塊移出的單層細胞匯合,細胞鋪滿瓶底,進行消化傳代[4]。
1.5 氧化應激大鼠真皮成纖維細胞模型
取對數生長期細胞,用DMEM高糖完全培養液將細胞濃度調整為1×105/ml。接種于96孔細胞培養板中,分為正常對照組(無氧化損傷模型),模型組、去肉桂組、原方組、2倍肉桂組和4倍肉桂組。每組每時段每濃度設置6個復孔[5]。每孔100μl細胞懸液,置于培養箱中培養24小時。待細胞貼壁后,棄去培養液。正常對照組,每孔加入不含H2O2的無血清DEME培養液100μl,其余5組每孔加入濃度為500μmol/L的H2O2無血清DEME培養液100μl,置于培養箱中刺激30分鐘(H2O2濃度和刺激時間為前期實驗摸索,相關內容將另文發表)。
1.6 復方含藥血清的制備
大鼠分組后,各組按人和大鼠間體表面積折算公式,計算每只大鼠每天的給藥劑量,每只每天灌胃1次,每次灌胃4 m l。正常對照組和模型組給予4 m l生理鹽水灌胃。連續給藥3天,第4天給藥后1小時,10%水合氯醛(0.4 m l/100 g)腹腔注射麻醉。麻醉成功后,將大鼠腹面向上固定于鼠板上,逐層打開皮膚、肌肉等各層組織,暴露腹主動脈后采血。采血后,將采血管室溫避光靜置1小時及4℃靜置1小時,待凝血堅固,血清析出,4℃,3000 r/min離心15分鐘,分離血清。吸出血清后,將同組大鼠血清混勻,分裝,-70℃冷藏備用。
1.7 不同濃度含藥血清對氧化損傷成纖維細胞增殖的影響
按照分組,各組氧化應激大鼠真皮成纖維細胞模型,分別加入對應的血清濃度為5%、10%、15%的DMEM培養液200μl。每組每時段每濃度設置6個復孔。置于培養箱中培養24小時、48小時。分別于培養24小時、48小時后,各孔加入20μl MTT(5 mg/ml),并置于培養箱中孵育4小時后,在鏡下觀察是否已形成紫色結晶,盡量吸凈孔內液體,各孔再加入DMSO 100μl,搖床避光振蕩10分鐘。用多功能全波長酶標儀在570 nm波長下,檢測各孔光密度值(optical density,OD)[6]。
1.8 流式細胞術檢測細胞周期
取對數生長期細胞,用DMEM高糖完全培養液將細胞濃度調整為1×106/ml,接種于25 cm2培養瓶中,每瓶1 ml細胞懸液,分組設置為正常對照組、模型組、去肉桂組、原方組、2倍肉桂組及4倍肉桂組,每組6瓶,置于37℃、5%CO2培養箱中培養24小時。待細胞貼壁,棄去培養液,正常對照組加入不含H2O2的無血清DEME培養液2 ml,其余5組加入500μmol/L的H2O2無血清培養液2 ml,置于培養箱中刺激30分鐘后用PBS漂洗兩次。各組加入對應的10%含藥血清DMEM培養液3 ml/瓶,置于培養箱中培養24小時、48小時。分別于培養24小時、48小時后,胰酶消化、離心收集細胞,用預冷的PBS洗滌細胞兩次。最后一次留500μl PBS,混勻細胞,逐滴加入到5 ml 70%預冷乙醇中,邊加邊搖晃均勻,置冰上45分鐘后保存于4℃固定液過夜。檢測當天,取出固定保存的細胞,以1000 r/min離心5分鐘,棄去固定液,加入PBS,同樣條件下再離心洗滌一次,留300μl PBS,打散細胞團,加入10 mg/ml的RNase A 5μl,37℃條件下放置1小時,然后加入10 mg/ml的PI染液5μl,室溫下避光反應30分鐘,上機前用200目尼龍網過濾,用流式細胞儀測定細胞周期。計算細胞增殖指數(proliferation index,PI)(%)=(S+G2/M)/(G0/G1+S+G2/M)×100%[7]。
1.9 統計學分析
全部數據用SPSS 18.0統計軟件進行統計分析。結果以均數±標準差表示,采用方差分析比較組間差異,以雙側P<0.05為有統計學意義,以雙側P<0.01為有顯著統計學意義。
2 結果
2.1 不同濃度含藥血清對氧化損傷大鼠真皮成纖維細胞增殖的影響
使用500μmol/L的H2O2刺激細胞30分鐘后,在同一時間點相同血清濃度的條件下,與正常對照組相比各組細胞OD值明顯降低,差異具有統計學意義(P<0.01或P<0.05)。藥物干預24小時后,5%濃度組中各用藥組與模型組相比OD值無明顯差異;10%濃度組中2倍肉桂組和4倍肉桂組OD值升高,與模型組相比差異具有統計學意義(P<0.05);15%濃度組中2倍肉桂組OD值明顯升高,與模型組相比差異具有顯著統計學意義(P<0.01)。藥物干預48小時后,5%濃度組中2倍肉桂組和4倍肉桂組OD值明顯升高,與模型組相比差異具有顯著統計學意義(P<0.01);10%濃度組中2倍肉桂組OD值明顯升高,與模型組相比差異具有顯著統計學意義(P<0.01);15%濃度組中各用藥組OD值與模型組相比無明顯差異。在四個用藥組中,2倍肉桂組在兩個時間點上的OD值均為最高。見表1。
2.2 四組藥物對氧化損傷大鼠真皮成纖維細胞細胞周期的影響
使用500μmol/L的H2O2刺激細胞30分鐘后,G0/G1期細胞比例增高,S期和G2/M期細胞比例降低,與正常對照組相比差異具有顯著統計學意義(P<0.01)。藥物干預24小時后,各用藥組G0/G1期細胞比例降低,S期和G2/M期細胞比例增高,與模型組相比差異具有顯著統計學意義(P<0.01),見表2。藥物干預48小時后,原方組和4倍肉桂組G0/G1期細胞比例降低,S期和G2/M期細胞比例增高,與模型組相比差異具有統計學意義(P<0.05),2倍肉桂組G0/G1期細胞比例明顯降低,S期和G2/M期細胞比例明顯增高,與模型組相比差異具有顯著統計學意義(P<0.01),而去肉桂組對細胞周期的影響與模型組相比無明顯差異。在四個用藥組中,2倍肉桂組在兩個時間點上的細胞增殖率均為最高,見表3。
表1 不同濃度四組藥物對氧化損傷大鼠真皮成纖維細胞增殖的影響(±s,n=6)

表1 不同濃度四組藥物對氧化損傷大鼠真皮成纖維細胞增殖的影響(±s,n=6)
注:與同一時間點正常對照組比較aP<0.01,bP<0.05;與同一時間點模型組比較cP<0.01,dP<0.05
組別 血清濃度 24小時OD值 48小時OD值5% 0.8393±0.2733 0.9160±0.0810 10% 1.0380±0.1958 1.1792±0.1473 15% 0.7383±0.2821 1.3567±0.3280模型組 5% 0.3500±0.0850a0.3579±0.1076a10% 0.4316±0.0579a0.5437±0.0941a15% 0.2847±0.1106b0.3302±0.1636a去肉桂組 5% 0.3056±0.1262a0.4039±0.0859a10% 0.5180±0.1152a0.6401±0.1569a15% 0.2401±0.0762a0.3484±0.0286a原方組 5% 0.2922±0.0707a0.4053±0.0999a10% 0.4603±0.1045a0.6601±0.1422a15% 0.2408±0.1217a0.1907±0.0426a2倍肉桂組 5% 0.4389±0.1371b0.5168±0.1006ac10% 0.5896±0.1111ad0.7596±0.1839ac15% 0.5342±0.1330c0.4951±0.2066a4倍肉桂組 5% 0.3132±0.0780a0.4930±0.0707ac10% 0.5588±0.0901ad0.6517±0.1112a15% 0.3292±0.0761a0.3215±0.0748正常對照組a
表2 四組藥物對氧化損傷大鼠真皮成纖維細胞周期的影響(24小時)±s,n=3)
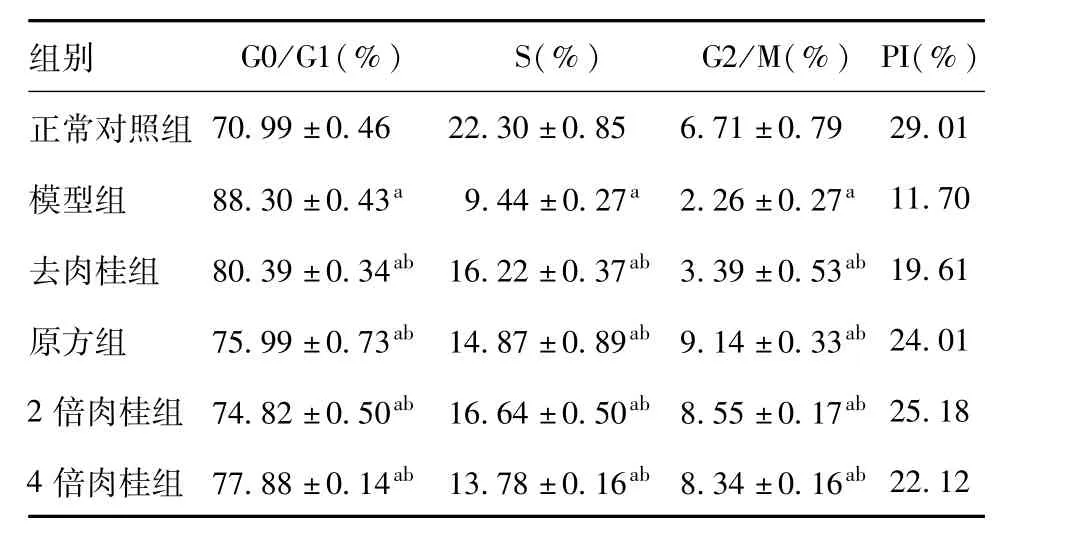
表2 四組藥物對氧化損傷大鼠真皮成纖維細胞周期的影響(24小時)±s,n=3)
注:與同一時間點正常對照組比較aP<0.01;與同一時間點模型組比較bP<0.01
組別 G0/G1(%) S(%) G2/M(%)PI(%)70.99±0.46 22.30±0.85 6.71±0.79 29.01模型組 88.30±0.43a9.44±0.27a2.26±0.27a11.70去肉桂組 80.39±0.34ab16.22±0.37ab3.39±0.53ab19.61原方組 75.99±0.73ab14.87±0.89ab9.14±0.33ab24.01 2倍肉桂組74.82±0.50ab16.64±0.50ab8.55±0.17ab25.18 4倍肉桂組77.88±0.14ab13.78±0.16ab8.34±0.16ab正常對照組22.12
表3 四組藥物對氧化損傷大鼠真皮成纖維細胞周期的影響(48小時)(±s,n=3)

表3 四組藥物對氧化損傷大鼠真皮成纖維細胞周期的影響(48小時)(±s,n=3)
注:與同一時間點正常對照組比較aP<0.01;與同一時間點模型組比較bP<0.01,cP<0.05
組別 G0/G1(%) S(%) G2/M(%)PI(%)71.20±0.59 15.29±0.76 13.51±0.45 28.80模型組 95.56±0.20a3.87±0.13a0.56±0.08a4.44去肉桂組 94.69±0.25a4.18±0.32a1.13±0.24a5.31原方組 94.25±0.19ac4.58±0.17ac1.17±0.06ac5.75 2倍肉桂組89.55±0.40ab8.62±0.28ab1.83±0.13ab10.45 4倍肉桂組91.82±0.04ac7.07±0.06ac1.11±0.08ac正常對照組8.18
3 討論
成纖維細胞具有合成、分泌膠原蛋白、糖胺多糖等細胞外基質成分的作用。在組織形成、保持組織形態以及組織損傷的修復等過程均發揮重要作用。它與預先制備的細胞外基質網架材料共同形成了真皮結構[8]。因此,研究成纖維細胞在體外培養條件下增殖、分化的調控因素,具有重要意義。
在本實驗中,MTT結果顯示500μmol/L的H2O2刺激大鼠真皮成纖維細胞30分鐘,可明顯抑制細胞的增殖,說明活性氧H2O2可以對大鼠真皮成纖維細胞的增殖起到抑制作用。5%濃度組中的2倍肉桂組、4倍肉桂組在藥物作用48小時后對細胞增殖具有明顯促進作用;10%濃度組中4倍肉桂組在藥物作用24小時后對細胞增殖具有促進作用,2倍肉桂組在藥物作用24小時及48小時后均能夠促進細胞增殖;15%濃度組中2倍肉桂組在藥物作用24小時后對細胞增殖具有明顯促進作用。其余各組對細胞增殖的影響不明顯。綜合以上結果可以看出,2倍肉桂組和4倍肉桂組在一定程度上對氧化損傷的大鼠真皮成纖維細胞具有促進增殖的作用,而去肉桂組及原方組對細胞增殖的影響較小。
流式細胞術檢測結果表明在藥物干預24小時后,四個用藥組G0/G1期細胞比例降低,而S期和G2/M期細胞比例升高,在藥物干預48小時后,除了去肉桂組以外,其余三個用藥組均能使G0/G1期細胞比例降低,S期和G2/M期細胞比例升高。表明四個用藥組均能夠解除細胞阻滯,增加S期細胞比例,促進細胞不斷分裂增殖。其中以原方組、2倍肉桂組及4倍肉桂組作用顯著。
中醫學認為難愈性創面屬于“陰證潰瘍”的范疇,其主要的治療原則是“煨膿長肉法”,在臨床現象上表現為創面出現黏稠明凈的“膿”是創面轉陽向愈的一個重要標志;從治法而言,“補法”是治療潰瘍的主要治法,但“潰瘍”中的“陰證潰瘍”則需要在補益法的基礎上配伍適量的溫通藥物促進創面由陰證向陽證的轉化。如陳實功在《外科正宗》中所論述“腐肉雖脫,新肉生遲,如凍色者,肉冷肌寒,大溫氣血”。又如《外科全生集》所論述:“若滋補不兼溫暖,則孰為釀膿之具,然膿之來必由氣血。”由本實驗可以看出補益法與溫補法均有促進氧化損傷成纖維細胞增殖的作用,從而根據整體和局部辨證的結果適當調整溫通藥物的配伍則起著“畫龍點睛”的作用,符合中醫學“煨膿長肉”的促愈理論。
[1] 王益民,韋福康,劉敏.成纖維細胞與創傷修復的研究進展[J].中國修復重建外科雜志,2000,14(2):126-128.
[2] 劉繼松.氧化應激和糖尿病創面的延遲愈合[J].蚌埠醫學院學報,2010,35(7):756-757.
[3] 楊國志,王潤秀,林源.氧化應激與創面愈合[J].中國組織工程研究與臨床康復,2007,11(2):355-358.
[4] 趙京霞,李萍,黃啟福,等.桂皮醛對NIH3T3細胞增殖和細胞周期的影響[J].北京中醫藥大學學報,2006,29(12):823-825.
[5] 杜先華,李海燕,王爽,等.H2O2誘導體外培養的皮膚成纖維細胞氧化應激損傷[J].中國老年學雜志,2011,31(4):644-646.
[6] 楊國志,王潤秀,林源,等.氧化應激對大鼠真皮成纖維細胞的影響[J].中國組織工程研究與臨床康復,2007,32(11):6428-6431.
[7] 李光善,李萍,盛巡,等.黃芪多糖、桂皮醛、川芎嗪對實驗性糖尿病大鼠創面成纖維細胞增殖作用的影響[J].中國中醫基礎醫學雜志,2004,10(4):20-22.
[8] 趙雷.EGF對大鼠真皮成纖維細胞增殖的影響[J].吉林醫學,2004,25(6):23-25.
Influence of Shiquan Dabu Decoction and different doses of cinnamon com patibility on oxidativedamaged rat dermal fibroblasts proliferation
HAO Jue,TANG Ying,WANG Shun-mei,et al.School of Preclinical Medicine Beijing University of Chinese Medicine,Beijing 100029,China Corresponding author:DAIHong-yu,E-mail:dhy515@163.com
Objective To investigate themechanism of Shiquan Dabu Decoction(literally,Com-plete Ten-medicinals Nourishment Decoction)with varying doses of cinnamon composed in its benefits to wound/skin repair from the perspective of cell division and cell cycle.M ethods Rat dermal fibroblasts was obtained by in-vitro culture.The serums extracted with serum pharmacological approacheswere used to interfere the oxidative-damaged rat dermal fibroblasts.Next,Methyl thiazol tetrazolium(MTT)-assay was used tomeasure the effects of the serums on cell proliferation;and flow cytometry were employed to test the effects on cell cycle.Results OD value decreased significantly in MTT-assaywhen 500μmol/LH2O2had stimulated rat dermal fibroblasts for30minutes.And the proportion ofG0/G1 period increased significantly while the proportion of Sand G2/M period decreased significantly.The rate of apoptosis increased significantly.Mitochondrialmembrane potential decreased significantly.And the level of reactive oxygen species increased significantly.After 24 hours of serums treatment,the OD values of the double cinnamon group and the four times cinnamon group increased in the group of 10%serum concentration.The OD value of the double cinnamon group increased significantly in the group of15%serum concentration.After48 hours of serums treatment,the OD values of the double cinnamon group and the four times cinnamon group increased significantly in the group of5%serum concentration.The OD value of the double cinnamon group increased significantly in the group of 10%serum concentration.The OD values of the double cinnamon group in two time pointswere both the highest in the four groups.After 24 hours of serums treatment,the proportion of G0/G1 period ofall four groups decreased significantly,and the proportion of Sand G2/M period of all four groups increased significantly.After 48 hours of serums treatment,the proportion of G0/G1 period of the Shiquan Dabu Decoction group,the double cinnamon group and the four times cinnamon group decreased,and the proportion of S and G2/M period of the three groups increased.The proliferation index of the double cinnamon group in two timepoints were both the highest in the four groups.Conculusion Shiquan Dabu Decoction can acceleratewound healing into skin restoration through promoting cell proliferation controlling the proliferation of filbrohlasts from granulation tissue of the wound.And the function can be enhanced if the dose of cinnamon is increased on the basis of Shiquan Dabu Decoction.
Oxidative stress; Wound healing; Dermal fibroblasts; Shiquan Dabu Decoction;Cinnamon
R285.5
A
10.3969/j.issn.1674-1749.2013.09.002
2013-05-30)
(本文編輯:黃凡)
北京市自然科學基金(7112072);北京中醫藥大學自主選題資助項目(20111003)
100029北京中醫藥大學基礎醫學院[郝鈺、唐瑩(碩士研究生)、王順梅(碩士研究生)];北京中醫藥大學東方醫院肛腸科[代紅雨、杜冠潮(碩士研究生)]
郝鈺(1964-),女,博士,教授。研究方向:中藥的免疫調節機制研究。E-mail:huangshiren64@qq.com
代紅雨(1971-),博士,副主任醫師。研究方向:中醫藥促進難愈性創面愈合的研究。E-mail:dhy515@163.com

