藥品招標采購活動中相關質量術語解讀
王愛杰 付加雷
(1山東省藥品集中采購服務中心,山東 濟南 250014;2山東省中醫藥研究院)
健全和完善的藥品招標采購制度是控制藥品費用不合理增長,遏制藥品購銷領域不正之風的有效手段。構建完善的藥品招標和采購制度是新醫改提出建立藥品供應保障體系的重點和難點之一,新醫改中規定,通過省政府建立藥品采購機構,對藥品和藥品配送進行招標,其目標是通過集中招標采購降低不必要的藥品成本,保障藥品質量,增強藥品的可獲得性和供應的及時性[1]。發達國家藥品市場經過多年發展,在藥品制度設計上較為完善。一些發達國家,都成立了政府藥品招標采購機構,其作用為重新規劃管理全國范圍內的藥品招標采購問題,以合同采購為基礎,建立從藥品招標采購到藥品配送的完善管理體系[2-5]。學習國外成功經驗有助于建立完善的藥品招標采購制度。由于我國藥品集中招標采購起步較晚,藥品招標采購制度與藥品配送管理體系還需進一步完善。
近幾年各省陸續成立了藥品集中招標平臺,各種類型的藥品集中招標采購陸續開展。縱覽各省藥品招標采購方案發現,對藥品相關的質量術語理解大相徑庭,必須對各術語進行總結、歸納與分析,以便形成統一標準。否則,各個質量術語的不規范與不統一,不僅不利于全國的藥品招標采購活動,更不利于藥品的質量層次劃分,從總體上更無法體現藥品招標“質量優先,價格合理”的根本原則[6-7]。
1 質量相關術語
1.1 何為專利藥品
對2009年以來具有代表性的幾個省市招標方案中專利藥品的概念進行列舉和比較,見表1。
由表1對比分析可知,所謂專利藥品都是指發明專利,幾乎把實用新型和外觀設計專利排除在外。有些省市對“專利藥品”采用狹義概念,僅指化合物或化合物實體專利,不包括藥物組合物、天然提取物和微生物及其代謝物等其他專利藥品;有些省市則采用相對廣義的概念,把化合物(實體)專利、藥物組合專利(藥物有效成份組合專利)、天然提取物專利、微生物及其代謝物專利以及中成藥組方專利等都納入專利藥品范疇。針對工藝流程專利在不同的省份有不同的界定,嚴格意義上講工藝流程專利(含劑型專利藥品)也屬于發明專利的一種,大部分省份把它排除在專利藥品范疇之外,只有少部分省份納入了專利藥品來對待。
從原國家食品藥品監督管理局網站藥品注冊相關專利信息公開公示欄目上查詢到1 932條藥品注冊相關專利信息,從該數據統計分析,主要分為五大類藥品專利,分別為化合物專利、藥物專利、處方專利、工藝專利以及其他專利。在這五大類藥品專利中,藥物專利只有一條數據,主要是針對藥物使用方法或者用途實施保護。分析其他四大類專利:有些對化合物實體、天然提取物以及微生物及其代謝物實施保護的專利,藥品注冊相關專利信息統一歸屬于化合物專利;中成藥處方專利和西藥處方專利(藥物組合物專利)藥品注冊相關專利信息統一歸屬于處方專利;主要針對制備工藝的保護,一般包括劑型專利在內,藥品注冊相關專利信息統一歸屬于工藝專利;藥品注冊相關專利信息中的其他專利一般包括國外申請的專利、外觀設計專利和實用新型專利。再結合最近幾年各省份招標方案中針對專利藥品概念的解讀,藥品專利可以細分如下,其具體結構層次見圖1。
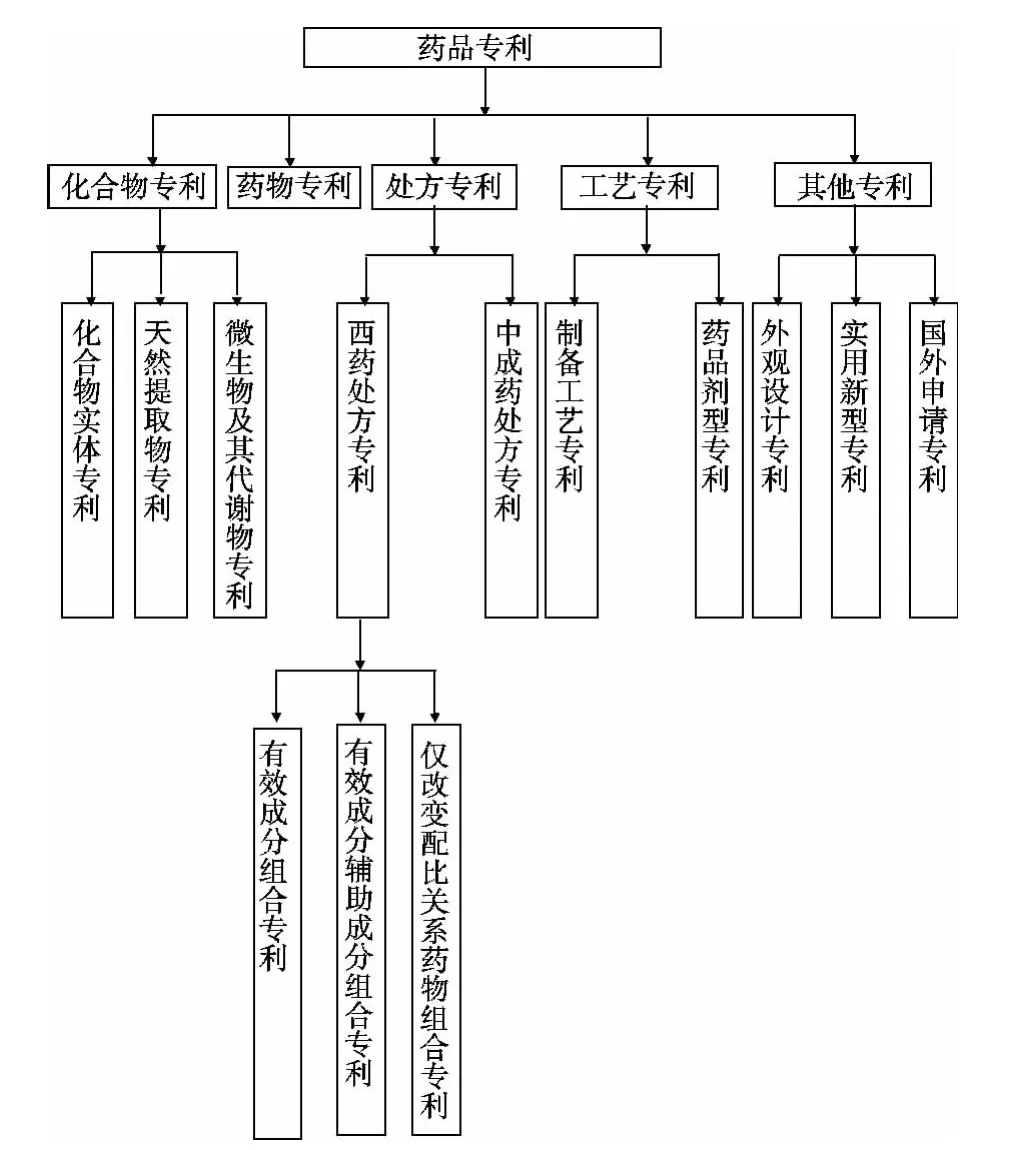
圖1 藥品專利分類示意
針對1 932條藥品注冊相關專利信息歸納分析以及各省藥品招標方案中專利藥品的不同解釋,現對各個專利藥品詳解如下。
1.1.1 化合物實體專利是指具有我國化合物核心結構發明專利證書、或外國發明專利取得我國保護證明文件的藥品,在其發明專利證明文件中應當有化合物的名稱、結構或分子式等關鍵表征,不包括改變酸根、堿基、金屬元素、結晶形式等為特征實施保護的化合物專利。該專利主要是針對化學藥品的專利保護。
1.1.2 天然提取物專利是指首次從自然界分離或提取出來的物質的保護專利,該物質結構、形態或者其他物理化學參數等應在其專利文件中被確切地表征,并獲得我國發明專利證明文件。該專利主要是針對天然藥物的專利保護。
1.1.3 微生物及其代謝物專利是指對細菌、放線菌、真菌、病毒、原生動物、藻類等微生物種經過篩選、突變、重組等方法得到并分離的純培養物和其代謝物質的保護專利,并獲得我國發明專利證明文件。該專利主要是針對生化藥物以及生物制品的專利保護。
1.1.4 有效成分組合專利是指兩種及兩種以上有效成份或藥品的全新組合,并獲得我國發明專利證明文件。在各省的藥品招標方案中有藥物組合物專利這一術語,其定義是指對兩種或兩種以上的藥物成分組合的保護專利,在其專利文件中應當有組分或者含量等組成特點的關鍵表征,并在專利名稱、摘要、權利要求等內容中明確表述其為組合物專利。這一概念和西藥處方專利相吻合,包括有效成分組合專利、有效成分與輔助成分組合專利以及僅改變配比關系的藥物組合專利三種類型。
1.1.5 中成藥處方專利(含中藥提取物專利)也可以稱為中成藥組方專利,指以中藥材或其提取物為原料,在中醫藥理論指導下,按照規定的處方組成和制備工藝加工生產的,供臨床醫師辨證施治的藥物專利。該專利主要是針對我國中醫藥的專利保護。
1.1.6 專利保護期內的工藝流程發明專利(含藥品劑型專利)是指產品在生產過程中對生產的流程、工藝技術、制造方法進行研究、創新,受法律規范保護、享有專利權的發明創造,能有效的提高產品質量,以國家知識產權局的專利證書為準。該專利主要是針對藥品的制備工藝進行保護,而藥品劑型專利應該屬于制備工藝專利的一種。
1.1.7 其他專利一般是指在國外申請的專利,其專利類型應該包括除中成藥處方專利之外的所有類型,該專利應取得我國保護證明文件。此外,還包括外觀設計專利和實用新型專利。外觀設計專利主要是針對藥品包裝外觀設計的專利保護,該專利與藥品質量屬性無直接相關性;實用新型專利一般是針對使用藥品新型容器的專利保護,該專利一般與藥品的安全性或者有效性有關。
根據專利法可知,嚴格法律意義上的專利藥品應該包括所有取得專利權的藥品。因此,對于取得發明專利、實用新型專利或者外觀設計專利的藥品,都應該納入專利藥品范疇(從廣義的角度)。但是在招標采購活動中,各省份為了實現“質量優先”的原則,對專利藥品的概念或者范疇出現了不同的界定。綜上所述,化合物實體專利、天然提取物專利、微生物及其代謝物專利、有效成分組合專利以及中成藥處方專利(含中藥提取物專利)等屬于發明專利,在招標采購活動中都應該納入專利藥品范疇;外觀設計專利、實用新型專利以及專利保護期內的工藝流程發明專利 (含藥品劑型專利),從廣義角度上講也屬于專利藥品,但是考慮到該類專利藥品的質量、新穎性和創造性與前述專利藥品存在很大的差異,因此,大部分省份沒把它們納入專利藥品范疇或者單列。
1.2 何為原研制藥品
原研制藥品是指中華人民共和國國家知識產權局授予的發明專利保護期的藥品或中華人民共和國國家發展和改革委員會文件中標示為原研制的藥品,以及專利法實行前(即1985年4月1日前)首次研發上市的國產藥品,而未標明原研制藥品的單獨定價且獲國外專利證書的進口藥品也可視為原研制藥品。不包括取得外觀設計、實用新型或工藝流程等專利藥品和同種藥品上市后首次出現的劑型和新適應證藥品。
1.3 何為歐美澳和日本認證藥品
歐美澳和日本認證藥品是指獲得美國食品藥品管理局(FDA)認證、歐盟動態藥品生產管理規范(cGMP)認證、澳大利亞藥物管理局(TGA)認證以及日本藥品管理規范(JGMP)認證的制劑生產線生產,且已向相應國家出口的國產藥品,僅原料、生產車間或生產線獲認證的不在范圍內,以相關證書原件、相應國家(歐盟包括所有成員國)的海關報關單、相關認證過程文件(認證函、認證檢查結論等)為準。外文材料必須附有中文翻譯件及公證書,原件與中文翻譯件內容須一致,否則以中文翻譯件為準。
1.4 何為國家級獎項藥品
國家級獎項藥品是指獲得國家自然科學二等獎或國家科學技術進步二等獎及以上獎項的藥品,所獲獎項應與投標藥品質量密切相關,不包括獲得上述獎項的通用技術和其他通用研究成果的藥品。依據國務院頒發的國家自然科學或科技進步獎證書原件或者清晰彩色復印件進行認定。譬如:一個藥廠的緩控釋技術獲得國家科學技術進步二等獎,那么這個藥廠利用緩控釋技術生產的藥品劑型不屬于國家科學技術獎藥品,因為緩控釋技術是通用技術;原藥品生產企業生產的藥品獲得國家科學技術獎,如該藥品變更為別的生產企業生產,那么變更后的藥品也不屬于國家科學技術獎藥品(不包括生產企業更名)。
1.5 其他相關藥品質量屬性專業術語
國家一類新藥是指保護期或監測期內的國家一類新藥,以原國家食品藥品監督管理局核發的《國家新藥證書》和《藥品注冊批件》為準;單獨定價藥品、優質優價中成藥是指國家發展和改革委員會藥品定價文件確定的單獨定價藥品 (化學藥品和生物制品)或優質優價中成藥,以及省物價局對上述單獨定價藥品或優質優價中成藥根據差比價規則確定的其他規格藥品;中藥保密處方是指國家保密局和科技部共同頒布的中藥保密處方目錄中的藥品;標準首仿藥品是指生產企業為國家相關主管部門認定的,或首家取得國家藥品生產批件,同時為該藥品的質量標準起草單位,并持有新藥證書(或新藥批件)的國產化學藥品和生物制品;中藥保護品種是指獲得國家食品藥品監督管理局核發的《中藥保護品種證書》且在保護期內的藥品。
2 目前的質量層次劃分
針對全國31省的藥品招標采購方案中有關質量分層調查研究發現,一般分為2~6個層次,基本藥物質量分層也與之相似[8]。按照4個層次做了標準統計分析,其結果如下。
2.1 第一質量層次
經過統計分析包括保護期內的專利藥品、原研制藥品、國家級獎項藥品、一類新藥(包括化藥、生物制品以及中成藥)、中成藥組方專利(含中藥提取物專利)、單獨定價藥品和企業排名。分析結果見圖2。
由圖2統計分析可知,在31個省份的樣本數量中,有25個省份在第一質量層次中包含保護期內的專利藥品,所占比例最高約為80%,其次是原研制藥品所占比例接近50%,國家級獎項藥品、一類新藥和專利保護期內的中藥所占比例也較高,接近40%。單獨定價藥品所占比例較低,僅為10%,此外企業排名僅在1個省份出現。
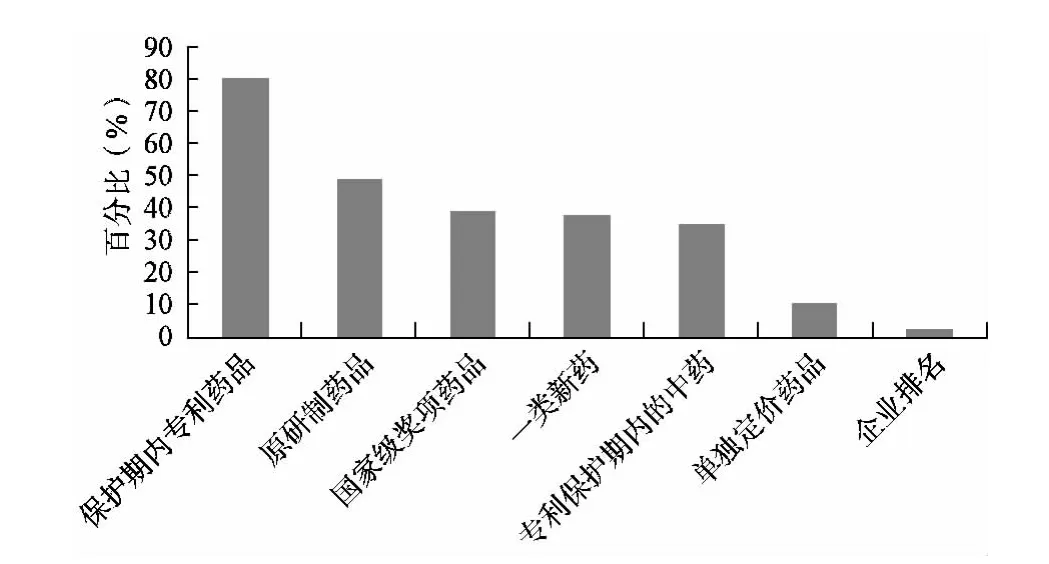
圖2 第一質量層次統計分析
2.2 第二質量層次
經過統計分析包括單獨定價藥品、原研制藥品、歐美日認證藥品、企業排名、一類新藥、專利保護期內的中藥(中成藥組方專利)、制備工藝專利(含劑型專利)、首仿藥品、國家級獎項藥品。分析結果見圖3。
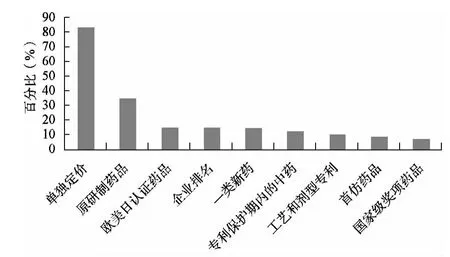
圖3 第二質量層次統計分析
由圖3統計分析可知,在31個省份的樣本數量中,有26個省份在第二質量層次中包含單獨定價藥品,所占比例最高,超過80%,原研制藥品所占比例為35%,歐美日認證藥品、企業排名和一類新藥所占比例為15%,專利保護期內的中藥比例為12.5%,制備工藝專利(含劑型專利)、首仿藥品和國家級獎項藥品所占比例接近或者低于10%。
2.3 第三質量層次
經過統計分析包括國內生產質量管理規范(GMP)藥品、歐美日認證藥品、制備工藝專利(含劑型專利)、企業排名、首仿藥品、專利保護期內的中藥、單獨定價藥品、原研制藥品等,分析結果見圖4。
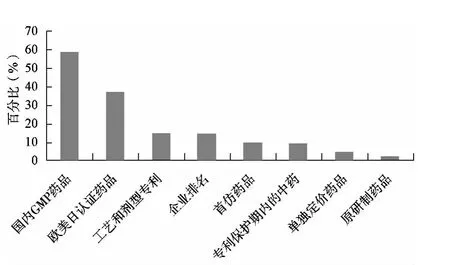
圖4 第三質量層次統計分析
由圖4統計分析可知,在31個省份的樣本數量中,有18個省份在第三質量層次中包含國內GMP藥品,所占比例接近60%,歐美日認證藥品(含相應國進口藥品)所占比例為37.5%,制備工藝專利(含劑型專利)和企業排名比例為15%,首仿藥品和專利保護期內的中藥比例為10%,單獨定價藥品與原研制藥品等所占比例更低。
2.4 第四質量層次
經過統計分析包括國內GMP藥品、企業排名、首仿藥品等,分析結果見圖5。

圖5 第四質量層次統計分析
由圖5統計分析可知,在31個省份的樣本數量中,有8個省份在第四質量層次中包含國內GMP藥品,所占比例約為25%,企業排名和首仿藥品等僅占一席之位。
3 建議藥品質量層次的劃分
由以上統計分析結果,再加上對藥品質量屬性專業術語解讀,認為針對藥品招標活動中藥品質量大致可以分為3層較為合適。因為,這樣更能體現藥品招標采購活動中“質量優先,價格合理”的宗旨。
3.1 第一質量層次
包括專利保護期內的藥品(化合物實體專利、有效成分組合專利、天然提取物專利、微生物及其代謝物專利以及中成藥組方專利)、國家保密處方藥品、原研制藥品、一類新藥以及國家級獎項藥品。
3.2 第二質量層次
包括單獨定價藥品、歐美日澳等認證藥品、制備工藝專利(含劑型專利)藥品、中藥保護藥品以及首仿藥品。
3.3 第三質量層次
包括國內GMP藥品(根據企業排名再細分兩個亞層)和其他國家地區進口藥品(不包括歐、美、日、澳)。其結構層次見表2。

表2 藥品質量層次劃分
由此可見,按以上層次劃分,不僅在全國范圍內統一了藥品質量層次劃分模式,而且明確了藥品質量層次的界定范圍,還統一了藥品質量層次歸類的屬性;不僅能體現藥品質量層次劃分的合理性和科學性,更能推動藥品集中招標采購切實貫徹落實“質量優先、價格合理”的原則。
4 討論
4.1 招標采購要對專利藥品區別和分類
根據專利法可知,專利一般分為發明專利、實用新型專利和外觀設計專利。專利藥品從廣義角度來講,應該是包括所有取得專利權的藥品。但是,不可回避的是專利藥品的質量、新穎性和創造性是存在很大差異的,因此,導致了各個省份針對專利藥品范疇界定大相徑庭。中成藥組方專利(含中藥提取物專利)和天然提取物專利是針對中藥和天然藥物保護的專利;微生物及其代謝物專利是針對生化藥物和生物制品保護的專利;化合物實體專利是針對化學藥物保護的專利。
4.2 招標采購納入專利藥品的知識范疇
藥物組合物專利與西藥處方專利相類似,一般包括有效成分組合專利、有效成分與輔助成分組合專利和僅改變配比關系的藥物組合物專利3種類型。有效成分組合專利一般是指藥品的全新組合,有效成分與輔助成分組合專利和僅改變配比關系的藥物組合物專利實質為藥物處方制劑專利,與制備工藝專利(含劑型專利)藥品相類似,與化合物實體專利、天然提取物專利和微生物及其代謝物專利等相比較低,所以大部分省份沒把它們納入狹義的專利藥品范疇。在1 932條數據中有一條叫做藥物專利,其實質是針對藥物某種適應證的保護,如該適應證是國內外均未批準的新適應癥,那么該藥物的適應證專利也應納入專利藥品范疇。上述所有專利都屬于發明專利,實用新型專利一般是針對使用藥品新型容器的專利保護,與藥品的安全性或者有效性有關,但是該類藥品的質量、新穎性和創造性較低;而外觀設計專利一般是針對藥品外包裝形狀或者圖案的專利保護,與藥品質量無直接相關性。幾乎沒有省份把這兩種類型的專利納入專利藥品范疇。專利是最能體現藥物質量層次的硬指標,幾乎所有創新都體現在知識產權,特別是專利中。因此,在專利藥品界定中一定要慎重,不僅要求我們具有一定的專利法相關知識,更要有深厚的專業知識背景。
4.3 招標采購如何體現“質量優先,價格合理”的宗旨
原研制藥品以我國發明專利證明文件或者以國家發展和改革委員會的有關文件標示為依據。如果該藥品在國外申請的專利過期,國家發展和改革委員會有關文件又沒標示為原研制,并且在我國又沒取得相關專利證明文件等,這種情況下該藥品可定性為原研制藥品。有些學者認為,雖然原研制藥品是專利保護期過后的認定,但是原研制藥的領先性仍然可以保持很久。因此,可以把專利藥品與原研制藥品劃分為同一質量層次。但是,專利藥品與原研制藥品確實存在本質上的差別,不僅如此每一層次中的不同質量專業術語,所定性的藥品質量也存在著差別,所以說上述的質量分層只是籠統的劃分,不能從根本上體現招標采購活動中“質量優先,價格合理”的宗旨。因此,如何真正實現這一宗旨,還需要繼續探索研究。
[1]王迪飛,田昕,邱心鏡.我國藥物招標采購制度分析[J].醫學與社會,2012,25(2):39-42.
[2]焦家泉.獨具特色的藥物管制——新加坡藥品宏觀管理簡介[J].中國衛生經濟,1995,14(6):62-63.
[3]蔡江南.管制與競爭:美國藥品市場中政府的作用[J].世界經濟文匯,2004(3):1-14.
[4]葉露,胡善聯.藥品價格及其管理政策的英國經驗啟示[J].中國藥房,2005,16(9):675-677.
[5]卓頤悉.英國藥品管理體制[J].全球科技經濟嘹望,1997(3):6-8.
[6]沈松泉,李軍.藥品招標和醫藥分開改革的實踐與思考[J].中國醫療保險,2012(3):68-70.
[7]劉文先.安徽構建規范性基本藥物采購新機制[J].行政管理改革,2012(4):23-26.
[8]謝敬敏,張方,仲昭乾.基本藥物招標采購存在的主要問題分析與建議[J].中國藥業,2012,21(6):1-2.

