空腹血糖調節受損與老年人認知功能障礙關聯性分析
楊松 吳德紅 蔡克濤 王開華 柯燕
空腹血糖調節受損(impaired fasting glucose,IFG)是血糖水平介于正常人與糖尿病患者血糖水平之間的一種中間代謝狀態,屬于糖調節受損,有學者將其稱為糖尿病前期。與糖尿病類似,IFG的發病機制也和B細胞功能受損及胰島素抵抗密切相關[1]。據國內外的最新報道,糖尿病及糖耐量受損即糖調節受損的另外一種狀態均與中老年人的認知功能障礙相關,可能是中老年人認知功能障礙的獨立危險因素[2-3]。但是,關于IFG與認知功能障礙之間的關系,目前國內外報道較少,且尚無一致的結論[4-5]。本文探討IFG與認知功能障礙之間的關系,以期為老年性癡呆的防治提供一定的依據。
1 對象與方法
1.1 研究對象 選擇2009年6月至2010年1月在我院體檢中心進行檢查或收住院的對象。所有對象均經過簡易智能狀態量表(mini-mental state examination,MMSE)[6]檢測認知功能情況。排除患有惡性腫瘤、心肝腎有嚴重功能不全的患者。研究共納入受試者186例,男92例,女94例。其中認知功能障礙組70例,年齡74~87歲,平均(78.31 ±9.25)歲,男32例,女38例,受教育年限為(3.56±2.85)年;認知功能正常組患者116例,年齡71~82歲,平均(71.24 ±6.03)歲,男60例,女56例,受教育年限為(6.46 ±3.01)年。2組之間年齡、受教育年限差異有統計學意義(P <0.05)。
1.2 研究方法
1.2.1 研究內容:制定老年人認知功能調查表,納入以下可能相關的影響因素:年齡、性別、受教育年限、總蛋白水平、IFG、腦卒中、高血壓、冠心病、高脂血癥、吸煙、飲酒、是否進行規律的體育鍛煉等。以上疾病的診斷必須有據可依,如既往外院的診斷,或者本次來院檢查得出的診斷。其中,IFG指血糖水平在7.8~11.0 mmol/L。
1.2.2 認知功能情況的檢測:采用中文版MMSE進行檢測,該量表有19項,分為定向力、記憶力、注意力及計算力、回憶、語言能力等5個分量表。每題回答正確得1分,回答錯誤或不知道為0分,總分為0~30分,得分越高表示認知能力越好。張明圓等[7]對MMSE量表進一步研究,認為中國老年人群認知功能障礙標準為:文盲組MMSE<17分,小學文化組MMSE<20分,中學及以上組MMSE<24分。
1.2.3 生化指標的檢測:血液生化采用日本產奧林巴斯AU640全自動生化儀,血常規采用日本產Sysmex XE-5000血細胞分析儀及原裝配套試劑檢測。
1.3 統計學方法 所有數據均采用SPSS 16.0軟件進行分析。計量資料用±s表示,組間比較采用t檢驗;計數資料用行×列表的卡方檢驗;多因素模型采用logistic回歸分析。以P<0.05為差異有統計學意義。
2 結果
2.1 IFG與老年人認知功能障礙的基線資料分析與認知功能正常組相比較,認知功能障礙組年齡較大、受教育年限偏短,IFG及高血壓的發生率高,差異有統計學意義(P<0.05或P<0.01)。其他因素均未見明顯統計學差異。見表1。
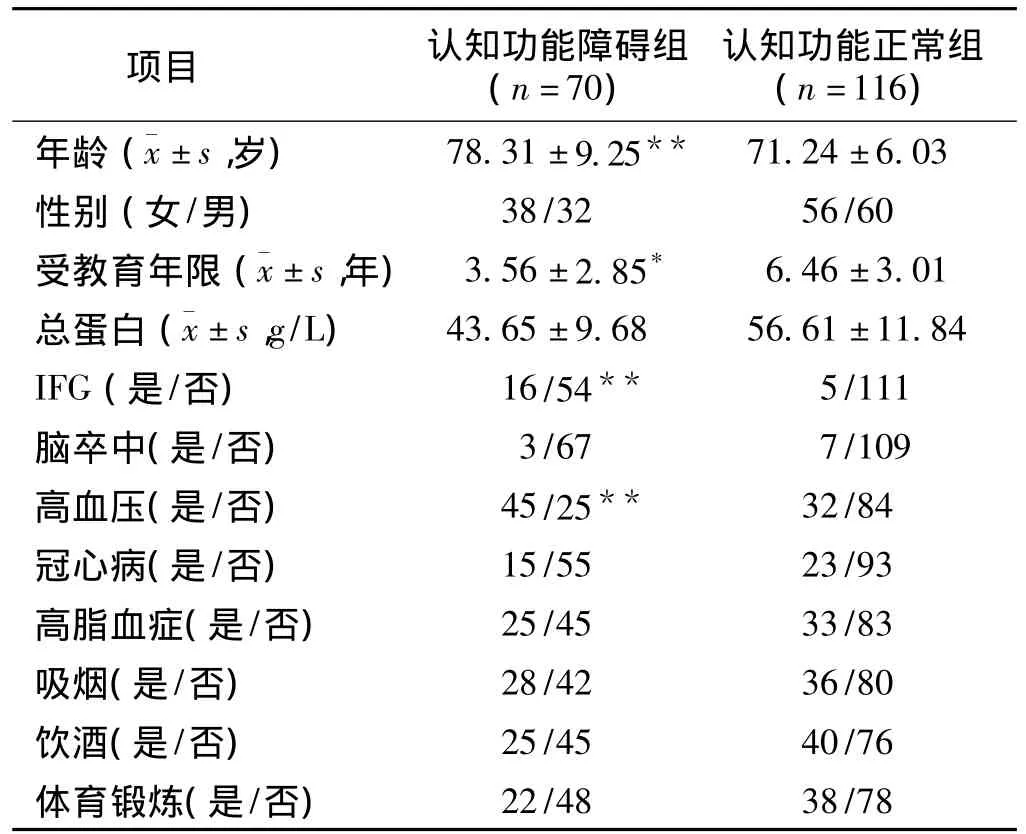
表1 2組基線資料比較
2.2 IFG與老年人認知功能障礙的關系 將年齡、性別、受教育年限、總蛋白水平、是否存在IFG、是否有腦卒中、是否有高血壓、是否有冠心病、是否有高脂血癥、是否吸煙、是否有飲酒、是否進行規律的體育鍛煉等因素納入 logistic回歸方程中,結果顯示:年齡(P<0.001)及IFG(P=0.038)等與老年人的認知功能障礙密切相關,是其獨立的危險因素。見表2。

表2 IFG與老年人認知功能障礙關系的多因素分析
3 討論
隨著年齡增長,老年人認知功能逐漸下降。據統計,62%左右的>65歲的老年人患有認知功能障礙或老年性癡呆。這些患者的認知功能障礙不僅導致了老年人日常生活能力的缺失,還對其家庭以及社會產生巨大的負面影響,已經成為嚴重危害老年人身心健康的公共衛生問題[8]。認知功能障礙是老年期癡呆重要的早期臨床表現。研究老年人認知功能下降的危險因素,才有可能對老年性癡呆做出早期診斷、治療和干預。
國內外相關文獻證實:年齡、性別、教育水平、吸煙、飲酒,以及某些軀體疾病如腦卒中、高血壓及高脂血癥均可能與老年人的認知功能下降相關。最新研究認為糖尿病和糖耐量受損均是老年人認知功能障礙的危險因素[2-3,9]。與糖耐量受損類似,IFG也是糖調節受損的一種類型,在臺灣人的研究中發現2種類型患者對胰島素敏感性方面的改變相當,而IFG提示胰島B細胞功能受損更嚴重[9]。IFG和糖耐量受損患者早期胰島素分泌均下降,但糖耐量受損者晚期胰島素分泌也受損;糖耐量受損患者具有明顯肌肉胰島素抵抗和中度肝胰島素抵抗,而IFG患者肝胰島素抵抗明顯,肌肉對胰島素敏感性接近正常[10]。本研究對老年人認知功能障礙的相關因素進行了研究,結果顯示IFG也是老年人認知功能障礙的一項危險因素。國外的研究也表明IFG是老年認知功能障礙的代謝標志物之一[5],并且是老年婦女認知功能障礙的風險因素[4]。這些結果均與本研究結果一致。
目前關于糖尿病與老年人認知功能的關聯機制尚不清楚,可能的機制有:腦血管病變[11],胰島素抵抗[12],晚期的糖化終產物[13],炎癥反應[14],氧化應激[15]和胰島素、β-淀粉樣蛋白競爭胰島素降解酶[16]等。對糖尿病動物模型的腦部研究發現,海馬錐體神經元的樹突萎縮,棘密度下降,神經脆弱性增加,神經元減少,這些特征均與阿爾茨海默病及動物模型一致[17-18]。而胰島素及相關治療能逆轉這些變化[19]。臨床研究發現糖尿病能引起腦部的功能微變化,如腦白質疏松、一般影像學檢查難以檢出的微病變,已有研究證實這些亞疾病可能與老年認知功能下降相關[20]。
IFG有著與糖尿病相似的病理生理特點,如高血糖、胰島素抵抗、糖基化終產物及脂質代謝紊亂;多數IFG患者存在B細胞功能減退及胰島素抵抗,與糖耐量正常人群相比,IFG患者的血管病變危險性顯著增加;IFG患者常合并多種心腦血管疾病的危險因素,如高血壓、高血脂、肥胖及代謝綜合征,這些疾病或多或少與認知功能的下降相關。鑒于IFG是糖尿病前期,早期診斷和預防,不僅對糖尿病的治療有重要意義,而且對老年認知功能障礙也能起預防作用。我們的研究明確了IFG也是老年人認知功能障礙的一項危險因素,為預防老年性認知功能障礙提供了理論基礎。
[1]American Diabetes Association.The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus:followup report on the diagnosis of diabetes mellitus[J].Diabetes Care,2003,26(Suppl 1):3160-3167.
[2]Kalmijn S,Feskens EJM,Launer LJ,et al.Glucose intolerance,hyperinsulinemia and cognitive function in a general population of elderly men[J].Diabetologia,1995,38(9):1096-1102.
[3]樊華.糖尿病與阿爾茨海默病發病風險相關性研究進展[J].實用老年醫學,2010,24(4):342-345.
[4]Yaffe K,Blackwell T,Kanaya AM,et al.Diabetes,impaired fasting glucose,and development of cognitive impairment in older women [J].Neurology,2004,63(4):658-663.
[5]Bonito Di P,Fraia Di L,Gennaro Di L,et al.Impact of impaired fasting glucose and other metabolic factors on cognitive function in elderly people[J].Nutr Metab Cadiovascul Dis,2007,17(3):203-208.
[6]Folstein MF,Folstein SE,McHugh PR.“Mini-mental state”.A practical method for grading the cognitive state of patients for the clinician [J].J Psychiatr Res,1975,12(3):189-198.
[7]張明圓.精神科評定量表手冊[M].長沙:湖南科學技術出版社,1998:183-191.
[8]The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus.Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus[J].Diabetes Care,1997,20(7):1183-1197.
[9]Li CL,Tsai ST,Chou P.Relative role of insulin resistance and beta-cell dysfunction in the progression to type 2 diabetes-The Kinmen Study[J].Diabetes Res Clin Prac,2003,59(3):225-232.
[10]Abdul-Ghani MA,Tripathy D,DeFronzo RA.Contributions of beta-cell dysfunction and insulin resistance to the pathogenesis of impaired glucose tolerance and impaired fasting glucose[J].Diabetes Care,2006,29(5):1130-1139.
[11]Miyakawa T.Vascular pathology in Alzheimer's disease[J].Psychogeriatrics,2010,10(1):39-44.
[12]Craft S,Watson GS.Insulin and neurodegenerative disease:shared and specific mechanisms[J].Lancet Neurol,2004,3(3):169-178.
[13]Munch G,Schinzel R,Loske C,et al.Alzheimer's disease—synergistic effects of glucose deficit,oxidative stress and advanced glycation endproducts[J].J Neural Transm,1998,105(4/5):439-461.
[14]Tuppo EE, AriasHR. Therole ofinflammation in Alzheimer's disease[J].Int J Biochem Cell Biol,2005,37(2):289-305.
[15]Kapogiannis D,Mattson MP.Disrupted energy metabolism and neuronal circuitdysfunction in cognitiveimpairmentand Alzheimer's disease[J].Lancet Neurol,2011,10(2):187-198.
[16]Fernandez-Gamba A,Leal MC,Morelli L,et al.Insulin-degrading enzyme:structure-function relationship and its possible roles in health and disease[J].Curr Pharm Des,2009,15(31):3644-3655.
[17]Alvarez EO,Beauquis J,Revsin Y,et al.Cognitive dysfunction and hippocampal changes in experimental type 1 diabetes[J].Behav Brain Res,2009,198(1):224-230.
[18]Kim YB,Kotani K,Ciaraldi TP,et al.Insulin-stimulated protein kinase C lambda/zeta activity is reduced in skeletal muscle of humans with obesity and type 2 diabetes:reversal with weight reduction[J].Diabetes,2003,52(8):1935-1942.
[19]Bomba M,Ciavardelli D,Silvestri E,et al.Exenatide promotes cognitive enhancement and positive brain metabolic changes in PS1-KI mice but has no effects in 3xTg-AD animals[J].Cell Death Dis,2013,4:e612.
[20]張微微.心腦血管疾病危險因素與認知功能障礙[J].中華內科雜志,2005,44(10):797-798.

