粘紅酵母H810產油脂培養基、發酵條件優化及其油脂組分的分析
魏 濤,王麗娟,毛多斌,陶 靜,劉蘇萌,馬歌麗,何培新
(鄭州輕工業學院 食品與生物工程學院,河南 鄭州 450002)
一些微生物在一定條件下利用碳水化合物、碳氫化合物和普通油脂等碳源在菌體內合成并積累油脂,油脂含量超過總生物量的20%,即稱為產油微生物。產油微生物所產生積累的油脂稱為微生物油脂[1-3]。目前已報道霉菌、酵母菌、細菌以及藻類的某些菌株都可以產生大量油脂,但以斯達油脂酵母菌(Lipomyces starkeyi)、粘紅酵母屬(Rhodotorula glutinis)、曲霉屬(Aspergillus)以及毛霉屬(Mucor)等真核微生物常見[4]。隨著化石能源的短缺,石油價格的不斷攀升,尋找新的可再生資源成為當今世界各國的一個重要議題。通過生物化工和微生物發酵制取能源產品與化學品,部分替代化石資源,將是多渠道開發可再生資源的必然趨勢。利用微生物生產油脂在開發新油脂資源方面具有良好的發展前景,因此探索研究微生物積累油脂具有重要的現實意義[5-6]。
利用微生物生產油脂具有不受季節和氣候的影響、生產原料來源廣泛、油脂含量高、質量穩定、可連續進行大規模生產和生產周期短等優點[7-8]。本研究以粘紅酵母菌H810為出發菌株,通過單因素和正交試驗優化粘紅酵母菌H810產油脂培養基的組成和培養條件,分析了在優化條件下油脂成分,旨在提高粘紅酵母菌H810生物量和油脂產量,為其進一步研究打下基礎。
1 材料與方法
1.1 材料與培養基
粘紅酵母菌H810,本實驗室選育菌種。葡萄糖、酵母膏和蛋白胨均購自上海生工生物工程技術服務有限公司;所用化學試劑乙醚、甲醇等購自天津市德恩化學試劑有限公司,均為分析純。
種子斜面保藏酵母浸出粉胨葡萄糖(yeast extract pep tone dextrose,YEPD)培養基:葡萄糖20g/L,酵母膏10g/L,蛋白胨10g/L,瓊脂20g/L,自然pH;
液體種子培養基:葡萄糖20g/L,酵母粉0.5g/L,硫酸銨5g/L,磷酸二氫鉀1g/L,七水合硫酸鎂0.5g/L,自然pH;
搖瓶發酵基礎培養基:葡萄糖70g/L,硫酸銨1g/L,酵母膏0.5g/L,磷酸二氫鉀1g/L,七水合硫酸鎂1g/L,自然pH。
以上培養基均在121℃飽和蒸汽下滅菌15min。
1.2 儀器與設備
HZQ-Y電熱鼓風干燥箱:上海左科儀器設備有限公司;SHB-3循環水多用真空泵:鄭州杜甫儀器廠;SCT-06索氏提取儀:上海洪紀儀器設備有限公司;LA-230S型電子天平:北京賽多利斯有限公司;GC6890氣相色譜:美國安捷倫公司。
1.3 方法
1.3.1 粘紅酵母的培養
培養斜面上將一環活化菌體接于80mL液體種子培養基中,28℃、180 r/min搖床培養20h~28h。以10%接種量接種于80mL發酵基礎培養基中,在相同條件下培養96h。
1.3.2 油脂提取與測定
粘紅酵母生物量測定:將培養好的菌體8000r/min離心15min,去除上清液,得到濕菌體,110℃烘干至質量恒定,自然冷卻至室溫后稱質量,即為菌體干質量,以g干菌體/L發酵液表示菌體生物量。
菌體油脂的含量測定:參照索氏抽提法直接進行油脂抽提[9-10]。菌體烘干,研磨粉碎后取一定質量的干菌體粉末用濾紙包好,放入索氏抽提器的提取管中,以60℃~90℃沸程的石油醚為抽提劑,水浴提取6h~8h,取下抽提瓶,在93℃水浴中揮發掉殘留石油醚,再于95℃~105℃烘干2h,準確稱量粗油脂質量。油脂含量按下式計算:

式中:X 為樣品中油脂的質量分數,%;m為樣品的質量,g;m0為油脂抽提瓶的質量,g;m1為油脂及油脂抽提瓶的質量,g。
油脂脂肪酸組分分析:采用氣相色譜法分析油脂脂肪酸組分。氣相色譜(GC)條件[11-12]:GC6890氣相色譜儀進行分析,氮氣為載氣,毛細管色譜柱HP-5MS(30m×0.25mm×0.2μm),柱溫初溫200℃,程序升溫,以5℃/min速度升至220℃,保溫30min,進樣口溫度240℃,分流比1∶25,進樣體積2μL。
2 結果與討論
2.1 碳源的選擇
碳源是微生物生長繁殖最重要的營養成分,而粘紅酵母H810對不同碳源的利用能力和速度是不同的,本研究考察了在葡萄糖、木糖、淀粉、蔗糖、阿拉伯糖、乳糖和麥芽糖在不同碳源下(碳源添加量5%),粘紅酵母H810菌體生物量和細胞油脂含量的變化情況,結果見圖1。

圖1 不同碳源對粘紅酵母H810菌體生物量和油脂合成的影響Fig.1 Effect of carbon sources on biomass and lipid content ofRhodotorula glutinis H810
由圖1可知,粘紅酵母H810利用碳源的能力為葡萄糖>木糖>阿拉伯糖>蔗糖>淀粉>乳糖>麥芽糖。葡萄糖是菌體細胞生長的最佳碳源,也是菌體油脂合成的最適碳源,添加5%葡萄糖,其培養液生物量達到34g/L,菌體油脂含量達到49%。
2.2 氮源的選擇
適宜種類和濃度的氮源不僅能促進粘紅酵母菌H810高效利用葡萄糖、木糖等碳源,而且可以減少次級代謝產物的形成。由圖2可知,不同氮源(氮源添加量5%)對粘紅酵母H810生長影響較大。

圖2 不同氮源對粘紅酵母H810菌體生物量和油脂合成的影響Fig.2 Effect of nitrogen sources on biomass and lipid content ofRhodotorula glutinis H810
由圖2可知,粘紅酵母H810利用氮源的能力為酵母膏>磷酸二氫銨>硫酸銨>蛋白胨>硝酸銨>尿素。酵母膏是粘紅酵母H810菌體細胞生長和合成油脂的最適氮源,添加5%酵母膏,其培養液生物量達到32g/L,菌體油脂含量達到47%。
2.3 碳氮比(C/N)的選擇
微生物細胞生長需要充分的氮源,而油脂的合成一般在氮源耗盡而碳源豐富的條件下,C/N的高低對菌體細胞的生長和油脂的合成影響較大[13]。實驗選擇葡萄糖為碳源,酵母膏為氮源,考察不同的C/N對菌體生物量和油脂含量的影響。由表1可知,C/N為40時,粘紅酵母H810的菌體生物量和油脂含量為最高,過高和過低的比例都不適合酵母菌體生長和油脂產生。

表1 C/N對粘紅酵母H810菌體生物量和油脂合成的影響Table 1 Effect of C/N on biomass and lipid content ofRhodotorula glutinis H810
2.4 培養溫度
培養溫度是影響粘紅酵母H810油脂合成的一個重要條件。由圖3可知,在28℃時,粘紅酵母H810產油脂率最高,溫度過高或過低油脂產量均明顯下降。培養溫度28℃作為粘紅酵母H810的最佳產脂溫度。

圖3 不同溫度對粘紅酵母H810菌體生物量和油脂合成的影響Fig.3 Effect of culture temperatures on biomass and lipid content ofRhodotorula glutinis H810
2.5 培養基初始pH值
發酵培養基初始pH值是影響粘紅酵母H810菌體生長和油脂產量的一個重要條件,合適的pH值可以促進產油酵母的生物量和油脂合成[14-15]。由圖4可知,在初始pH值高于或低于6.8時,粘紅酵母H810生物量和油脂產量均明顯下降,所以6.8是粘紅酵母H810的最佳生長和產脂pH值。

圖4 不同pH值對粘紅酵母H810菌體生物量和油脂合成的影響Fig.4 Effect of pH value on biomass and lipid content ofRhodotorula glutinis H810
2.6 接種量
接種量是影響微生物油脂產量的重要因素,接種量不同,菌體生物量和油脂產量也不同。接種量過大,菌體生長期細胞數量過多,單細胞油脂產量反而下降,細胞內積存的油脂過多,又會使菌體失去增殖能力,因此應使微生物細胞處于一定數量,以保持菌體的增殖能力和產油生理狀態。由圖5可知,粘紅酵母H810的接種量為6%時,菌體生物量和油脂含量為最高,接種量過大,油脂合成減少。

圖5 不同接種量對粘紅酵母H810菌體生物量和油脂合成的影響Fig.5 Effect of inoculumu on biomass and lipid content ofRhodotorula glutinis H810
2.7 發酵條件優化正交試驗
在單因素試驗基礎上,以油脂含量為考察指標,選擇碳氮比C/N、溫度、pH值和接種量4個主要影響因素作4因素3水平L9(34)的正交試驗設計,對粘紅酵母H810產油脂最佳發酵條件進行優化篩選[8],正交試驗結果見表2,方差分析結果見表3。
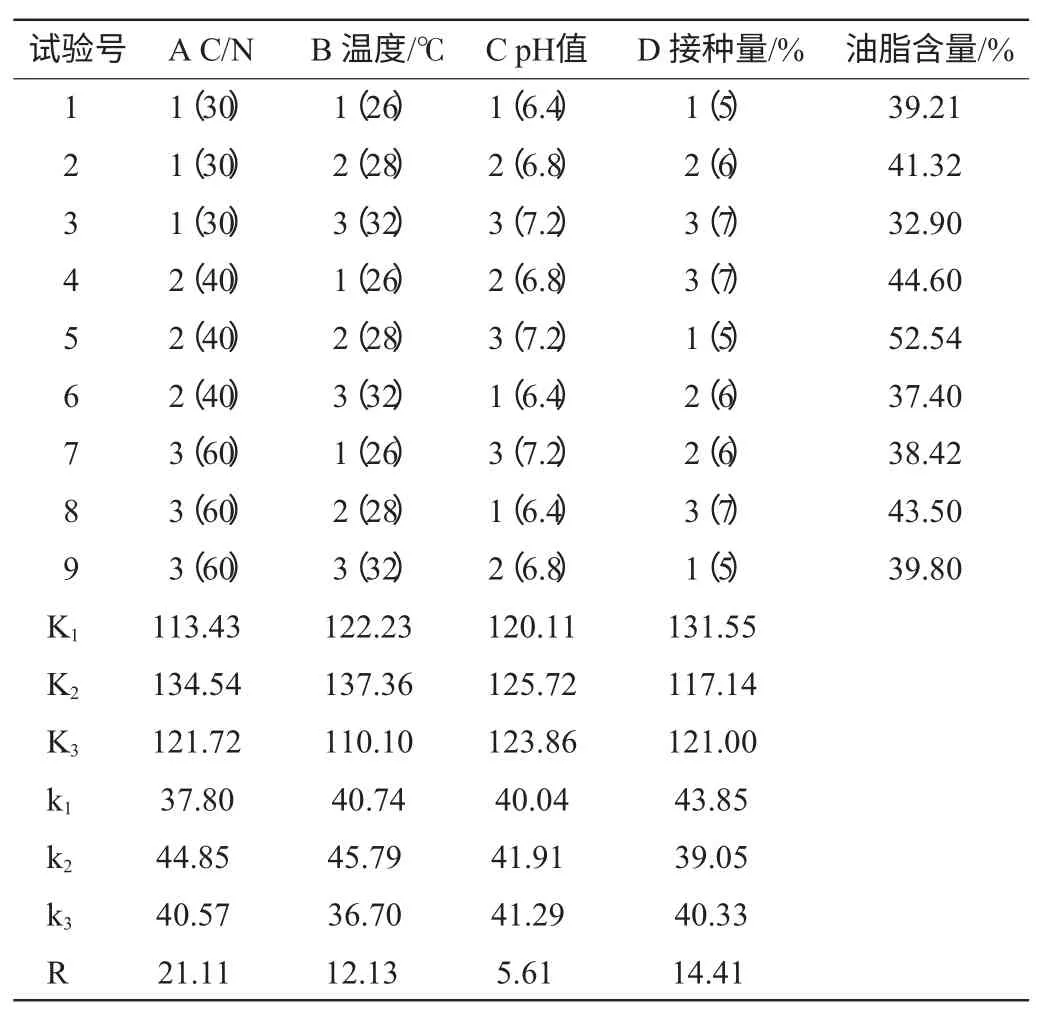
表2 粘紅酵母H810發酵條件優化正交試驗結果與分析Table 2 Results and analysis of orthogonal experiments for fermentation condition ofRhodotorula glutinis H810

表3 粘紅酵母H810產油脂最佳發酵條件正交試驗結果方差分析Table 3 Variance analysis of orthogonal experiment of lipid content ofRhodotorula glutinis H810
從表2極差結果得出,影響粘紅酵母H810油脂含量的因素大小為RA>RD>RB>RC,即碳氮比C/N>接種量>溫度>pH。表3方差分析結果表明,碳氮比C/N和培養溫度對油脂含量影響極顯著;接種量對油脂含量影響顯著,培養基初始pH對油脂含量影響不顯著。最佳提取條件為A2B2C2D1,即碳氮比C/N為40,接種量為5%,培養溫度為28℃,培養初始pH值為6.8。在此最佳條件下進行驗證試驗,粘紅酵母H810油脂含量為56.88%。
2.8 油脂組分分析
菌株H810在優化培養條件下油脂組分分析見表4,油脂中以油酸47.95%為主,其次為亞油酸12.96%、棕櫚酸12.34%、α-亞麻酸11.76%和γ-亞麻酸7.30%,多不飽和脂肪酸總含量92%以上,在醫藥保健行業具有重要工業應用前景。

表4 菌株H810所產油脂組分分析Table 4 Analysis of lipid content produced byRhodotorula glutinis H810
3 結論
本研究在以碳氮比C/N、培養溫度、培養pH和接種量各單因素試驗基礎上,采用正交試驗得出了粘紅酵母H810產油脂最佳發酵條件,即碳氮比C/N為40,接種量為5%,培養溫度為28℃和培養pH值為6.8,在此條件下粘紅酵母H810油脂含量達到56.88%,比文獻報道高出10%左右[7]。在該條件下粘紅酵母H810油脂成分主要包括油酸47.95%、亞油酸12.96%、棕櫚酸12.34%、α-亞麻酸11.76%和γ-亞麻酸7.30%。采用該工藝發酵粘紅酵母H810生產微生物油脂具有一定的應用價值,也為大規模生產微生物油脂和研究油脂的不飽和性能提供了研究基礎。
[1]LIU B,SUN Y,LI Y H,et al.Pregress on microbial glyceride biosynthesis and metabolic regulation in oleaginous microorganisms[J].Acta Microbiol Sinica,2005,45(1):153-156.
[2]PAPANIKOLAOU S,KOMAITIS M,AGGELIS G,et al.Single cell oil(SCO) production by mortierella isabellin grown on high-sugar cotent media[J].Bioresource Technol,2004,95(3):287-291.
[3]徐 鑫,段仰凱,董曉宇,等.斯達氏油脂酵母產油脂培養基及產油條件的優化[J].太陽能學報,2007,28(8):857-860.
[4]李永紅,劉 波,趙宗保,等.圓紅冬孢酵母菌發酵產油脂培養基及發酵條件的優化研究[J].生物工程學報,2006,22(4):650-656.
[5]惠豐立,張彩瑩,褚學英,等.戊糖發酵產油酵母菌的篩選及油脂組分分析[J].太陽能學報,2009,30(1):107-811.
[6]馬麗娟,王海明,溫玉風,等.絲狀真菌發酵產油脂培養基及發酵條件的優化研究[J].長春工業大學學報:自然科學版,2008,29(4):459-463.
[7]劉 玲,金 雨.紅酵母產油脂誘變育種及發酵條件的研究[J].糧食與食品工業,2005,12(6):17-21.
[8]李 建,劉宏娟,張建安,等.微生物油脂研究進展及展望[J].現代化工,2007,27(11):133-136.
[9]許安邦,林維宣.食品分析[M].北京:中國輕工業出版社,1998:139-140.
[10]林維宣.實驗設計方法[M].大連:大連海事大學出版社,1995:118-156.
[11]魏 濤,王麗娟,張 飛,等.一株高產油脂酵母菌株的分離鑒定及其油脂組分的分析[J].中國釀造,2013,32(7):50-52.
[12]張世鵬,劉品何,秦偉帥,等.麥飯石對白蘭地中揮發性物質的影響[J].中國釀造,2012,31(10):116-119.
[13]張 卉,呂秀芳,孫曉雪.廣譜碳源產油酵母菌的篩選及培養基優化[J].沈陽化工學院學報,2009,23(2):124-128.
[14]李永紅,劉 波,孫 艷,等.廣譜碳源產油酵母菌的篩選[J].中國生物工程雜志,2005,25(12):39-44.
[15]高 媛,李元媛,王常高,等.高產油脂酵母的篩選及發酵條件的研究[J].化學與生物工程,2010,27(1):55-58.

