乳酸菌發酵生產乳酸鈣的條件優化
陳文潔,張京震,郭建峰*
(1.中北大學 化工與環境學院,山西 太原 030051;2.山西省經濟建設投資有限公司,山西 太原 030012)
乳酸鈣是一種重要的化工原料,主要應用于食品、醫藥和飼料行業。在食品工業中,乳酸鈣作為安全的食品添加劑,可用于固化劑、風味增強劑、調味劑、配料、食品松軟劑、營養供應品及穩定劑和增稠劑使用;在醫藥行業是人和動物的主要補鈣劑;在輕工行業作為抗菌劑和除垢劑用于牙膏中[1-3]。
由于目前乳酸鈣的制備成本偏高,有效地降低乳酸鈣生產成本對其市場應用具有積極的推動作用[4-5]。工業中淀粉廢水的排放量與日俱增,會污染環境且造成資源浪費[6]。為了充分利用廢水中的淀粉等資源,降低乳酸鈣生產成本,試驗通過葡萄糖作為乳酸菌生長發酵的碳源,對乳酸菌生長和發酵條件進行優化,探索最優發酵工藝條件,提高乳酸鈣產量,為后續研究利用淀粉廢水發酵提供理論依據和試驗基礎條件。以其為后期的應用探索合適發酵條件。
1 材料與方法
1.1 材料與試劑
1.1.1 試驗菌種
保加利亞乳桿菌(Lactobacillus bulgaricus):試驗室儲藏;脫脂乳粉為市售。
1.1.2 培養基
MRS固體培養基:在MRS培養基中加入1.5%瓊脂。發酵培養基:葡萄糖,酵母膏,MgSO4·7H2O,磷酸二氫鉀。保藏培養基:在MRS培養基中加入1%的CaCO3。
1.2 儀器與設備
BS210電子天平:上海精密科學有限公司;YXQ-SG46-280S手提式高壓蒸汽滅菌鍋:上海博訊實業有限公司醫療設備廠;SW-CJ-2F無菌操作臺:寧波科森凈化器制造有限公司;DHP060型恒溫培養箱:上海飛越試驗儀器有限公司;PHS-3C精密pH計:杭州奧利龍有限公司;721可見分光光度計:上海第三分析儀器廠。
1.3 方法
1.3.1 培養方法
乳酸菌的活化:取一環生長良好的斜面種子,接入液體活化培養基中,至于36℃培養箱中培養,連續活化2次備用。乳酸菌富集培養:在無菌條件下,用移液管吸取一定量活化后的菌懸液,加入MRS培養基中,置于恒溫培養箱中培養。
乳酸菌發酵產酸培養:在250mL錐形瓶中加入50mL發酵培養基,在無菌條件下,用移液管吸取一定量活化后的菌懸液,加入發酵培養基中,置于恒溫培養箱中培養。
發酵法制取乳酸鈣:將活化后的菌懸液接入添加有碳酸鈣的發酵培養基中,在試驗所得的最優條件下進行培養。
1.3.2 分析方法
(1)乳酸菌生長情況測定
用移液管吸取培養一定時間后的菌懸液,稀釋5~10倍后,使用721分光光度計在波長660nm處測定其吸光度值。
(2)發酵產酸量測定
用0.1mol/L的NaOH對發酵液進行滴定,溴甲酚紫為指示劑,溶液由橙黃色變為藍紫色即達到滴定終點[7]。記錄滴定消耗NaOH的體積數,mL。
乳酸產量按下式計算:
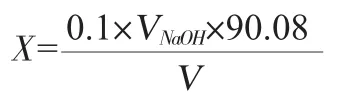
式中:X 為乳酸產量,g/L;VNaOH為滴定消耗的氫氧化鈉體積數,mL;90.08 為乳酸的摩爾質量,g/mol;V為樣品的體積,mL。
(3)乳酸鈣總量的測定
本試驗通過乙二胺四乙酸二鈉中和滴定法測定所產乳酸鈣的總量[8]。
1.3.3 乳酸鈣的提取方法
將在最佳條件下獲得的發酵液過濾,以除去菌體及未反應的碳酸鈣,在濾液中加入氧化鈣調pH值至12~13,并加入0.4%的MgSO4沉聚菌體蛋白[9-11],在80℃,攪拌反應30min后,趁熱抽濾得乳酸鈣母液,再將母液進行加熱濃縮,當母液中乳酸鈣質量濃度達到145g/L~15g/L[12-13]時,冷卻靜置結晶24h。分離晶體和母液,由于乳酸鈣在水中的溶解度較大,結晶母液中還留有大量的乳酸鈣,濃縮后再次結晶,合并晶體[14]。
1.3.4 乳酸菌生長條件單因素試驗
(1)乳酸菌生長曲線的測定
制備7瓶50mL相同條件的MRS培養基,按2%的接種量接種,30℃條件下進行培養,在2h、5h、8h、12h、15h、20h、24h 后分別取出一瓶測其OD值,以確定菌種生長情況。
(2)不同pH值對乳酸菌生長情況影響
在6個裝有50mL MRS培養基的錐形瓶中,添加氫氧化鈉或乙酸調整培養基的起始pH值,分別為3.2、4.0、5.0、6.0、7.0、8.0,按2%的接種量接種,在30℃條件下進行培養,12h后測其生長情況。
(3)不同的培養溫度對乳酸菌生長情況的影響
將裝有50mL MRS培養基的錐形瓶滅菌后,按2%的接種量接種,分別放置于28℃、30℃、32℃、36℃、38℃、40℃、42℃條件下培養12h后,測量生長情況。
(4)不同的接種量對乳酸菌生長情況的影響
在裝有50mL MRS培養基的錐形瓶中,用滅菌后的移液管分別接入2%、5%、8%、10%、12%、15%的乳酸菌菌懸液,在之前試驗確定的最佳溫度條件下培養12h后測其生長情況。
(5)不同的裝液量對乳酸菌生長情況的影響
分別往6個250mL的錐形瓶中加入25mL、50mL、75mL、100mL、150mL、200mL的MRS培養基,并接入2%的乳酸菌菌懸液[15],置于之前試驗確定的最佳溫度下培養12h后,分別測其生長情況。
1.3.5 發酵條件優化正交試驗
將酵母膏、MgSO4·7H2O、磷酸二氫鉀的用量固定,以酸度為考察指標,優化溫度(A)、時間(B)、接種量(C)、葡萄糖含量(D)和初始pH值(E)為5個因素,設計L16(45)正交試驗分析發酵培養基優化結果,因素水平見表1。
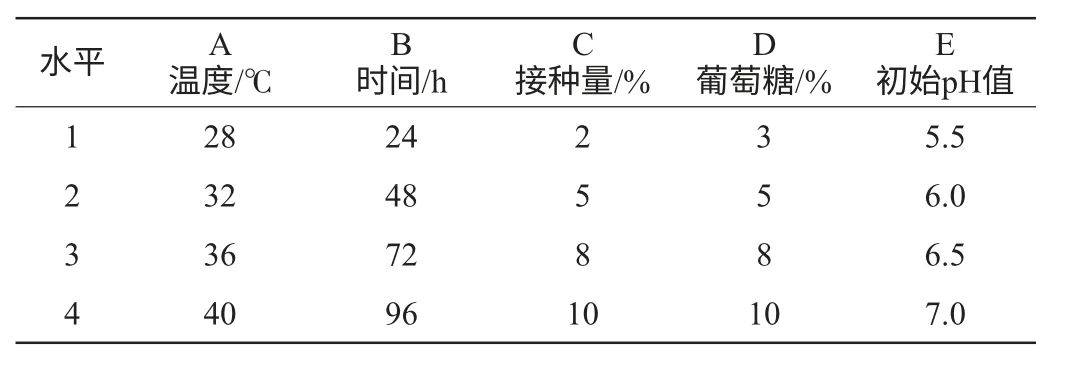
表1 發酵培養基優化L16(45)正交試驗因素水平Table 1 Factors and levels of the L16(45) orthogonal experiment for fermentation medium optimization
2 結果與分析
2.1 生長曲線的測定
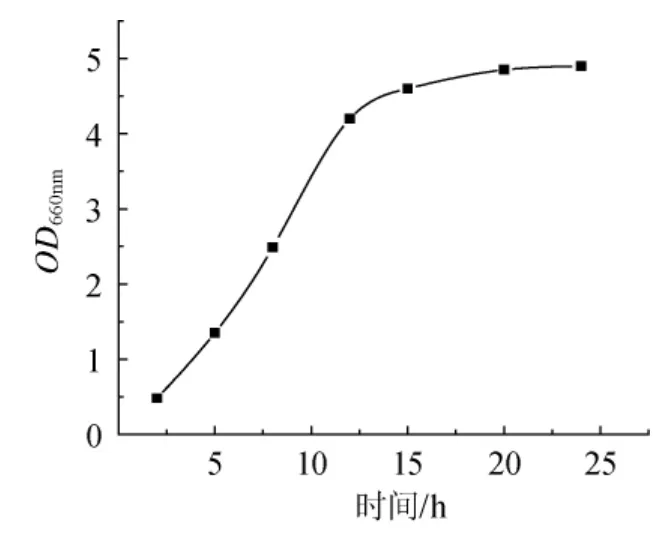
圖1 菌種生長曲線Fig.1 The growth curve of lactic acid bacteria
菌液的OD值在一定程度上反映了菌體的生長情況,由圖1可知,菌體經過較短的延遲期后即進入對數生長期,到12h時達到較高水平,此后雖然OD值一直增大但變化幅度趨于平穩,表明菌株此時進入穩定期。
2.2 乳酸菌生長條件單因素試驗
2.2.1 初始pH值的影響
pH值是影響微生物生長代謝的一個重要因素,乳酸菌在生長過程中,對pH值有著嚴格的要求。37℃培養12h后,測其OD值,試驗結果見圖2。
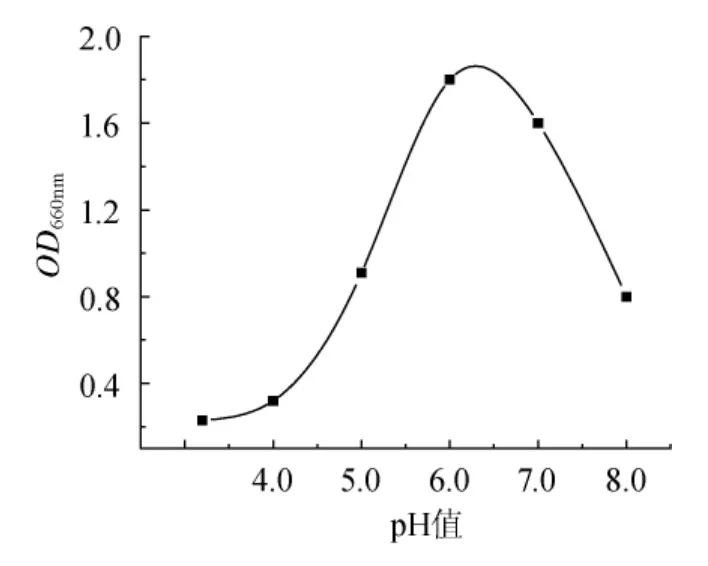
圖2 pH值對乳酸菌生長的影響Fig.2 Effect of pH value on the growth of lactic acid bacteria
由圖2可知,在一定的pH值范圍內,初始pH值越高,菌種生長越好,在pH值為6.0時,菌種達到最佳生長條件,隨后pH值的增大會抑制菌種生長。因此,之后發酵優化中初始pH值選取在5.5~7.0的范圍內。由于pH值在自然情況下,生長情況尚好,為方便起見,后期試驗采用自然條件的pH值。
2.2.2 裝液量的影響
裝液量將直接影響培養基里的供氧量,過多將影響菌體的呼吸作用,菌體的生長將受到抑制,過少將浪費培養基里的氧氣。本試驗選取了10%~80%的裝液量做單因素試驗,37℃培養12h后,測其OD值,結果見圖3。
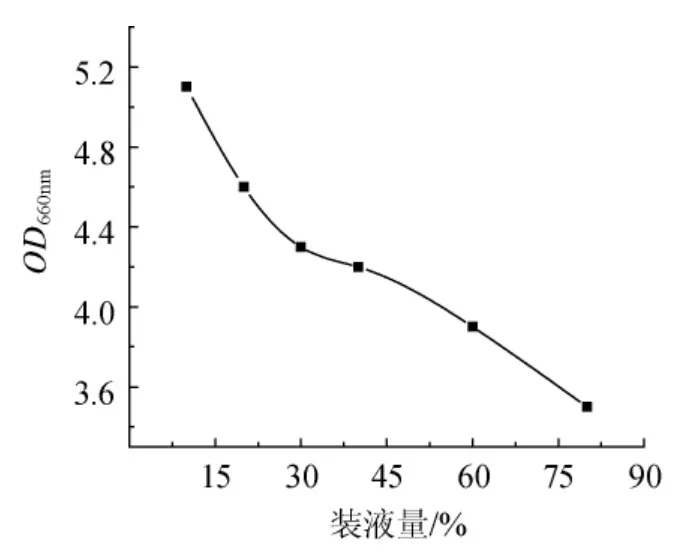
圖3 裝液量對菌種生長的影響Fig.3 Effect of liquid volume on the growth of lactic acid bacteria
從圖3可知,乳酸菌雖為兼性厭氧菌,但是裝液量越少時,生長越好,由于10%的裝液量過少,且20%的裝液量效果尚佳,所以之后發酵選擇20%的裝液量。
2.2.3 接種量的影響
將活化后的乳酸菌種子培養基分別以2%、5%、8%、10%、12%、15%接種量接種于MRS培養基中,37℃培養12h后,測其OD值,結果見圖4。
從圖4可知,接種量為8%時,菌種生長最佳,在低于8%時,接種量越高,生長越好,當接種量高于8%時,生長量反而減少。由于2%~10%接種量的結果(OD值)差距不大,所以在活化菌種時為節約菌種采用2%的接種量,之后發酵水平選取在2%~10%的區間內。
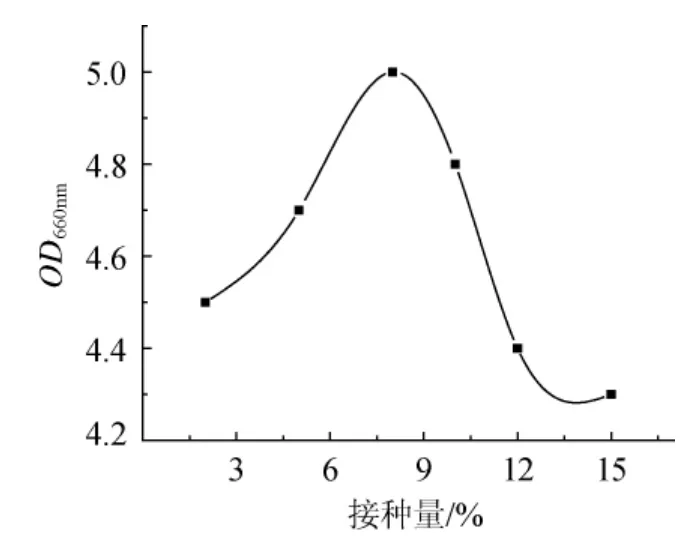
圖4 接種量對菌種生長的影響Fig.4 Effect of inoculum on the growth of lactic acid bacteria
2.2.4 溫度對菌種生長的影響
乳酸菌的生長隨溫度變化,試驗分別在28℃、30℃、32℃、36℃、38℃、40℃培養12h。OD值變化見圖5。
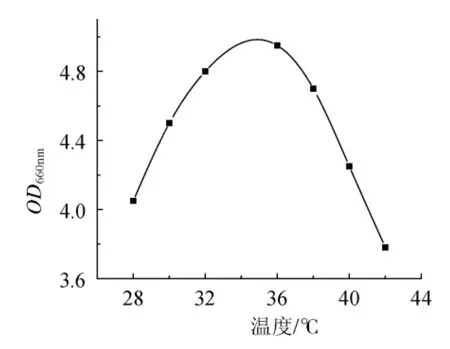
圖5 溫度對菌種生長的影響Fig.5 Effect of temperature on the growth of lactic acid bacteria
從圖5可知,乳酸菌生長OD值在32℃~38℃較高,在35℃~37℃達到最高水平。在此水平前,菌種隨溫度的升高而呈現良好的生長趨勢,高于此水平溫度時,菌種受高溫的抑制,雖然可以生長,但生長變得緩慢。
2.3 菌種發酵條件的優化正交試驗
在單因素試驗的基礎上,以滴定酸度為考察指標采,用L16(45)進行正交試驗,結果見表2。由表2可知,最優組合為A4B4C3D4E4,即培養溫度40℃,培養時間96h,接種量8%,葡萄糖含量10%,初始pH值為7.0。由極差大小可知,因素對菌種發酵產酸影響主次順序為時間>溫度>接種量>葡萄糖含量>初始pH值。
按照優選出的發酵培養基條件A4B4C3D4E4制備發酵培養基,葡萄糖含量為10%,初始pH值為7.0,接種量為8%,于40℃培養96h,其最終酸度為75°T。
2.4 乳酸鈣的測定和提取
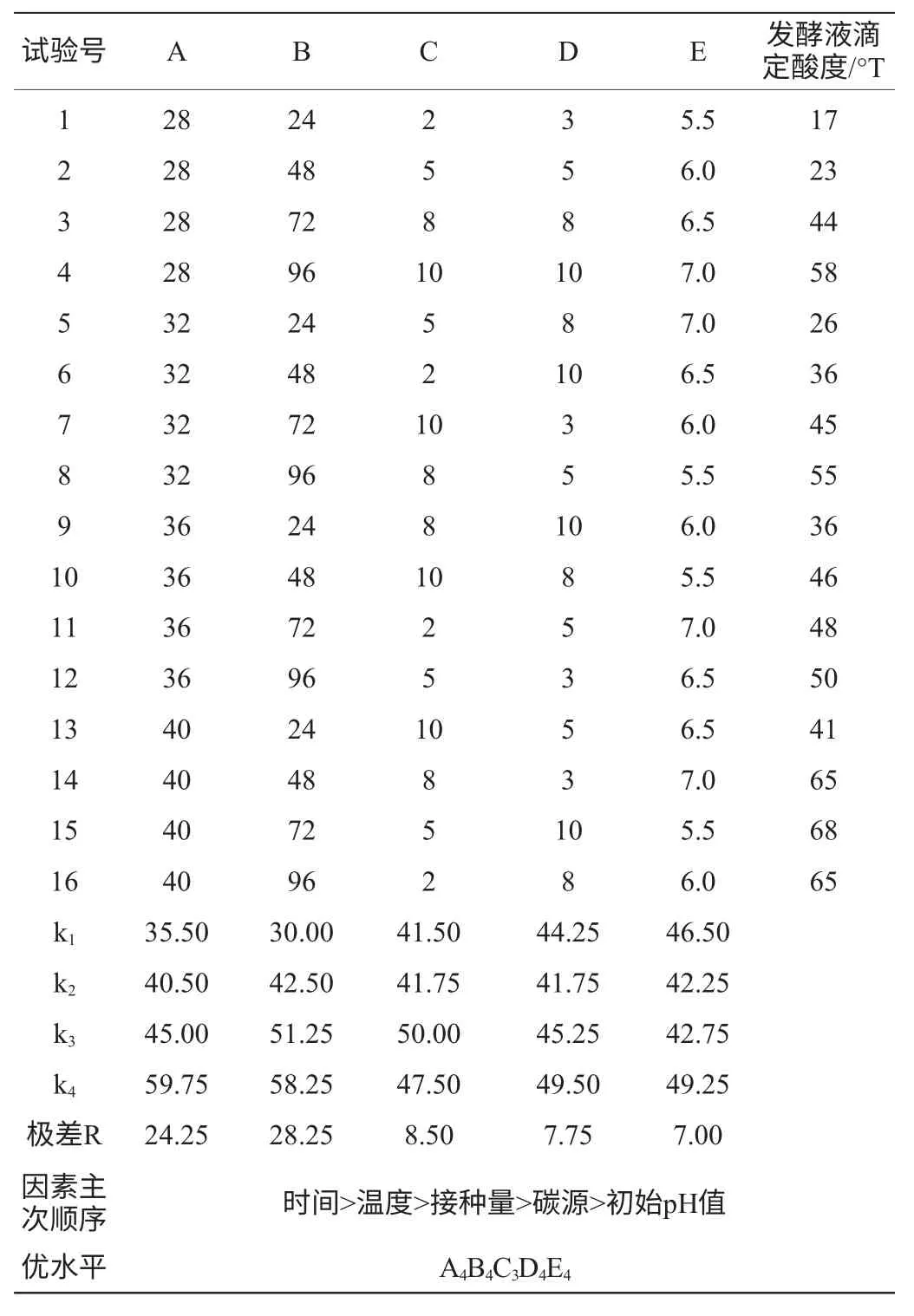
表2 發酵培養基優化的L16(45)正交試驗結果與分析Table 2 Result and analysis of the L16(45) orthogonal experiment for fermentation medium optimization
在最優發酵條件的培養基中加入碳酸鈣,其用量為乳酸產量的120%,即0.52g,按照最優條件進行發酵,反應結束后,用乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)滴定發酵液,測得乳酸鈣含量為27.28g/L。
將4瓶50mL發酵液統一處理,通過純化除雜,濃縮結晶得乳酸鈣成品3.93g,計算得乳酸鈣提取率為72.0%。
3 結論
單因素試驗結果表明,乳酸菌種子培養基的最佳條件為接種量8%,裝液量20%,溫度36℃,初始pH值為6.0,接種后12h菌種活性較高,適合下一代的接種。對乳酸桿菌進行乳酸發酵優化后,確定了最佳發酵條件:時間96h,溫度40℃,葡萄糖含量10%,接種量8%,初始pH值為7.0。各因素對發酵產酸的影響順序為時間>溫度>接種量>碳源>初始pH值。在最優條件下進行發酵,可得乳酸產量為8.64g/L,發酵液中乳酸鈣含量可達27.28g/L。通過過濾除去菌體和未反應的碳酸鈣,等電點沉淀法除去蛋白質,濃縮結晶提取乳酸鈣。最終乳酸鈣的提取收率為72%。該研究僅對菌種生長條件和發酵培養基條件進行了研究,葡萄糖轉換率較低,今后可以對該菌進行誘變[16-17]以提高菌種性能和乳酸產量。
[1]TAY A,YANG S T.Production of L-lactic acid from glucose and starch by immobilized cells ofRhizopus oryzaein a rotating fibrous bed bioreactor[J].Biotechnol Bioeng,2002,80(10):1-12.
[2]賴譜富.利用花蛤殼制備乳酸鈣的新工藝研究[D].福建:福建農林大學碩士論文,2009.
[3]陳黎洪,楊 穎,任發政,等.乳酸菌發酵法生產高鈣雞骨泥的工藝研究[J].中國食品學報,2011,11(2):104-108.
[4]徐 忠,汪群慧,姜兆華.L-乳酸的制備及其應用的研究進展[J].化學與粘合,2004,214(4):214-217.
[5]ALTAF M D,NAVEENA B J,VENKATESHWAR M,et al.Single step fermentation of starch to L (+) lactic acid byLactobacillus amylophilusGV6 in SSF using inexpensive nitrogen sources to replace peptone and yeast extract-optimization by RSM[J].Process Biochem,2006,41(2):465-472.
[6]苑廣志.一株乳酸菌發酵條件優化及檢測方法的建立[J].食品研究與開發,2012,33(11):197-201.
[7]LEE C W.Production of D-lactic acid by bacterial fermentation of rice[J].Fibers Polym,2007,8(6):571-578.
[8]GB/T 5009.92-2003 食品中鈣的測定[S].
[9]梅笑冰.食品添加劑乳酸鈣制備工藝研究[D].西安:西北大學碩士論文,2009.
[10]王振鐸.L-乳酸鈣的生產工藝[J].山西食品工業,2000(1):26-27.
[11]李逢振,馬美湖,李彥坡,等.雞蛋殼直接中和制取乳酸鈣的工藝[J].農業工程學報,2010,26(2):370-374.
[12]王 玉,吳 疆,吳家鑫.一株耐高溫乳酸菌的發酵條件優化[J].食品研究與開發,2012,33(5):161-164.
[13]孫天松,劉紅霞,倪慧娟,等.傳統發酵酸駝乳中乳酸菌的分離及鑒定[J].中國乳品工業,2006,39(6):4-7.
[14]田國軍,尚艷艷,黃澤元.臘魚中優勢乳酸菌的分離、純化及性質鑒定[J].食品與發酵工業,2011,37(6):78-81.
[15]JOHNR P,ANISHA G S,NAMPOOTHIRI K M,et al.Direct lactic acid fermentation:focus on simultaneous saccharification and lactic acid production[J].Biotechnol Adv,2009,27(2):145-152.
[16]凌代文,東秀珠.乳酸細菌分類鑒定及實驗方法[M].北京:中國輕工業出版社,1999.
[17]魯明波,曾 翔,張 力,等.紫外線誘變和恒化器培養篩選耐高溫的高產乳酸菌[J].微生物學通報,2010,37(4):520-523.

