甘蔗不同組織絲氨酸/蘇氨酸蛋白激酶基因家族的表達分析
葉冰瑩,薛 婷,陳 玲,張積森,陳由強*
(1.福建師范大 學生命科學學院,福建 福州 350108;2.福建發(fā)育與神經(jīng)生物學重點實驗室,福建 福州 350108;3.農(nóng)業(yè)部福建甘蔗生物學與遺傳育種重點實驗室,福建 福州 350108)
甘蔗(Saccharum officinarumL.)是熱帶與亞熱帶地區(qū)重要的糖料作物,是人類最早利用C4光合途徑的高光效禾本科甘蔗屬單子葉植物(禾本科是一類具有重要經(jīng)濟價值的種子植物家族),生物產(chǎn)量高,收益大,且在世界食糖總產(chǎn)量中,蔗糖占65%左右,我國則占80%以上。甘蔗理想的生物學特征,使其被視為具有巨大開發(fā)潛力的能源作物。許多研究表明甘蔗蔗糖積累機制、糖代謝過程及其相關調(diào)控機制的研究能為甘蔗育種提供重要的理論基礎[3]。植物細胞的絲氨酸/蘇氨酸蛋白激酶(serine/threonine kinase,STK)幾乎參與所有的生理及病理過程(如糖代謝、細胞周期、細胞生長及基因表達等[4])。研究甘蔗蛋白激酶中的絲氨酸蘇氨酸激酶基因可對甘蔗的代謝和發(fā)育信號轉(zhuǎn)導路徑有較大的貢獻作用。
本研究基于比較基因組的生物信息學預測,從甘蔗中克隆獲得STK基因家族的cDNA片段及其對應的基因組片段,通過實時熒光定量PCR技術對甘蔗STK基因家族的組織表達差異性進行分析,了解該家族中具體參與糖代謝調(diào)控影響較為重要的基因,初步研究探討STK在信號轉(zhuǎn)導中的作用,尤其是STK在蔗糖代謝中的作用。
1 材料與試劑
1.1 植物材料與菌株
甘蔗(Saccharumsp.cultivar.FN41)品種由農(nóng)業(yè)部福建甘蔗生物學與遺傳育種重點實驗室提供。大腸桿菌菌株DH5α由農(nóng)業(yè)部福建甘蔗生物學與遺傳育種重點實驗室保存。
1.2 主要試劑
Trizol購自Invitrogen公司,焦碳酸二乙酯(DEPC)購自美國Sigma公司,植物基因組DNA提取試劑盒、DNA Ladder購自天根生化科技有限公司,pMD 19-T 載體、Ex Taq酶、rTaq酶、EcoRⅠ限制性內(nèi)切酶、EASYDilution均購自TakaRa公 司,SV Gel and PCR Clean-Up System 購 自Promega,Amp購于上海生物工程公司,F(xiàn)irst strand cDNA Synthesis Kit、DNase Ⅰ購 自Fermentas 公 司,F(xiàn)S Universal SYBR Green Master(熒光定量試劑盒)購自Roche公司。其他生化試劑和常規(guī)試劑均為超純或分析純。
2 實驗方法
2.1 基因組的生物信息學預測
將擬南芥信息資源網(wǎng)TAIR搜索獲得的所有的絲氨酸/蘇氨酸蛋白激酶的轉(zhuǎn)錄序列,編碼域序列,基因位點序列與水稻基因組比對,獲得水稻的STK基因組序列、蛋白質(zhì)序列及完整的編碼域序列;再將高粱數(shù)據(jù)庫中的Sorbi1_GeneModels_Sbi1_4_aa.fasta protein 在BioEdit →Accesory Application→BLAST→Create a local protein database file→Local blast→將所有水稻STK蛋白序列上傳→Do search,得到所有高粱STK蛋白質(zhì)序列、轉(zhuǎn)錄序列。繼而與甘蔗已表達序列標志(EST)數(shù)據(jù)庫比對,后續(xù)實驗依據(jù)高粱基因組與甘蔗ESTs設計引物,克隆出STK基因家族的編碼域序列(coding domain sequence,CDS)與基因組序列片段,通過實時熒光PCR分析STK家族組織表達差異性。
2.2 甘蔗光合參數(shù)的測定
通過乙烯利處理[5]九月齡甘蔗,利用光合測定儀(具體操作見說明書)測定光合速率、氣孔導度、胞間CO2濃度、蒸騰速率的變化情況。
2.3 引物設計
本實驗選擇看家基因GAPDH為內(nèi)參照基因。看家基因GAPDH用作內(nèi)參基因來調(diào)整不同樣品最初的模板量以及RNA反轉(zhuǎn)錄的不同效率。依據(jù)實時定量PCR引物設計原則[6],根據(jù)STK cDNA序列和GAPDH基因的mRNA序列,用Primer Premier5.0設計目標基因和內(nèi)參基因的特異性引物,用Oligo 6.0檢驗其特異性。引物由上海生工合成,序列見表1。
2.4 實時熒光定量PCR引物的特異性檢測
根據(jù)Trizol說明書提取蔗莖、蔗葉的總RNA,參照Prime ScriptTM 1st strand cDNA synthesis Kit試劑盒的方法進行反轉(zhuǎn)錄。使用引物OligdT 18,反轉(zhuǎn)錄條件為42℃、1h,70℃、5min,-80℃長期保持。
在進行實時熒光定量PCR之前,先用STK-F/STK-R進行常規(guī)PCR擴增,通過瓊脂糖凝膠電泳和序列測定來檢測引物的特異性。PCR擴增條件為:94℃變性5min后,按94℃變性30s,60℃退火30s,72℃延伸30s進行30輪循環(huán),最后72℃延伸10min。10μL反應體系:10×PCR Buffer 2μL;dNTP Mixture(2.5mmol/Leach)1.6μL;上下游引物(均為10μmol/L)各0.4μL;模板cDNA 1μL;rTaq(5U/μL)0.2μL;ddH2O補足20μL。反應完成后,吸取3μL PCR擴增產(chǎn)物1%瓊脂糖凝膠電泳檢測。
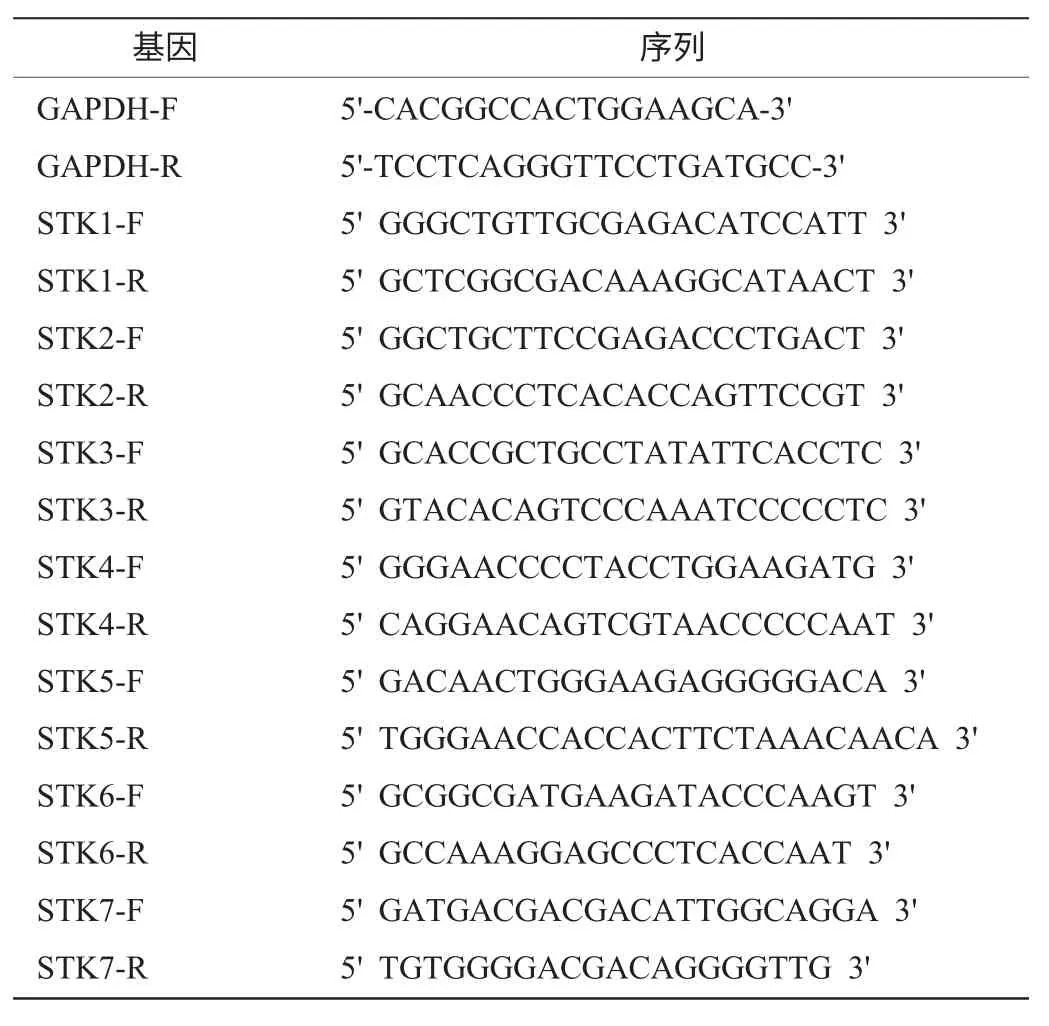
表1 STK和GAPDH實時熒光定量PCR引物Table 1 Specific primers to amplify STK and GAPDH genes for FQ-PCR
2.5 實時熒光PCR反應條件的優(yōu)化
用EASY Dilution將反轉(zhuǎn)錄產(chǎn)物原液按4-1、4-2、4-3、4-4倍稀釋。根據(jù)不同模板在60℃條件下的反應結果,確定PCR反應的最適模板量。PCR擴增實驗結束后,選擇Dissociation模式,設置在60℃~95℃每隔0.2℃采集熒光值生成溶解曲線,依據(jù)溶解曲線來判斷最有反應條件。
2.6 GAPDH基因和甘蔗STK基因?qū)崟r熒光PCR擴增
條件優(yōu)化后可選擇4-1倍稀釋的反轉(zhuǎn)錄產(chǎn)物為模板,每個樣品3個重復,共3個平行,對GAPDH基因、STK基因進行擴增。在冰上配制反應體系,且擴增反應在ABI 7300Fast Real-Time PCR System完成,擴增程序為95℃變性10min后,按95℃變性15s,60℃退火/延伸60s進行40輪循環(huán)。在退火/延伸時采集熒光,反應結束后選擇Relative Quantification(ddCt)Study模式進行數(shù)據(jù)分析和修正。
2.7 甘蔗STK基因表達差異分析
以GAPDH基因為內(nèi)參基因,福農(nóng)41成熟功能葉為校準樣本,2-△△Ct法[7]分析基因表達水平,比較不同組織STK基因表達差異。
3 結果與分析
3.1 基因組的生物信息學預測
本研究搜索到所有的擬南芥STK基因序列33條,水稻71條,高粱192條。對各物種的STK基因序列進行聚類分析,樹形顯示STK基因經(jīng)歷了廣泛的分化,并有可能經(jīng)歷了基因的水平轉(zhuǎn)移。通過以前實驗克隆得到的甘蔗STK基因作為起始的源序列,Blast搜索高粱數(shù)據(jù)庫,得到了13條高粱STK基因的亞家族序列。最終,經(jīng)過結構域預測排除疑似STK基因而不具有STK激酶的保守結構域的序列,得到高粱STK亞家族的7條序列STK1-7(圖1)。現(xiàn)STK6,7在分支圖上親源進化程度相比STK1,2,3,4,5較遠(分支圖上的序列從上之下依次為STK1-7)。將擬南芥、水稻、高粱STK基因家族的Groups和亞家族基因數(shù)總結為表2。繼而與甘蔗EST(Expressed Sequence Tag)數(shù)據(jù)庫比對,可用于后續(xù)實驗高粱基因組與甘蔗ESTs設計引物,克隆出STK基因家族的CDS(coding domain sequence)與基因組序列片段,通過實時熒光PCR分析STK家族組織表達差異性。

圖1 真正的高粱STK亞家族聚類分析Fig.1 The cluster analysis of true Sorghum STK Sub-family

表2 擬南芥、水稻、高粱STK基因家族的組和亞家族基因數(shù)Table 2 The Groups and sub-family genes inArabidopsis,Oryza Sativa andSorghum STK
3.2 甘蔗光合參數(shù)的測定
利用光合測定儀(ABI6400)測定乙烯利處理九月齡甘蔗的光合參數(shù)的變化見圖2。在乙烯利的處理條件下,光合速率下調(diào),氣孔導度上調(diào),胞間CO2上調(diào),蒸騰速率下調(diào),但是變化幅度不大。
3.3 甘蔗不同組織總RNA的提取及檢測
從圖3可以看出,甘蔗不同組織總RNA的電泳條帶清晰,28S帶明顯亮于18S帶,且無拖帶現(xiàn)象,表明提取的總RNA完整性較好,部分組織存在介于5S和18S之間的1~2條條帶,經(jīng)紫外分光光度計檢測,A260/A230大于2,A260/A280為1.8~2.0,表明RNA中的蛋白質(zhì)和多糖含量較少,具有較高的純度,符合合成cDNA的要求。
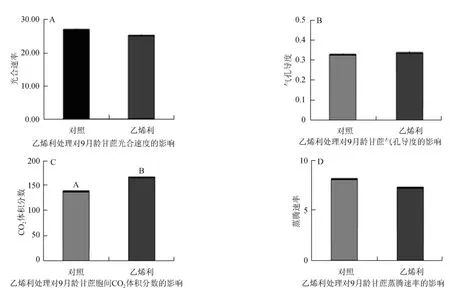
圖2 乙烯利影響甘蔗光合參數(shù)的變化Fig.2 Ethephon influence sugarcane photosynthetic parameters change
3.4 實時熒光定量PCR引物的特異性檢測
為驗證反轉(zhuǎn)錄效果,在進行定量PCR之前,采用GAPDH引物進行常規(guī)PCR擴增。取1μL擴增產(chǎn)物用3%瓊脂糖凝膠電泳檢測,擴增產(chǎn)物條帶明顯,單一,無雜帶,亮度一致,且產(chǎn)物的大小與理論相符(圖4)。選擇STK6進行不同組織的常規(guī)PCR,結果見圖5。1~6分別為根、老莖、嫩莖、嫩葉、鞘、芽,大小約200bp,條帶單一,較清晰,表明反轉(zhuǎn)錄效果良好,引物特異性好,可用于后續(xù)的實時熒光定量PCR。
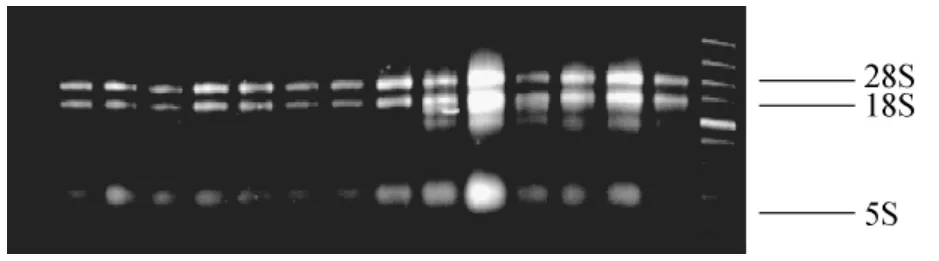
圖3 Trizol試劑提取總RNA的電泳圖Fig.3 The agarose gel electrophoresisdetection of total RNA extracted by Trizol method
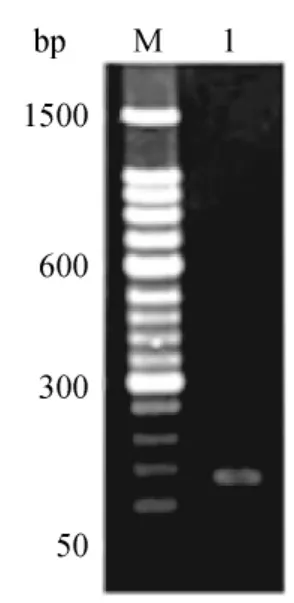
圖4 甘蔗GAPDH基因PCR產(chǎn)物Fig.4 PCR products of GAPDH gene from sugarcane
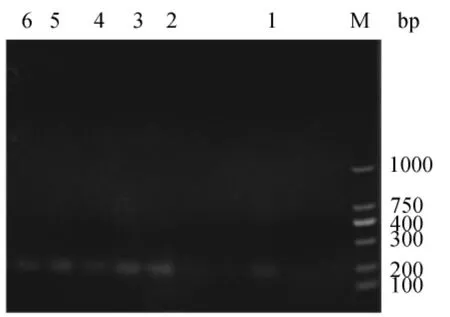
圖5 STK6不同組織常規(guī)PCRFig.5 STK6 conventional PCR in different organizations
3.5 實時熒光PCR反應條件的優(yōu)化
分別選取稀釋不同倍數(shù)的不同基因的反轉(zhuǎn)錄產(chǎn)物作為模板,在預設條件溫度下進行擴增反應,選取GAPDH的擴增曲線(圖6)來判斷最優(yōu)稀釋倍數(shù),4-0和4-1倍稀釋的反轉(zhuǎn)錄產(chǎn)物都可用于PCR擴增反應,為了節(jié)省樣品量,本實驗選擇4-1倍稀釋的反轉(zhuǎn)錄產(chǎn)物作為后續(xù)實時熒光定量PCR反應的模板,60℃為最適退火/延伸溫度。
3.6 甘蔗STK家族基因不同組織表達差異分析
經(jīng)過熒光定量PCR擴增之后,收集退火/延伸時期的熒光參數(shù),以根組織為參照,得到STK基因家族在不同組織的相對表達量的變化情況(圖7、圖8)。STK1:鞘>老莖>老葉>嫩葉>嫩莖>芽>根,STK2:嫩莖>老莖>鞘>老葉>嫩葉>芽>根,STK3:老葉>鞘>嫩莖>嫩葉>老莖>根>芽,STK4:鞘>老莖>老葉>嫩莖>嫩葉>根>芽,STK5:嫩葉>鞘>老葉>芽>嫩莖>根>老莖,STK6:鞘>老葉>嫩葉>嫩莖>芽>根>老莖,STK7:嫩莖>老莖>芽>嫩葉>鞘>根>老葉。該家族中各基因在各個組織中的表達情況是不同的,但多數(shù)基因是在鞘和嫩葉、嫩莖中表達量較高。STK2、STK7在莖中表達量高,STK3在老葉中表達量高,STK5的嫩葉表達量高,但與葉鞘和老葉差異不大。為了顯示STK基因家族在甘蔗各組織的表達情況,本實驗采用SYBR Green Ⅰ染料法定量分析該基因家族各基因的表達情況。同一時間段同一植株取各組織樣品,且取3個平行植株,并混合所有樣品,以排除單株之間的差異。每次實驗每個樣品做3個重復,對偏離比較嚴重的ΔCt值除去,然后取剩余2個的平均值,以排除在加樣過程中存在的偏差。另外,做3次獨立重復的實驗,對比3次實驗結果后發(fā)現(xiàn),基因表達量的差異小,由此證明實驗數(shù)據(jù)可靠。
圖6 GAPDH不同稀釋倍數(shù)的擴增曲線圖Fig.6 GAPDH amplification plot of different dilution
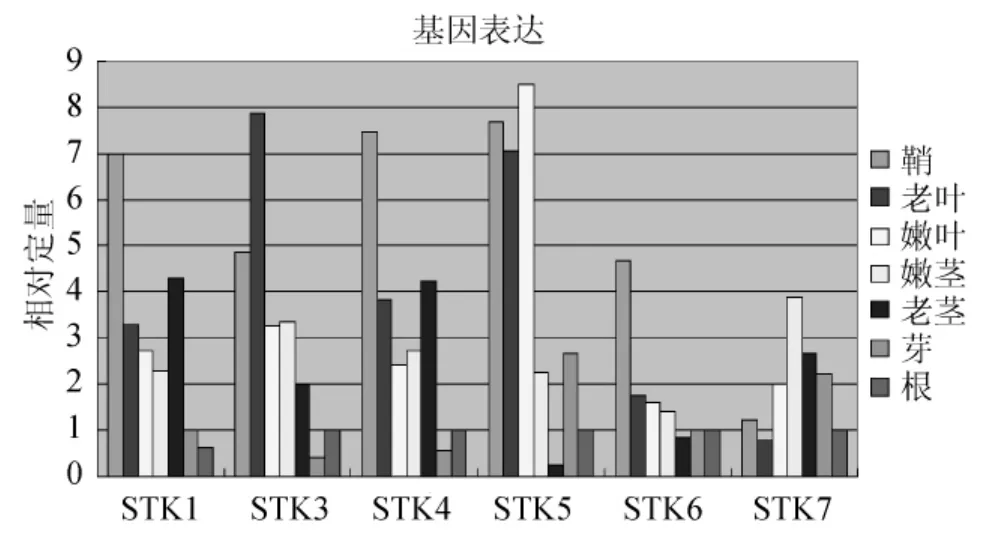
圖7 STK家族基因?qū)崟r熒光定量PCRFig.7 STK family gene real-time fluorescence quantitative PCR
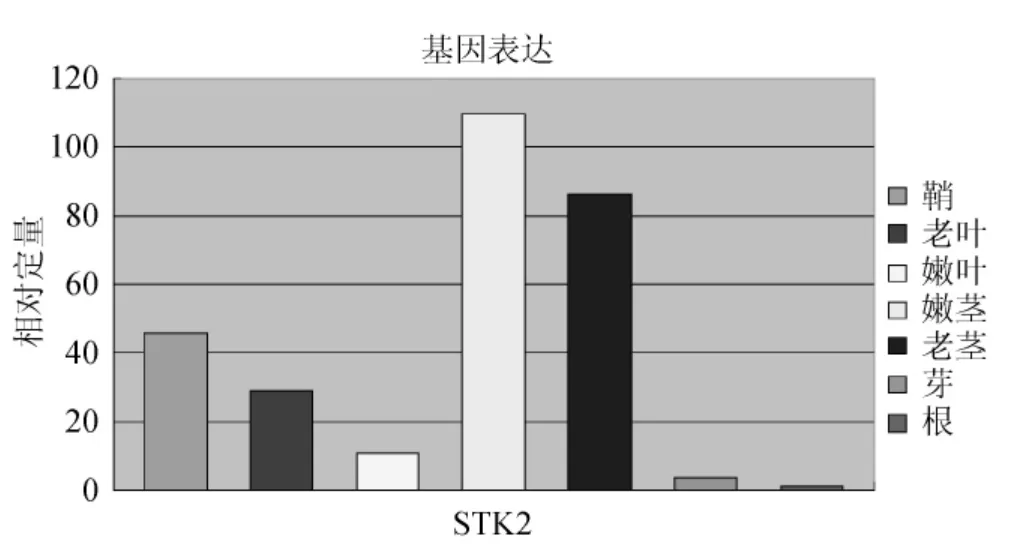
圖8 STK2基因?qū)崟r熒光定量PCRFig.8 STK 2 gene real-time fluorescence quantitative PCR
4 結論與討論
光合作用是植物體內(nèi)最為重要的同化過程,光合速率的測量是研究植物光合性能、診斷植物的光合機構的運轉(zhuǎn)、研究環(huán)境因素對光合作用的影響的重要方法[8]。本實驗的九月齡甘蔗在乙烯利的處理下,光合速率下調(diào),氣孔導度上調(diào),胞間CO2上調(diào),蒸騰速率下調(diào),但是變化幅度不大,即乙烯利對光合作用影響不大,對光合產(chǎn)物的積累和轉(zhuǎn)化,糖代謝的信號調(diào)控的影響微弱。同時,在基因表達的分析中,RNA轉(zhuǎn)錄的穩(wěn)態(tài)水平是檢測細胞和組織的基因表達活性的最方便的參數(shù)之一[9-10]。實時熒光定量PCR技術,既能定性又能定量的優(yōu)勢使其成為基因轉(zhuǎn)錄水平研究的良好手段,其精確、快速的特點則使其目前在分子遺傳學領域得到廣泛應用[11-14]。本實驗提取的甘蔗各組織RNA,通過分析STK基因家族在甘蔗各組織中的組織表達差異時發(fā)現(xiàn),該家族中各基因在各個組織中特異表達的基因是不同的,但多數(shù)基因是在鞘和嫩葉、嫩莖中表達量較高。STK2、STK7在莖中表達量高,可能是參與莖中蔗糖貯存的主要STK基因;STK3在老葉中表達量高,STK5的嫩葉表達量高,但與葉鞘和老葉差異不大,這2個基因可能是參與葉中蔗糖轉(zhuǎn)化的主要STK基因。該4個基因可能在甘蔗糖代謝的信號調(diào)控中起主要作用。
本研究目的是通過光合參數(shù)測定來研究植物光合性能、診斷植物的光合機構的運轉(zhuǎn)、研究環(huán)境因素對光合作用的影響。通過測定STK基因在不同組織表達情況,分析甘蔗STK基因家族的組織表達差異。即使對于甘蔗STK基因的調(diào)控機制不是完全清楚,但是,甘蔗的生長發(fā)育過程中,在以碳水化合物收支平衡的基礎上,與蔗糖合成代謝相關酶,如蔗糖合成酶(SS)[15]、蔗糖磷酸合成酶(SPS)和轉(zhuǎn)化酶(Inv),這些酶基因都受到轉(zhuǎn)錄調(diào)控系統(tǒng)的支配,STK調(diào)控的信號轉(zhuǎn)錄系統(tǒng)可能調(diào)控著蔗糖合成代謝途徑。
[1]黃東杰,張樹珍,范海闊,等.甘蔗的蔗糖代謝[J].植物生理學通訊,2006,42(4):755-760.
[2]胡 巍,張積森,葉冰瑩.甘蔗蔗糖磷酸合成酶磷酸化位點的突變及相應表達載體的構建[J].亞熱帶農(nóng)業(yè)研究,2010,6(4):280-283.
[3]陳 玲,葉冰瑩,黃貞杰,等.甘蔗絲氨酸/蘇氨酸激酶基因的克隆及序列分析[J].亞熱帶農(nóng)業(yè)研究,2012(3):194-198.
[4]蔡 沖,呂均良,陳昆松.蛋白激酶的研究(綜述)[J].亞熱帶植物科學,2002,31(1):63-67.
[5]蔡新民,邵春喜,黃文興.乙烯利對玉米生產(chǎn)性能影響的試驗[J].玉米科學,1998(S1):88-89..
[6]Kenneth J.Livak and Thomas D.Schmittgen.利用實時定量PCR 和2-△△Ct法分析基因相對表達量[J].方法,2001,25:402-408.
[7]唐兆前,李 力,張 瑋,等.卵巢癌細胞卡鉑耐藥相關腫瘤抑制基因的表達變化及其啟動子區(qū)甲基化觀察[J].山東醫(yī)藥,2010(18):904-907.
[8]賈凌云,孫 坤,馮漢青,等.呼吸作用對葉片光合作用和異戊二烯釋放的影響[J].植物科學學報,2012,30(2):193-197.
[9]衛(wèi)賽賽,楊 敏,許正平.真核生物rRNA 基因的轉(zhuǎn)錄調(diào)節(jié)[J].中國生物化學與分子生物學報,2007(11):888-893.
[10]祁云霞,劉永斌,榮威恒.轉(zhuǎn)錄組研究新技術:RNA-Seq 及其應用[J].遺傳,2011,33(11):1191-1202.
[11]白衛(wèi)濱,黃亞東,柳忠玉.利用熒光定量PCR 技術快速檢測轉(zhuǎn)基因產(chǎn)品的研究[J].食品工業(yè)科技,2006(1):193-195.
[12]王式春,徐亞軍,劉 渠.熒光定量PCR 在肺結核臨床診斷及療效評估中的應用[J].華南預防醫(yī)學,2011(5):14-18.
[13]趙 麗,趙緒永,陳紅英.PPV SYBR GreenⅠ實時熒光定量PCR 檢測方法的建立及應用[J].西北農(nóng)林科技大學學報:自然科學版,2012(5):27-31.
[14]袁 森,田明堯,崔鶴馨.人干擾素誘導跨膜蛋白基因?qū)崟r熒光定量PCR 檢測方法的建立[J].中國生物制品學雜志,2013(5):131-137.
[15]滕建北,萬德光,蔡 毅.美花石斛蔗糖合成酶活性動態(tài)研究[J].安徽農(nóng)業(yè)科學,2012,39(2):644-645.

