糖及乙醇對木葡糖酸醋桿菌種子液活力的影響
康麗茹,鐘春燕,王錫彬,向 東,王志國*
(1.海南大學 食品學院,海南 海口 570228;2.海南椰國食品有限公司,海南 海口 570311)
細菌纖維素與高等植物細胞中的纖維素相比,具有高結晶度、高純度、高持水力,高楊氏模量等特性,因此廣泛應用于食品、醫藥材料、造紙、服裝等領域,因此得以廣泛研究[1-2]。就目前的研究來看,主要集中于如何高產纖維素,如通過誘變篩選高產菌株[3-4]、優化培養基配方[5-7]、發酵工藝的優化等[8-11]。高產纖維素的前提是種子液活力要高,而種子液的制備方式通常為靜置培養,但在實驗過程中,發現靜置培養制備種子液時,傳代次數多了,種子液的活力就會下降。盡管糖源及乙醇對纖維素的產量影響已有不少報道[12-15],但就這些物質對種子液活力的研究鮮有報道。本實驗以木葡糖酸醋桿菌為研究對象,對種子傳代次數、糖源及乙醇對纖維素的產量進行了研究,對提高纖維素產量具有重要的實際意義。
1 材料和方法
1.1 材料
1.1.1 菌種
木葡糖酸醋桿菌(Gluconacetobacter xylinus),海南大學食品學院綜合實驗室分離保存。
1.1.2 培養基
斜面培養基:2.0%葡萄糖、0.5%酵母膏、0.5%蛋白胨、0.27%Na2HPO4、0.115%檸檬酸、2.0%瓊脂,自然pH值,121℃、15min條件下滅菌。
種子培養基:糖源(1.0%葡萄糖、2.0%葡萄糖、2.0%蔗糖、4.0%蔗糖),0.3%Na2HPO4、0.3%(NH4)2SO4、0.1%檸檬酸、0.025%MgSO4,調節pH值至4.0,105℃消毒15min。研究乙醇的影響時,添加1%vol乙醇。
生產培養基:自然發酵椰子水、白砂糖4.0%、0.3%(NH4)2SO4、0.1%KH2PO4、0.05%MgSO4,用10%NaOH調節pH值至4.5,105℃、15min條件下消毒[16]。
1.2 儀器與設備
SW-CJ-1F單人雙面凈化工作臺:蘇州凈化設備有限公司;YX280A手提式不銹鋼蒸汽消毒器:上海三申醫療器械有限公司;SHP-1500生化培養箱:上海精宏實驗設備有限公司;SHZ-82氣浴恒溫振蕩器:常州市華普達教學儀器有限公司。
1.3 方法
1.3.1 實驗方法
菌種活化:挑取斜面培養基上的木葡糖酸醋桿菌(Gluconacetobacter xylinus)于50mL種子培養液中,30℃靜置培養4d。
靜置方式制備種子液:菌種活化液按5%(v/v)的接種量轉接于100mL種子培養液,30℃靜置培養4d后,按5%(v/v)轉接至新鮮的種子培養液中,30℃靜置培養4d,連續轉接5次,對每次轉接所制備的種子液進行活力評估。
振搖方式制備種子液:菌種活化液按5%(v/v)的接種量轉接于100mL種子培養液,30℃、120r/min培養4d,按5%(v/v)轉接至新鮮的種子培養液中,30℃靜置培養4d,連續轉接5次,對每次轉接所制備的種子液進行活力評估。
1.3.2 糖源對Ga.xylinus種子液活力的影響
在種子培養液中分別加入1.0%葡萄糖、2.0%葡萄糖、2.0%蔗糖、4.0%蔗糖,分別考察靜置方式、振搖方式對種子培養液活力的影響。
1.3.3 乙醇對Ga.xylinus種子液活力的影響
在種子培養液中以2.0%葡萄糖為碳源,加入1%vol的乙醇,分別考察靜置方式、振搖方式對種子培養液活力的影響。
1.3.4 分析方法
種子液活力的評估:種子液按5%(v/v)的接種量接種于300mL生產培養液中,30℃靜置培養6d,得到細菌纖維素,置于80℃,0.1mol/L NaOH溶液中,保持2h,冷卻后用0.1mol/L HCl中和至pH值為7.0,用自來水充分洗滌,在80℃條件下干燥至質量恒定,稱質量。
菌落計數:將種子液取1mL,加入9mL無菌0.85%生理鹽水,如此重復后,將稀釋10、100、1000倍的稀釋液涂布于固體平板上,涂布后,置于30℃靜置培養6d,平板菌落計數[17]。
2 結果與分析
2.1 靜置方式制備Ga.xylinus 種子液
2.1.1 糖種類及濃度對Ga.xylinus種子液活力的影響
從圖1可以看出,靜置方式制備Ga.xylinus種子液,其活力隨轉接次數增加而下降。
第1次轉接時,種子液活力差別不大(1%葡萄糖、2%葡萄糖、2%蔗糖、4%蔗糖的活力分別為4.1g/L、4.2g/L、4.2g/L、4.3g/L),但隨著轉接次數的增加,差別逐漸顯現,轉接至第5次時,2%蔗糖的種子液活力為2.1g/L,分別比1%葡萄糖、2%葡萄糖、4%蔗糖少38%、57%、52%。
當種子液中的糖源為2%的葡萄糖時,下降的趨勢較為平緩,至第5代時,活力為3.3g/L,比第1代種子液的活力(4.2g/L)下降了約24%;而糖源為2%蔗糖時,種子液活力下降十分明顯,至第5代時,活力為2.1g/L,比第1代種子液的活力(4.2g/L)下降了50%。
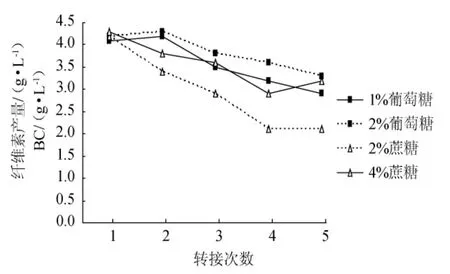
圖1 糖對靜置方式制備種子液的活力影響Fig.1 Effects of sugars in stationary culture on its viability
2.1.2 乙醇對Ga.xylinus種子液活力及生物量的影響
靜置培養時,2%葡萄糖的種子液在連續5次傳代過程中活力相對穩定,但仍下降了24%(見圖1),因此添加1%vol的乙醇進行研究。
從圖2可以看出,添加1%vol的乙醇,傳代次數增加,種子液活力仍下降。但在同代中,比單純葡萄糖種子培養基的活力高,即使轉接至第5次時,種子液活力(4.3g/L)也與僅含2%葡萄糖的種子液轉接第1次的活力(4.2g/L)相當。
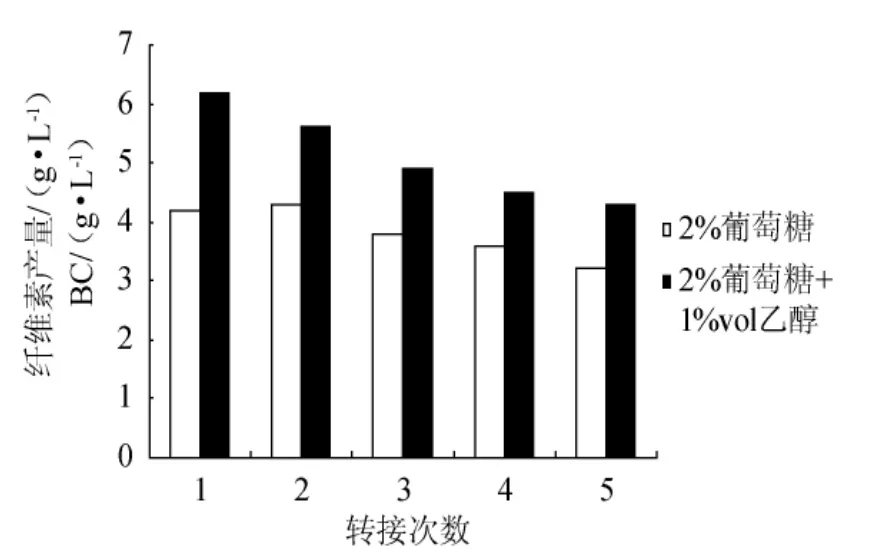
圖2 乙醇對靜置方式制備種子液的活力影響Fig.2 Effects of ethanol in stationary culture on its viability
對含有乙醇的種子液進行菌落計數,結果見圖3。從圖3可看出,靜置連續培養的8d時間內,含乙醇的種子液比不含乙醇對照組(CK)中的菌落數始終更多。可見乙醇能增加生物量,從而減緩種子液在傳代過程中的活力下降。
總的說來,以靜置方式制備Ga.xylinus種子液時,其合適的培養基為2%葡萄糖、1%vol乙醇、0.3% Na2HPO4、0.3%(NH4)2SO4、0.1%檸檬酸、0.025%MgSO4,調節pH至4.0。培養條件為30℃,4d。
2.2 振搖方式制備種子液
2.2.1 糖種類及濃度對Ga.xylinus種子液活力的影響
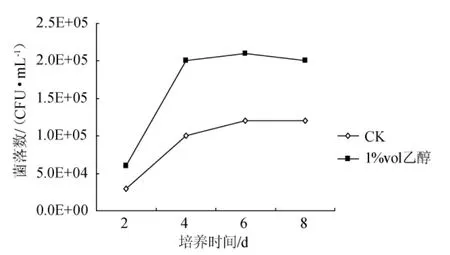
圖3 乙醇對靜置方式制備種子液的生物量影響Fig.3 Effects of ethanol in stock culture cultivated statically on its biomass
振搖方式制備種子液,種子液活力隨代數增加變化降低趨勢更為明顯(圖4)。從圖4可以看出,采用1%的葡萄糖培養基,至第3代時,種子液幾乎沒有活力,采用2%蔗糖,至第4代時,種子液活力也幾乎喪失。
這種活力喪失的原因是種子液中木葡糖酸醋桿菌的數量銳減,因為將種子液用顯微鏡觀察,幾乎看不見木葡糖酸醋桿菌細胞的存在。
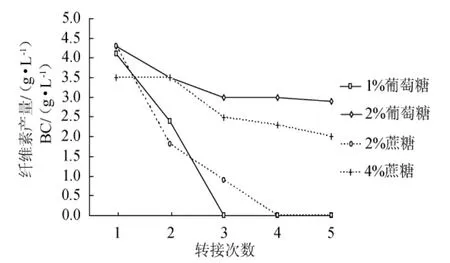
圖4 糖源對振搖方式制備種子液的活力影響Fig.4 Effects of sugars in stock culture cultivated shaking on its viability
總體說來,種子培養基的糖源以2%的葡萄糖更為合適,其次為4%的蔗糖。
2.2.2 乙醇對Ga.xylinus種子液活力及生物量的影響
在2%的葡萄糖種子培養基中添加1%vol乙醇,采用振搖方式制備種子液,其活力隨傳代次數增加逐漸減小(圖5),但在同一代中,添加乙醇,明顯增加了種子液活力,這是由于前面4d內,含乙醇的振搖種子液中含有更多的木葡糖酸醋桿菌細胞(如第4d時,無乙醇中為1.6×105CFU/mL,而乙醇培養液中為2.0×105CFU/mL)。從圖6可以看出,如果增加每代培養的時間,可以預料,添加1%vol乙醇的種子液的活力在傳代過程中,可能下降更快。
從圖7可以看出,每代種子液培養時間延長至8d,無論是否添加乙醇,種子液活力在傳代過程中都持續下降,而且同代種子液的活力比較看,乙醇似乎具有負作用,即種子液活力相對更低。
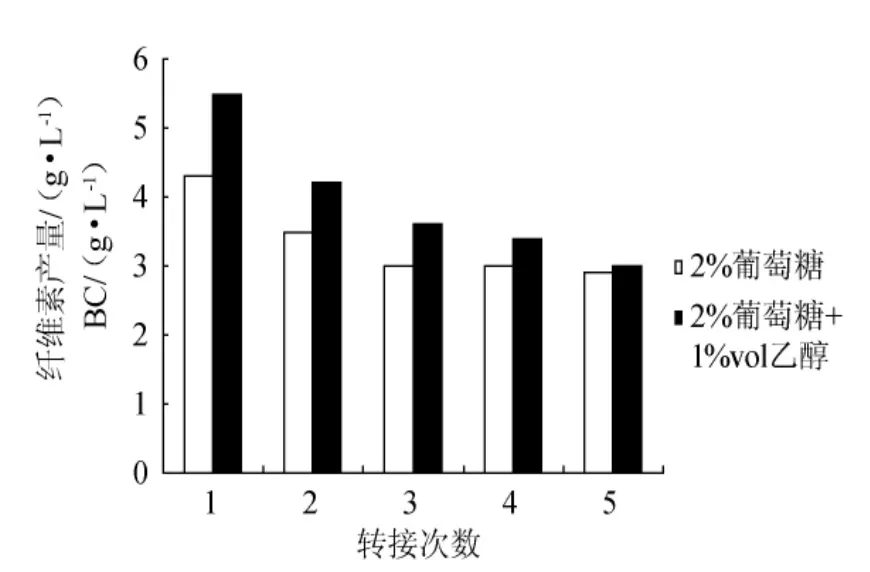
圖5 乙醇對振搖方式制備種子液的活力影響Fig.5 Effects of ethanol in stock culture cultivated shaking on its viability
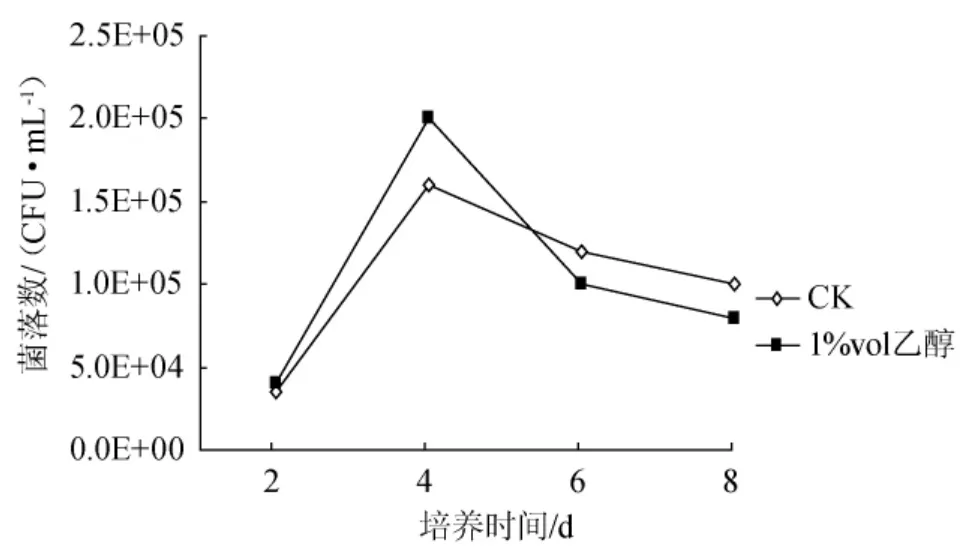
圖6 乙醇對振搖方式制備種子液的生物量影響Fig.6 Effects of ethanol in stock culture cultivated shaking on its biomass
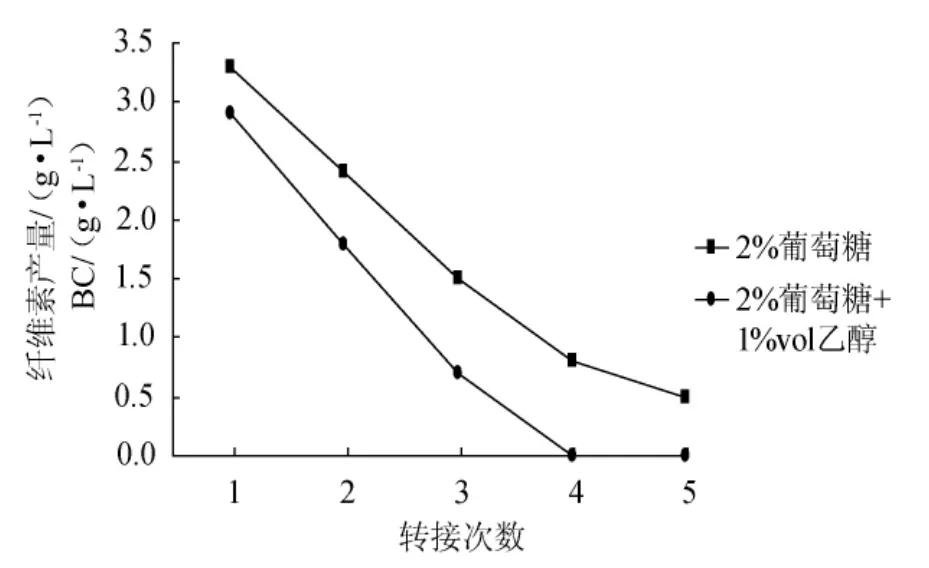
圖7 乙醇對振搖方式制備種子液的活力影響Fig.7 Effects of ethanol in stock culture cultivated by shaking for 8d on its viability
造成這一現象的原因可能是乙醇具有增菌作用,正因如此,培養液中的營養物質消耗更快,培養時間延長,微生物總數量反倒減少,從而導致種子液活力下降。從圖7可以看出,添加乙醇的種子液中,當傳代至第4代時,此時的種子液幾乎不能產生纖維素。
3 結論
Ga.xylinus種子液代數增加,無論是靜置方式還是振搖方式制備時,種子液活力隨轉接次數增加而下降,但這種下降的趨勢因糖的種類不同而異,以2%葡萄糖為糖源時,下降趨勢更緩,如果添加1%vol的乙醇,因為乙醇有增菌作用,下降趨勢得到緩解。但在振搖制備時,盡管添加乙醇也能緩解種子液活力的下降,但培養的時間不宜超過4d。
靜置培養制備Ga.xylinus種子液時,以2%葡萄糖結合1%vol乙醇為較佳,但傳代次數宜控制,結合先前的實驗結論[18],還要注意裝液量不能太大,否則易出現衰退菌株。
[1]POKALWAR S U,MISHRAL M K,MANWAR A V.Production of cellulose byGluconacetobactersp.[J].Recent Res Sci Tech,2010,2(7):14-19.
[2]CHAWLA P R,BAJAJ I B,SURVASE S A,et al.Microbial cellulose:fermentative production and applications[J].Food Technol Biotech,2009,47(2):107-124.
[3]毋銳琴.高產細菌纖維素菌株的篩選及發酵工藝優化[D].西北農林科技大學碩士論文,2008.
[4]葛含靜.細菌纖維素高產菌株高壓誘變選育及其機理研究[D].西北農林科技大學碩士論文,2012.
[5]李兆乾,裴重華,彭碧輝.細菌纖維素的研究現狀及進展[J].纖維素科學與技術,2007,15(2):64-67.
[6]謝健健,洪 楓.細菌纖維素發酵原料的研究進展[J].纖維素科學與技術,2011,19(3):68-77.
[7]張繼東.木醋桿菌發酵產細菌纖維素的研究[D].南京理工大學博士論文,2004.
[8]趙 瓊,楊 謙.木醋桿菌突變株產細菌纖維素發酵條件優化[J].食品研究與開發,2007,28(6):44-48.
[9]秦微微,遲玉杰.木醋桿菌發酵培養基優化及發酵方式的探討[J].中國釀造,2006,25(6):33-36.
[10]SANI A,DAHMAN Y.Improvements in the production of bacterial synthesized biocellulose nanofibres using different culture methods[J].J Chem Technol Biot,2010,85(2):151-164.
[11]JUNG J Y,KHAN T,PARK J K,et al.Production of bacterial cellulose byGluconacetobacter hanseniiusing a novel bioreactor equipped with a spin filter[J].Korean J Chem Eng,2007,24(2):265-271.
[12]王志國,王錫彬,向 東,等.乙醇在合成培養基中對木醋桿菌HN001合成纖維素的影響[J].食品科技,2007(12):47-49.
[13]馬 霞,王瑞明,關鳳梅,等.非碳水化合物對木醋桿菌合成細菌纖維素影響規律的初探[J].中國釀造,2003,22(4):15-17.
[14]張鳳清,張海悅,鄭春雨,等.玉米漿做Acetobacter xylinum培養基生產纖維素的發酵條件優化[J].食品工業科技,2005,26(2):107-108.
[15]羅錦洪,盧紅梅,張義明,等.利用響應面法優化細菌纖維素發酵培養基[J].中國釀造,2008,27(22):39-41.
[16]王志國,鐘春燕,王錫彬,等.椰子水自然發酵條件對細菌纖維素生產的影響[J].中國釀造,2009,28(4):32-34.
[17]葉 明.微生物學實驗技術[M].安微:合肥工業大學出版社,2009.
[18]吳 謙,謝必祺,劉耀謙,等.木葡糖醋桿菌靜置培養中的衰退現象初探[J].中國釀造,2013,32(5):19-21.

