源于自然發酵腐乳中5’-AMP脫氨酶高產菌株的篩選
梅光明,郭遠明,饒勝其,張小軍,李佩佩,嚴忠雍,龍 舉
(1.浙江省海洋水產研究所 浙江省海水增養殖重點實驗室,浙江 舟山 316100;2.揚州大學 食品科學與工程學院,江蘇 揚州 225009)
自然發酵腐乳也叫腐乳、醬豆腐,為中國著名的傳統食品,由新鮮豆腐經過發酵、腌制而成,有“東方奶酪”之稱[1-2]。腐乳的制作過程中有霉菌、乳酸菌和酵母菌等多種微生物共同參與發酵作用[3-5]。5’-AMP脫氨酶又稱腺苷酸脫氨酶、5’-AMP氨基水解酶,是構成嘌呤核苷酸代謝循環的3種主要酶類之一。在核酸酶水解核酸制備5’-核苷酸的工業化生產過程中,約占總量25%的腺苷酸通常沒有多大用途,而5’-AMP脫氨酶可專一性地將腺苷酸轉變為肌苷酸,后者可用來生產藥品及強力味精,此外脫氨酶還用于生產細胞的H+緩沖劑[6]。當今核酸酶的研究炙手可熱且成果產出速度飛速提高,勢必導致市場對5’-AMP脫氨酶的需求大大增加,因此大規模化地生產5’-AMP脫氨酶具有廣泛的生產應用前景和巨大的經濟效益。現在工業生產中使用的生物酶大多由酵母、青霉、曲霉及毛霉等微生物發酵制備,但有關生產工藝的報道卻比較少。本實驗利用自然發酵腐乳中富集的豐富微生物資源,參考相關文獻資料報道的微生物篩選目標菌株的方法[7-21],采用3種固體培養基(PDA、YPD、MRS)對腐乳中的野生菌株進行篩選和平板分離劃線培養,使具有不同菌落特征的菌種分離純化后,測得各菌株5’-AMP脫氨酶的產量與活性表達,篩選出5’-AMP脫氨酶的高產菌株,并對其進行菌種鑒定及一系列的發酵條件優化研究。通過本實驗得到一株具有自主知識產權的高產5’-AMP脫氨酶菌株,為進一步研究5’-AMP脫氨酶的性質做準備,并推動其工業化生產步伐奠定一定的基礎。
1 材料與方法
1.1 菌株來源
從自然發酵腐乳中分離。
1.2 培養基制備
PDA固體培養基:馬鈴薯200g,葡萄糖20.0g,瓊脂20.0g,蒸餾水1000mL,121℃滅菌20min。。
MRS固體培養基:牛肉膏10.0g,蛋白胨10.0g,酵母浸膏5.0g,K2HPO42.0g,檸檬酸氫二銨2.0g,乙酸鈉5.0g,吐溫-801.0mL,MgSO4·7H2O0.50g,MnSO40.25g,葡萄糖20.0g,瓊脂20.0g,蒸餾水1000mL,121℃滅菌20min,調節pH值至6.2~6.4。
YPD固體培養基:蛋白胨20.0g,酵母浸膏10.0g,葡萄糖20.0g,瓊脂20.0g,蒸餾水1000mL,121℃滅菌20min,調節pH值至5.0~5.5。
搖瓶發酵培養基:木糖2.1%,檸檬酸三鈉0.28%,蛋白胨1.4%,硫酸鎂0.035%,吐溫0.084%。121℃滅菌20min。
1.3 試劑
酵母浸膏、牛肉浸膏、蛋白胨、腺苷酸和瓊脂均為生化試劑,其余試劑為分析純。
0.1 mol/L琥珀酸-氫氧化鈉緩沖液:稱取琥珀酸11.809g,加蒸餾水約950mL溶解,用1mol/L NaOH溶液調節pH值至6.0,定容至1000mL。
0.08 mol/L NaHCO3:稱取NaHCO36.72g,用蒸餾水溶解,定容至1000mL。
10%高氯酸溶液:稱取10.0mL高氯酸,加適量水稀釋,定容至100mL。
5’-AMP反應底物:準確稱取139mg腺苷酸,用0.08mol/L NaHCO3溶液定容至10mL,作為原始底物,然后用0.1mol/L琥珀酸-氫氧化鈉緩沖液將其稀釋400倍,得到最終濃度為0.1×10-3mol/L 的反應底物。
1.4 儀器與設備
TG16-WS型臺式高速離心機:湘儀離心機儀器有限公司;DK-S12型電熱恒溫水浴器:上海森信試驗儀器有限公司;SX-500型高壓蒸汽滅菌鍋:日本TOMMY公司;DGX-9053B-2型生化培養箱:上海福瑪試驗設備有限公司;BS210S型電子天平:北京賽多利斯天平有限公司;ZHJH-C1209B型垂直流超凈工作臺:上海智誠分析儀器制造有限公司;755S紫外-可見分光光度計:上海棱光技術有限公司。
1.5 方法
1.5.1 自然發酵腐乳半成品的制備
稱取500g市售新鮮豆腐,表面用經滅菌處理的自來水淋洗干凈后切成大小適中的小塊,放置于干凈塑料盒內(塑料盒底部預先放好一層干凈報紙并鋪上食品保鮮膜),在豆腐表面再鋪上一層保鮮膜后再放上一層報紙。蓋好塑料盒蓋子后在16℃、濕度85%左右的條件下放置培養5d[22]。
1.5.2 自然發酵腐乳半成品中產5’-AMP脫氨酶菌株的篩選
取樣:從腐乳半成品上選取菌落特征差別較大的多個點,分別取樣品2g左右于50mL錐形瓶中,加入無菌生理鹽水10mL,室溫條件下120r/min搖床提取30min,以此為菌懸液原液。將菌懸液原液按濃度梯度依次稀釋至10-1~10-7。分別取稀釋度為10-5~10-7的3種樣液350μL,用涂布棒均勻涂布于PDA、MRS、YPD培養基。涂布完成后,置于20℃恒溫箱內培養2h~3h,待水分蒸發干后,將培養皿倒置繼續培養48h。
分離純化:選擇涂布濃度適宜的平板,挑取形態完整、單獨生長的菌落分別劃線。用接種環以無菌操作沾取少許待分離的菌,在與涂布平板對應培養基的無菌平板表面進行平行劃線,微生物細胞數量將隨著劃線次數的增加而減少,并逐步分散開來。劃線完成后置于20℃恒溫箱內培養2d~3d。重復劃線培養操作2次,使菌株盡量純化。
搖瓶發酵培養:本試驗使用250mL錐形瓶,每瓶裝入約50mL搖瓶發酵培養基,從劃線平板接種后,20℃、200r/min搖瓶發酵培養24h后轉接5%至新的搖瓶中,繼續搖瓶發酵3d,培養完成,取樣測量5’-AMP脫氨酶的活性。
菌種保藏及酶液制備:分別取搖瓶發酵培養后的菌懸液1mL于1.5mL離心管中,10000r/min離心5min,下層沉淀加500μL 30%甘油,振蕩均勻后于-20℃冰箱中保藏,即為種子。甘油保藏適用于中期或長期保藏菌種。而上層清液即是酶液,可用于測定5’-AMP脫氨酶的活性。
5’-AMP脫氨酶活性的測定:將酶液樣品稀釋8倍備用,按照文獻[23]的方法測定5’-AMP脫氨酶的活性,每個樣品做3組平行實驗,平行實驗數據分別計算得到酶活后取平均值。
1.5.3 菌種鑒定
在倒好培養基平皿中,用接種針從斜面挑取少許孢子在培養皿中按三角頂點位置三點式接種。PDA培養基平皿在20℃培養3d~5d。形成菌落后進行特征觀察并記錄。對5’-AMP脫氨酶高產菌株進行分類鑒定
1.5.4 發酵條件對5’-AMP脫氨酶高產菌株產酶的影響
培養基初始pH值對產酶的影響:挑取單獨生長的純種菌落于裝有50mL不同pH值的液體培養基的250mL錐形瓶中,錐形瓶用8層紗布封口。20℃、200r/min搖床培養24h。發酵培養24h后,轉接5%(v/v,下同)至新的裝有約50mL液體培養基的250mL錐形瓶中繼續培養72h。培養后的酶液用于測定5’-AMP脫氨酶的活性。
搖瓶發酵培養溫度對產酶的影響:操作同1.5.4,比較不同溫度條件下搖床培養的酶液酶活大小。
接種量對產酶的影響:操作同1.5.4,比較不同接種量至裝有約50mL液體培養基的250mL錐形瓶中繼續培養72h后的酶液酶活大小。
搖瓶發酵時間對產酶的影響:操作同1.5.4,比較轉接5%至裝有約50mL液體培養基的250mL錐形瓶中繼續培養的時間長短對培養后的酶液酶活大小。
2 結果與分析
2.1 豆腐乳半成品制備及取樣點設置

圖1 市售新鮮豆腐(a)及放置5d后自然發酵腐乳半成品(b)Fig.1 Fresh tofu (a) and semi-finished tofu products after 5d natural fermentation (b)
市售新鮮豆腐見圖1a,放置5d后自然發酵腐乳半成品見圖1b。由圖1b可知,此時腐乳上的微生物已經生長十分旺盛。選取具有明顯菌落特征的取樣點,共計7個,分別記為A、B、C、D、E、F、G。

圖2 特征性涂布平板Fig.2 Characteristic coated tablet
圖2a為在YPD培養基上涂布分離豆腐乳中野生菌株的典型情況;圖2b為在MRS培養基上涂布分離豆腐乳中野生菌株的典型情況;圖2c為在PDA培養基上涂布分離豆腐乳中野生菌株的典型情況。
涂布完成后,挑取涂布平板上生長單一的特征菌落,依據純化情況,劃線2次或3次。共得到單一菌株36株,從PDA平板上得到20株,YPD平板上得到9株,MRS平板上得到7株。根據培養基種類不同,依次編號為DFP-101~120(PDA培養基),同樣有DFY-101~109(YPD培養基),DFM-101~107(MRS培養基)。
2.2 腐乳分離菌株的酶活測量結果
從自然發酵腐乳中篩選得到單一菌株共36株,在接種量5%,20℃、200r/min搖瓶發酵培養條件下發酵72h,分別測得5’-AMP脫氨酶活性,結果見表1。

表1 具有產酶能力的菌株酶活測量結果Table 1 Enzyme activity measurements of strains with ability of enzyme production
實驗結果表明,具有5’-AMP脫氨酶活性的共計18株,且這些具有5’-AMP脫氨酶產酶能力的菌株多數在PDA培養基上篩選得到,說明產5’-AMP脫氨酶的菌株較多為霉菌。編號為DFP-102的菌株為5’-AMP脫氨酶的最高產菌株,在上述發酵條件下,5’-AMP脫氨酶的活力達到359.1U/mL。故選取此菌株進行下一步的發酵優化及菌種鑒定試驗。
2.3 菌種初步鑒定結果
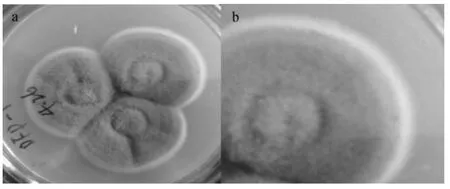
圖3 DFP-102菌落形態Fig.3 Colony morphology of DFP-102
圖3a為DFP-102的PDA培養基三點式培養菌落圖,圖3b為圖3a右上角菌落的放大圖。觀察DFP-102的菌落形態:灰色絮狀,菌落中間有小圓,邊緣呈白色,有同心圓,反面淺黃色。根據相關文獻資料[24-25]初步鑒定DFP-102分離菌株是毛霉菌屬。
2.4 發酵條件對DFP-102菌株產酶的影響
2.4.1 發酵液初始pH值對產酶的影響
按照1.5.4的方法實驗操作,結果(圖4)可知,在pH值為4.0~6.0時,酶活隨pH值的增加而增加,在pH值為6.0時,酶活達到最大值,此時5’-AMP脫氨酶活是359.1U/mL,當pH值高于6.0以后,酶活隨pH值的增加而下降。因此培養液的初始pH值確定為6.0。
2.4.2 搖瓶發酵培養溫度對產酶的影響
按照1.5.4的方法實驗操作,結果(圖5)可知,在18℃~24℃時,隨著溫度的上升,5’-AMP脫氨酶活性逐漸上升,在24℃時,酶活達到最高,此時5’-AMP脫氨酶活是390.6U/mL。隨溫度繼續上升,5’-AMP脫氨酶活性逐漸下降。因此搖床發酵培養溫度應控制為24℃左右。

圖4 發酵液初始pH值對酶活的影響Fig.4 Effect of initial pH value of the fermented liquid on enzyme activity
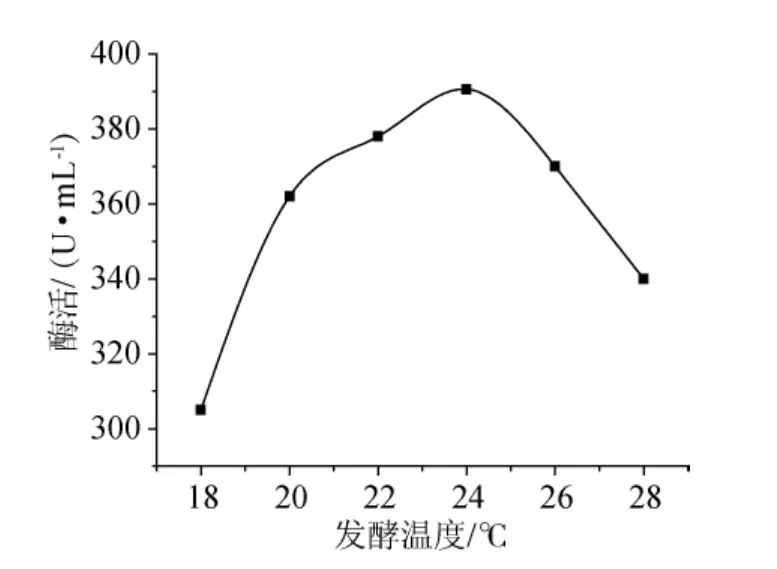
圖5 發酵溫度對酶活的影響Fig.5 Effect of fermentation temperature on enzyme activity
2.4.3 接種量對產酶的影響
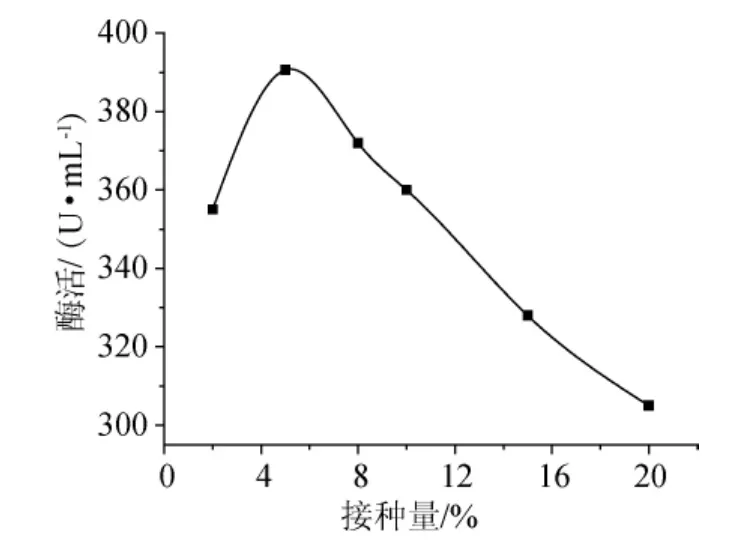
圖6 接種量對酶活的影響Fig.6 Effect of inoculum on enzyme activity
按照1.5.4的方法實驗操作,結果(圖6)可知,接種量大于5%后,隨著接種量的增加,酶活開始降低,因此接種量應選為5%,此時5’-AMP脫氨酶活性是390.6U/mL。
2.4.4 搖瓶發酵時間對產酶的影響
按照1.5.4的實驗方法操作,結果(圖7)可知,在12h~48h內,隨著時間的延長,酶的活性逐漸提高,發酵48h時酶活最高,此時5’-AMP脫氨酶活是472.3U/mL,繼續延長發酵時間,酶活逐漸降低,因此發酵培養時間確定為48h。
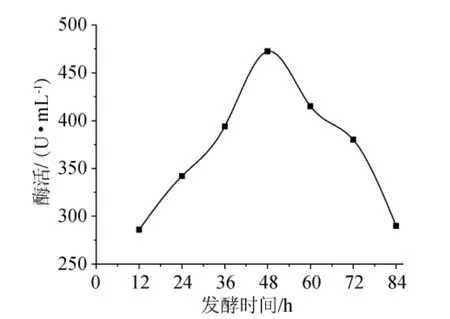
圖7 發酵時間對酶活的影響Fig.7 Effect of fermentation time on enzyme activity
3 結論
本研究從自制的自然發酵腐乳中進行菌株的分離與純化,篩選出單一菌株36株,其中檢測到具有5’-AMP脫氨酶活性的有18株。酶活最高的菌株為DFP-102(初步鑒定為毛霉菌屬,酶活為359.1U/mL)。經過搖床發酵培養條件的優化,DFP-102菌株產5’-AMP脫氨酶的最適宜發酵條件為培養基pH值為6.0,發酵溫度24℃,發酵時間48h,5%接種量。在該最佳發酵條件培養菌株后,5’-AMP脫氨酶活性可達472.3U/mL。本研究篩選得到的高產5’-AMP脫氨酶活性菌株來源于傳統發酵食品,具有較低的食品安全風險,且采用液體發酵培養法,生產周期較短,有利于5’-AMP脫氨酶大規模化生產并降低生產成本。后續將開展進一步的研究工作,包括DFP-102菌株的生化鑒定,嘗試對DFP-102進行菌株誘變得到更高的5’-AMP脫氨酶高產菌株,對于5’-AMP脫氨酶的性質研究,如穩定性,耐熱性等也有待進一步展開。本研究為5’-AMP脫氨酶的性質研究以及工業化生產打下了一定的基礎。
[1]張雪梅,蒲 彪.腐乳的研究概況與發展前景[J].食品與發酵工業,2005,31(5):94-97.
[2]汪立君,李里特,齊藤昌義,等.大豆發酵食品風味物質的研究[J].食品科學,2005(增刊):66-69.
[3]程永強,王曉輝,呼 晴.低溫發酵腐乳生產菌的微生物鑒定[J].食品科技,2009,34(5):2-5.
[4]魯 緋.腐乳發酵機理、品質改進和模式識別研究[D].北京:中國農業大學博士論文,2005.
[5]梁恒宇,程建軍,馬 鶯.中國傳統大豆發酵食品中微生物的分布[J].食品科學,2004,25(11):401-404.
[6]葉 煒,田呂明,姚 鵑,等.AMP 脫氨酶的生物性質研究[J].食品工業科技,2012,33(1):164-166.
[7]YOSHIMUNE K,KUGIMIYA K,MORIGUCHI M.Purification and characterization of a flavour-enhancing enzyme,thermostable adenosine-phosphate deaminase,from thermophilicAspergillus fumigatusNo.4[J].Ann Microbiol,2005,55(4):267-272.
[8]段作營,劉軍昌,毛忠貴.米曲霉腺苷酸脫氨酶的產酶條件[J].無錫輕工大學學報,2002,21(5):472-476.
[9]魏艷紅.纖維素酶產生菌的分離鑒定及產酶條件優化[D].武漢:華中師范大學碩士論文,2009.
[10]許 婧,歐陽嘉,何冰芳,等.組成型纖維素酶高產菌的篩選及產酶條件優化[J].食品與生物技術學報,2008,27(4):85-90.
[11]李琢偉,文連奎,胡耀輝,等.腐乳生產用毛霉高產端肽酶菌株誘變條件及發酵特性的研究[J].食品科學,2008,29(11):433-438.
[12]李劍峰,劉必謙,洪松柏,等.高產殼聚糖酶菌株的篩選及其產酶條件的優化[J].水生態學雜志,2010,3(3):127-131.
[13]RAHARDJOYS,SIE S,WEBER F J,et al.Effect of low oxygen concentrations on growth and alpha-amylase production model solid-state fermentation systems[J].Biomol Eng,2005,21(6):163-172.
[14]謝子文,王紅寧,鄒立扣.植酸酶畢赤酵母工程菌發酵條件優化研究[J].中國食品學報,2008,8(4):69-74.
[15]KIM DY,CHA CH,OH WS,et al.Expression of the promoter for the maltogenic amylase gene inBacillus subtilis168[J].J Microbiol,2004,42(4):319-327.
[16]HANNAN A,BAJWA R,LATIF Z.Screening ofAspergillus nigerstrains for pectinases production potential[J].J Biotechnol,2008,136:304-311.
[17]ZHANG XS,XU DJ,ZHU CY,et al.Isolation and identification of biosurfactant producing and crude oil degradingPseudomonas aeruginosastrains[J].Chem Eng J,2012,209:138-146.
[18]MISSOTTEN JAM,GORIS J,MICHIELS J,et al.Screening of isolated lactic acid bacteria as potential beneficial strains for fermented liquid pig feed production[J].Anim Feed Sci Tech,2009,150(1-2):122-138.
[19]劉軍昌,段作營,沈梅生,等.固態發酵生產腺苷酸脫氨酶[J].工業微生物,2002,32(1):36-39.
[20]張徐蘭,鄭 巖,吳天祥,等.腐乳中γ-氨基丁酸紅曲菌株的篩選及其生物學特性研究[J].中國釀造,2008,27(13):34-36.
[21]伍 玲,秦禮康.發酵豆制品中高產轉氨酶菌株篩選及固態菌劑制備[J].食品科學,2012,33(3):105-109.
[22]向 喜.家庭風味腐乳的加工[J].農村實用技術與信息,2003(6):54.
[23]劉軍昌,段作營,毛忠貴.AMP 脫氨酶活性測定的一種改進方法[J].食品與發酵工業,2001,20(7):30-33.
[24]布坎南,中國科學院微生物研究所譯.伯杰氏細菌鑒定手冊[M].北京:科學出版社,1984.
[25]魏景超.真菌鑒定手冊[M].上海:上海科學技術出版社,1979.

