響應面法優化玉米胚芽蛋白粉的酶改性工藝
趙 梅 韓忠杰 孫慶杰
(青島農業大學食品科學與工程學院,青島 266109)
玉米胚芽是玉米淀粉加工的副產品,在國內來源比較豐富,含有較高的脂肪及蛋白質,目前一般用于生產玉米胚芽油[1]。玉米胚芽粕是玉米胚芽提取玉米油后的殘渣,是玉米油廠的主要副產品,是一種玉米纖維和蛋白質為主的高營養物質[2],其中粗蛋白質量分數一般為23%~25%[3],含有人體必需的8種氨基酸,其生物效價PER值與WHO/FAO推薦值相近,并且具有吸油、持水、乳化等功能性質[4],能被廣泛地應用于肉制品、糕點及飲料等食品工業中。但一系列試驗表明,玉米胚芽蛋白很難兼顧幾種功能特性,或是很難達到某幾種特定功能性質的平衡。因此,為了使玉米胚芽蛋白得到更好的應用,必須改善其功能性質[5]。
蛋白質改性就是人為地對蛋白質結構進行修飾從而改善產品在制造、加工和保藏過程中的物理化學性質。目前對蛋白質進行改性主要有化學改性、物理改性、生物酶改性、基因工程改性和復合改性等[6]。酶法改性蛋白質不會導致營養素的損失,也不會產生毒理學方面的問題。而且蛋白質的酶法改性還具有反應時間短,專一性強,酶解程度可控制,在溫和條件下即可產生顯著效果等優點[7]。張春紅等[8]發現谷氨酰胺轉胺酶可以改善大豆濃縮蛋白的持水性和吸油性。黃衛寧等[9]認為添加TG改變了燕麥面團的熱力學性質。班進福等[10]研究發現MTG對餃子粉品質有明顯的改善作用,Sun等[11]研究了TG酶對肌纖維和豆分離蛋白共混物的凝膠性質的影響。但是孫煥等[12]研究TG酶改性大豆分離蛋白改性后發現盡管大豆分離蛋白凝膠性質增加了,但是溶解度降低了,起泡性和泡沫穩定性沒有出現太大影響,持水力也只達到了3.47。賀江航等[13]用TG酶改性魚肉蛋白凝膠硬度只能從4 N提高到14 N。盡管這些蛋白經過TG酶改性某個性質改善了,但是很難兼顧幾種功能特性的提高。本試驗著重研究了轉谷氨酰胺酶(MTG)改性玉米胚芽蛋白粉的最佳條件,如加酶量、改性時間等對玉米胚芽分離蛋白的凝膠性質的影響。此外,還探討了改性前后玉米胚芽蛋白粉其他功能性質的改善,為進一步研究玉米胚芽蛋白產品提供了一定的參考。
1 材料與方法
1.1 材料與試劑
玉米胚芽:臨沂魯洲集團;微生物谷氨酰胺轉氨酶(MTG,酶活力 100 U/g):德國 AB酶制劑公司;6號溶劑、磷酸二氫鉀、磷酸氫二鉀、鹽酸等均為分析純。
1.2 主要儀器
TA.XT Plus物性測試儀:英國Stable Micro Systems公司;BS224S型電子天平:北京賽多利斯儀器系統有限公司;752型紫外可見分光光度計:上海光譜儀器有限公司;PHS-3C精密pH計:上海雷磁儀器廠;FW100高速萬能粉碎機:天津市泰斯特儀器有限公司;LXJ-ⅡB離心機:上海安亭儀器廠;C-18F電磁爐:廣東銀港科技股份有限公司;電熱恒溫水浴鍋:龍口市先科儀器公司;BCD-257SL型冰箱:中國海爾集團;DHG-9070A型電熱恒溫鼓風干燥箱:上海精宏實驗設備有限公司。
1.3 方法
1.3.1 玉米胚芽蛋白粉的制取
取破碎玉米胚芽,按料液比1∶3加入6號溶劑,在40℃水浴下連續浸提6 h后進行抽濾脫脂,反復浸提、抽濾6次以上。將所得固體放于40℃烘箱進行烘干。將烘干后的樣品用高速萬能粉碎機粉碎,過100目篩,即可得到試驗所用玉米胚芽粉。
α-淀粉酶酶解:準確稱取一定量的玉米胚芽粉放于燒杯中,按液料比10∶1加入pH 5.2的磷酸鹽緩沖液,沸水浴30 min,之后冷卻至37℃。按照酶添加量3 000 U/g加入α-淀粉酶,37℃下反應3 h,離心干燥備用。
酸法提取:準確稱取一定量酶解后的胚芽粉,按料液比1∶9加蒸餾水攪拌均勻,滴加1 mol/L的鹽酸溶液調節至 pH 4.6。在37℃、攪拌速度為3 000 r/min下反應60 min,取出后離心取沉淀。重復上述步驟調節pH4.6進行酸沉,共重復3次。離心后的固體加入蒸餾水離心洗滌2次,經冷凍干燥即可得到玉米胚芽蛋白粉,蛋白質質量分數大約為40%。
1.3.2 改性玉米胚芽蛋白粉的制備方法
MTG改性玉米胚芽蛋白粉的流程:玉米胚芽蛋白粉加MTG→加pH 8的磷酸緩沖液→水浴(45℃)→離心(3 000 r/min,15 min)→40℃鼓風干燥→粉碎備用
1.3.3 MTG改性玉米胚芽蛋白粉的單因素試驗
底物質量分數:在改性時間2 h,加酶量10 U/g的條件下,研究底物質量分數為 4%、8%、12%、16%、20%對玉米胚芽蛋白粉硬度的影響。
改性時間:在控制底物質量分數為12%,加酶量為10 U/g的條件下,研究改性時間為 1、2、3、4、5 h對玉米胚芽蛋白粉硬度的影響。
加酶量:在控制底物質量分數為12%,改性時間為2 h的條件下,研究加酶量為 0、10、20、30、40 U/g對玉米胚芽蛋白粉硬度的影響。
1.3.4 響應面優化試驗
在單因素試驗的基礎上,以底物質量分數、改性時間、加酶量為試驗因素,酶改性玉米胚芽蛋白粉硬度為響應值,進行響應面優化試驗。采用Design Expert7.1統計軟件,進行Box-Behnken設計及響應面分析試驗。試驗因素水平表見表1。
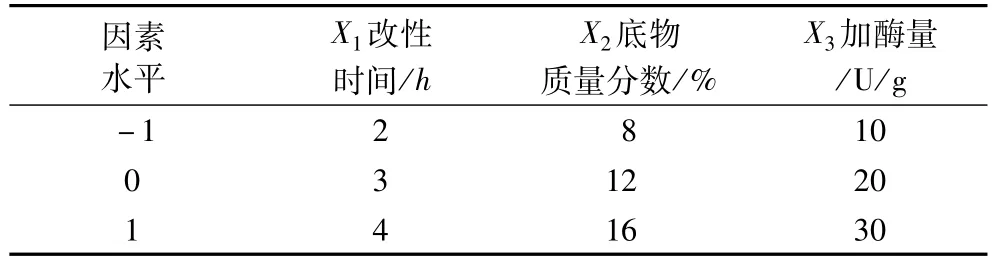
表1 響應面影響因素及水平
1.3.5 MTG改性玉米胚芽蛋白凝膠硬度測定
參照文獻[14]用質構儀進行測定。
1.3.6 MTG改性玉米胚芽蛋白功能性質的測定
持水力測定:稱取0.5 g改性后玉米胚芽蛋白粉,溶于9.5 mL蒸餾水中,用玻璃棒攪拌均勻,置于室溫下30 min,分散液以3 000 r/min離心10 min,稱量下沉物質量m(g),持水力(Water Binding Capability)用下式計算:
WBC=m/0.5
溶解性測定:將0.25 g玉米胚芽蛋白粉溶于10 mL蒸餾水中,攪拌1 h,分散液以3 000 r/min離心10 min,用凱氏定氮法測定上清液中的蛋白質含量,蛋白質的溶解度定義為上清液中的蛋白質含量占該溶液中蛋白質總量的百分數。
吸油性測定:準確稱取改性后樣品0.5 g置于10 mL離心管中,加入5 g玉米胚芽油,用玻璃棒攪拌均勻,放置30 min,用3 000 r/min的速度離心30 min,稱量下沉蛋白的質量m。吸油性(Fat Binding Capacity)的計算公式為:
FBC=m/0.5×100%
乳化性及乳化穩定性:測定參照Pearce等[15]的方法,用pH 8的磷酸緩沖液配制質量分數為0.6%的蛋白質懸浮液,取24 mL蛋白質溶液加入8 mL大豆色拉油,用剪切乳化儀在10 000 r/min下高速均質l min制成乳狀液,立即用移液管從底部取1 mL乳狀液,稀釋于 9 mL 0.1%SDS溶液中,以 0.1%SDS溶液作對照,立即用分光光度計在500 nm處測定吸光值(A0);放置20 min后,再次取樣測定。乳化活力(EA)以剛開始的吸光值A0表示,乳化穩定指數(ESI)用下式計算:
ESI=A0×Δt/ΔA
式中:A0為初始乳化液的吸光值;Δt為20 min:ΔA為20 min后的吸光度與A0之差。
起泡性及起泡穩定性:配制質量分數為1%的改性玉米胚芽蛋白溶液,取出100 mL在高速組織搗碎機中攪打(10 000 r/min)2 min,迅速倒入 200 mL量筒中,記錄泡沫體積V1,靜置10 min后再次測量泡沫體積V2,起泡性和起泡穩定性計算公式如下:
起泡性 =V1/100×100%
泡沫穩定性=V2/V1×100%
1.4 數據處理
采用Design Expert7.1統計軟件及Excell程序對試驗結果進行分析。
2 結果與分析
2.1 單因素對酶改性玉米胚芽蛋白粉凝膠硬度的影響
2.1.1 加酶量的影響
由圖1可以看出,隨著加酶量的增加,凝膠硬度隨之增大,當加酶量達到20 U/g后,隨著酶添加量的增加凝膠硬度降低。這是因為當底物濃度一定時,加酶量會存在一個臨界值[16]。酶添加量過少,酶不足以結合所有的底物,網狀結構形成不完全,所以凝膠硬度較低。但加酶量過高會破壞體系中的動態平衡,對底物-酶作用體系產生影響[17],導致出現加酶量增多,但凝膠硬度降低的結果。
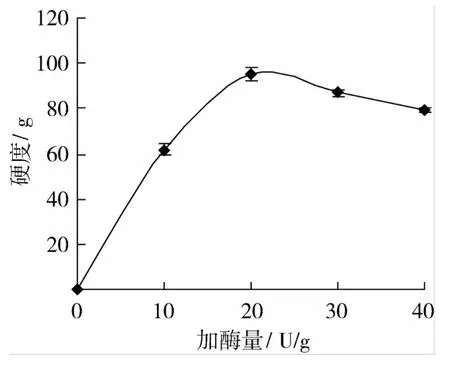
圖1 加酶量對玉米胚芽蛋白粉凝膠硬度的影響
2.1.2 底物質量分數的影響
由圖2可以看出,隨著底物質量分數的增加,凝膠硬度呈現先增大后減小的趨勢,底物質量分數為12%時凝膠效果最佳,當底物質量分數為4%時不成膠。這是由于當底物質量分數太小時,在一定時間內蛋白質底物接觸幾率降低,凝膠形成不完全。蛋白質凝膠的形成機制一般認為是蛋白質-蛋白質和蛋白質-溶劑的相互作用以及鄰近肽鏈之間的吸引力和排斥力平衡的結果,當蛋白質濃度較低時,蛋白質-溶劑相互作用占優勢,體系不易凝結成凝膠。當底物質量分數達到一定程度后,體系有效水濃度降低,使得底物蛋白分子和酶分子的碰撞幾率降低,從而反應速度降低,使得凝膠形成效率大大降低,凝膠硬度隨之降低。

圖2 底物濃度對玉米胚芽蛋白粉凝膠硬度的影響
2.1.3 改性時間的影響
由圖3可以看出玉米胚芽蛋白凝膠硬度隨著改性時間的增加先增加再降低,當改性時間為3 h時,凝膠硬度達到最大值。這是由于隨著酶作用時間的延長,酶與蛋白質底物不斷反應,形成的交聯產物不斷增多,從而提高凝膠硬度。但是改性時間繼續增加,凝膠硬度呈下降趨勢,可能是由于過長時間的熱處理導致蛋白質凝膠網絡中疏水基團變化、H鍵以及非共價鍵的斷裂有關[18]。

圖3 改性時間對玉米胚芽蛋白粉凝膠硬度的影響
2.2 響應面分析結果
2.2.1 響應面法的試驗結果及方差分析
響應面試驗設計及結果見表2。
利用Design Expert7.1對表2中的試驗數據進行回歸擬合,得到硬度Y與自變量改性時間(X1)、底物濃度(X2)、加酶量(X3)的二次回歸編碼方程模型為:
Y=95.25+5.32X1+1.61X2+11.84X3-12.95X1X2+3.99X1X3-0.011X2X3-20.36X12-14.54X22-15.12X32
由于二次回歸編碼方程模型的各個因素在響應面設計中均經過無量綱性編碼處理,且各因素間一次項、交互項與平方項的回歸系數均不相關,故可以根據編碼方程中各個回歸系數的絕對值大小直接比較各因素對響應值的影響程度,依次為:加酶量(X3)>改性時間(X1)>底物濃度(X2)。
通過方差分析來驗證模型及各參數的顯著性見表3。

表3 回歸分析結果
由表3可知失擬項P值為0.053 4,大于0.05表明失擬項不顯著,模型P值為0.025,小于0.05表明模型顯著。同時模型中的參數X3,X12,X22,X32都是顯著的。模型相關系數R2=0.87,表明模型擬合度較好,能較好地反映各因素與相應值變化的關系。
由圖4~圖6可直觀地了解各因素交互作用對響應值的影響。

圖4 底物質量分數和酶改性時間對硬度的影響

圖5 加酶量和酶改性時間對硬度的影響

圖6 加酶量和底物質量分數對硬度的影響
2.2.2 最優條件的求證及驗證
通過軟件Design Expert得到優化的酶改性玉米胚芽蛋白粉的工藝條件為改性時間3.18 h;底物質量分數 10.88%;加酶量 24.16 U/g,預測最佳凝膠硬度的理論值為98.165 g。對優化條件進行驗證試驗,重復3次,凝膠的硬度可達到98.13 g,預測值與理論值基本一致。說明響應面優化得到的最佳工藝條件可靠。
2.3 改性前后玉米胚芽蛋白功能性質對比
玉米胚芽蛋白粉提取工藝采用的是酶解結合酸解,與楊麗等[19]采用纖維素酶提取玉米胚芽蛋白質工藝流程相近,但是本試驗采用了不同的水解酶-淀粉酶,最后得到的玉米胚芽蛋白粉蛋白質質量分數與其纖維素酶法提取的蛋白質質量分數42.5%接近。本試驗做了大量重復試驗和放大試驗結果蛋白質含量變化不大,所以可以作為試驗材料。
在最佳改性條下,即加酶量 24.16 U/g;反應時間190 min;底物質量分數11%,得到的改性玉米胚芽蛋白粉與未改性玉米胚芽蛋白粉的功能性質見表4。
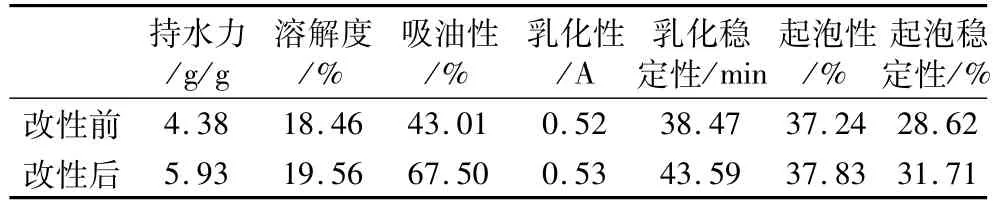
表4 改性對玉米胚芽蛋白粉功能性質的影響
由表4可知經改性處理后持水力增加了35.39%,這是由于以肽鏈中谷氨酰胺殘基的γ一羧酰胺基作為酰基供體,蛋白質或肽鍵上賴氨酸殘基的ε-氨基、游離氨基酸的ε-氨基作為酰基受體,它們在一定條件下形成蛋白質分子內和分子間的ε-(γ-谷氨酰)賴氨酸異肽鍵[20],使蛋白質分子發生交聯,形成分子內及分子間的網狀結構,從而截留住更多的水分。
改性后的玉米胚芽蛋白粉溶解性提高幅度不大,改善效果不明顯,約為5%。然而Babiker等[21]用TG對大豆分離蛋白改性試驗結果表明,經TG改性后的蛋白質溶解性得到明顯改善。這可能是由于MTG改性所導致的溶解性變化是有兩方面共同作用的結果:一方面是蛋白質分子交聯使分子量增大,從而溶解度下降;另一方面是TG的脫氨作用,使谷氨酰胺和天冬酰胺轉化為谷氨酸和天冬氨酸,離子化基團增多,溶解性增加[22]。
改性后吸油性較未變性蛋白提高了56.94%。這一方面是由于網狀結構能夠吸附更多的油,另一方面是由于網狀結構具有阻止油脂遷移的能力。
改性后玉米胚芽蛋白粉乳化能力沒有明顯改善,而乳化穩定性提高了13.31%。主要是由于MTG酶的作用,在蛋白質分子間和分子內引入了大量的氫鍵,使蛋白質形成了網狀結構,蛋白質-蛋白質或蛋白質-水的作用增加,體系的黏度增加,使乳化體系更加穩定。也有可能是改性蛋白結構內的部分疏水性殘基暴露在外,界面張力變小,因此乳狀液體系變的更加穩定。乳化能力與蛋白質的溶解性呈正相關,當溶解度提高,它在水-油界面擴散速度和吸附的能力大大提高,使得蛋白質疏水性殘基快速向油相排列,形成相應的界面性質[8]。而MTG酶的作用沒有改善溶解度,所以乳化能力的提高也很有限。
MTG酶改性后的玉米胚芽蛋白粉起泡能力沒有明顯改善,而泡沫穩定性提高10.8%。蛋白質的發泡能力與泡沫的穩定性一般是相反地,起泡能力是由蛋白質分子的快速擴散、疏水基團的暴露等因素決定,泡沫穩定性取決于溶液的流變學性質,主要有蛋白質的水合、分子間相互作用。由于改性后的蛋白質間或內相互作用增加,溶液黏度提高,使得形成的氣泡穩定性提高。
3 結論
3.1 在單因素試驗的基礎上,運用響應面分析法優化了玉米胚芽蛋白粉酶改性處理的條件。得到酶改性的最佳工藝條件為改性時間3.18 h;底物質量分數10.88%;加酶量24.16 U/g,在此工藝條件下得到的凝膠硬度為98.13 g。
3.2 MTG酶改性處理對于玉米胚芽蛋白粉持水力、吸油性、乳化穩定性、泡沫穩定性明顯提高,而對溶解度、乳化性和起泡性改善的不明顯。
[1]顧尤.玉米胚芽蛋白粉的性質及應用前景[J].糧油食品科技,2010,18(1):8-9
[2]楊麗,王聯結,鄭有為.玉米胚芽粕資源的綜合利用及展望[J].食品研究與開發,2011,32(11):205-208
[3]羅勤貴,廉小梅,歐陽韶暉.玉米胚芽粕在面包制作中的應用[J].西北農林科技大學學報:自然科學版,2007,35(7):231-234
[4]李寶玉,代小容.玉米胚分離蛋白提取及影響收率因素的初探[J].山東食品發酵,2008,(3):16-18
[5]WANG CR,ZAYASJF.Water retention and solubility of soy proteins and corn germ proteins in model system[J].Food science,1991,56(2):155-458
[6]肖蓮榮,任國譜.大米蛋白改性研究進展[J].食品與發酵工業,2012,38(2):151-156
[7]周楠迪,陳堅,鄭美英,等.谷氨酰胺轉胺酶的功能性質及其在食品中的應用方法[J].中國食品添加劑,2000(1):54-59
[8]張春紅,張瑩,趙菲.利用固定化酶改善酸法大豆濃縮蛋白持水性和吸油性的研究[J].食品工業科技,2011,32(3):208-210,214
[9]Huang W N,Li L L,Wang F,et al.Effects of transglutaminase on the rheological and mixolab thermomechanical characteristics of oat dough[J].Food Chemistry,2010,121:934-939
[10]班進福,魏益民,郭波莉,等.谷氨酰胺轉胺酶對餃子粉品質改良效果的研究[J].中國糧油學報,2008,23(6):33-36
[11]Sun X D,Arntfield,Susan D.Gelation properties of myofibrillar/pea protein mixtures induced by transglutaminase crosslinking[J].Food Hydrocolloids,2012,27(2):394-400
[12]孫煥,張春紅,陳海英,等.大豆分離蛋白的雙酶改性改善功能性的實驗[J].食品科技,2005(12):11-14
[13]賀江航,呂峰,黃金燕,等.TG催化魚肉蛋白共價交聯作用研究[J].徐州工程學院學報:自然科學版,2012,27(2):50-56
[14]唐傳核,楊曉泉,彭志英,等.微生物轉谷氨酰胺酶催化乳清蛋白聚合研究[J].中國乳品工業,2002,30(6):11-14
[15]Pearce K N,Kinsella JE.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].Journal of agriculture Food Chemistry,1978,26(3):716-723
[16]闞建全.食品化學[M].北京:中國農業大學出版社,2002,240-243
[17]吳海文,王強,馬鐵錚,等.轉谷氨酰胺酶催化花生濃縮蛋白對凝膠硬度和彈性的影響[J].中國油脂,2009,34(6):31-35
[18]徐幸蓮,程巧芬,周光宏.轉谷氨酰胺酶對蛋白質凝膠性能的影響[J].食品科學,2003,24(10):38-43
[19]楊麗,王聯結,鄭有為.酶法處理玉米胚芽粕提取蛋白質的條件初探[J].中國糧油學報,2011,26(5):97-101
[20]Nio N,Motoki M,Takinami K.Gelation mechanism of protein solution by transglutaminase[J].Agricultural and Biological Chemistry,1986,50(4):851-855
[21]Babiker E E.Effect of transglutaminase treatment on the functional properties of native and chymotrypsin-digested soy protein[J].Food Chemistry,2000,70:139-145
[22]張濤,江波,沐萬孟,等.酶法改性對鷹嘴豆分離蛋白功能性的影響[J].食品與發酵工業,2007,33(4):56-60.

