過(氧)硫酸根中硫和氧及臭氧中氧的氧化數與相應的氧化還原電對*
胡宗球
(華中師范大學化學學院 湖北武漢430079)
氧族元素位于元素周期表中ⅥA族,是元素化學教學中的重要內容之一。本文就氧族元素教學中的兩個問題提出商榷。
1 兩個問題
過一硫酸及其鹽和過二硫酸及其鹽是重要的含過氧鍵的化合物。其中,過二硫酸鹽是重要的強氧化劑,一般無機化學教材都給予了討論。我們以為例,討論硫的氧化數和該物質的氧化性本質問題。S的價電子組態為3s23p4,有6個價電子。雖然有些教材認為中S的氧化數為+7[1-4](依據的化學式作出的判斷),過一硫酸及其鹽中S的氧化數為+8[2-4],但按氧化數的概念,S的氧化數應為+6(元素的最高氧化數不超過價電子數)。這是因為中有一過氧鍵—O—O—,過氧鍵中O的氧化數為-1而非-2。在酸性條件下的還原產物是,S的氧化數并未改變,所變的是過氧鍵中O的氧化數(從-1降為-2),與H2O2還原為H2O時氧的氧化數變化情況一樣。

或氧化態-吉布斯自由能圖(圖1)[2]來表示氧族元素的電極電勢時,均把放在硫的系列。
從元素電勢圖不難看出,從右至左S的氧化數依次是:-2、0、+2、+2.5、+4、+6(),由-2到+6依次增加;那么,位于左邊的中S的氧化數是幾?如果S2O28-中S的氧化數也是+6的話,/就不能構成電對了。有的教材[7-8]也許意識到這個問題,在硫系列的元素電勢圖中并未列入;但是一常用的強氧化劑,回避并不意味著問題得到解決。
1.2 O3的氧化數問題
O3和O2互為同素異形體,是由同一元素形成的不同單質。雖然各種教材都沒有明確給出O3的氧化數,但按照通常的理解,單質的氧化數應為0。例如:O2、N2、X2、H2、P4、S8等,O3也是一樣。但國內外的教材[2-9]在構成氧系列的元素電勢圖時都表示成:
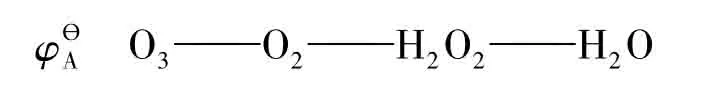

圖1 文獻[2]給出的酸性條件下硫、氧系列化合物的圖
這意味著可以構成電對:O3/O2。如同中S的氧化數問題一樣,如果這樣表達,O2的氧化數為0,則O3的氧化數必然大于0。
有教材[10]將O3看作O+4(O2)-2,但無論怎么講,O都不可能有+4氧化數,且這種表示(+4氧化數)與O3參與的所有氧化還原反應事實相悖。下面給出了幾個電極反應和氧化還原反應:
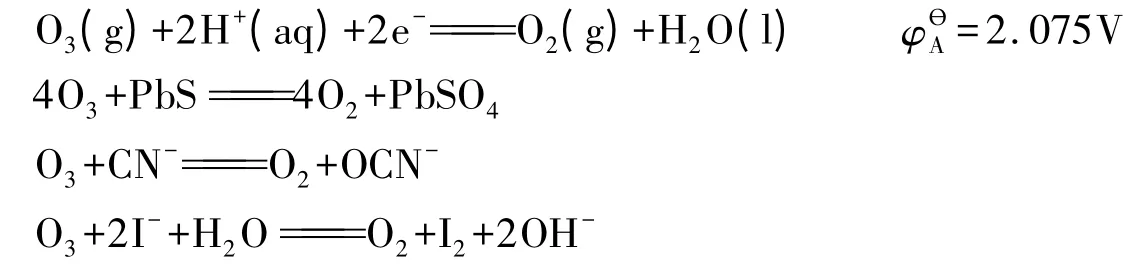
可以看出,無論是在酸性、中性或是堿性條件下,O3中總是有1個O獲得2個e-,生成氧化數為-2的含氧化合物或離子,還原半反應的本質是
2 建議
(1)將過硫化物歸于氧系列。
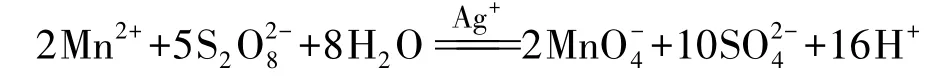
過硫酸及其鹽的分解也與過氧鍵的斷裂有關,并未改變S的氧化數:
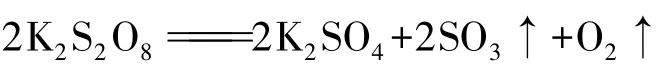
過氧化氫的實驗室制備為:

工業電解制備為:

其中的陽極產物水解反應為:
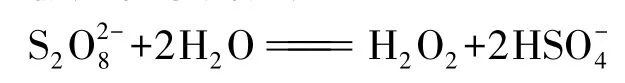
以上這些都說明過二硫酸(以及過一硫酸)及鹽應屬于氧系列而非硫系列。因而,在討論過硫酸及鹽的結構、制備、性質及用途時,將其放在過氧化氫之后較為合適。

將酸性條件下硫、氧系列化合物的氧化態-吉布斯自由能圖表示成圖2。
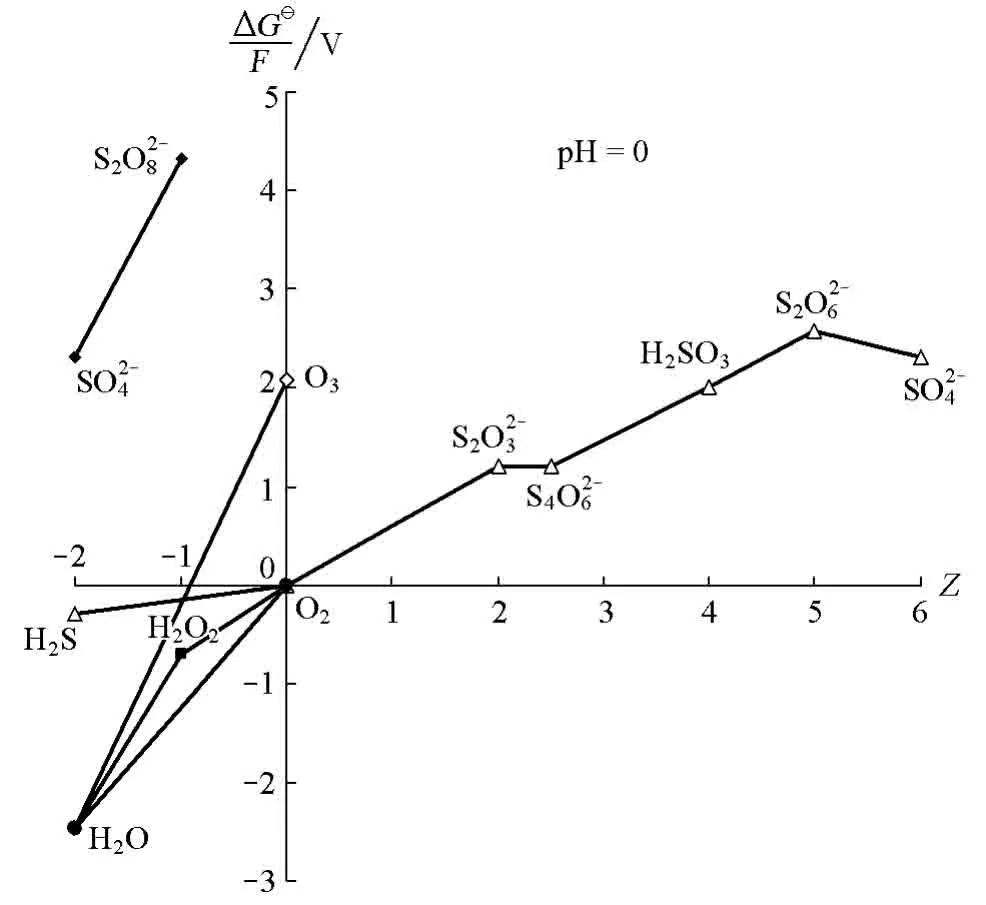
圖2 建議的硫、氧系列化合物的圖
國外有教材[9]將電對單列,但仍放在硫系列。作者認為這種方式仍然會引起讀者的誤解,不如放在氧系列更合適。
[1]華彤文,陳景祖.普通化學原理.第3版.北京:北京大學出版社,2005
[2]蔡少華,黃坤耀,張玉容.元素無機化學.廣州:中山大學出版社,1998
[3]北京師范大學,華中師范大學,南京師范大學.無機化學(下冊).第4版.北京:高等教育出版社,2003
[4]劉新錦,朱亞先,高飛.無機元素化學.北京:科學出版社,2005
[5]大連理工大學無機化學教研室.無機化學.第4版.北京:高等教育出版社,2001
[6]天津大學無機化學教研室.無機化學.第4版.北京:高等教育出版社,2010
[7]宋天佑,徐家寧,程功臻,等.無機化學(下冊).第2版.北京:高等教育出版社,2004
[8]Miessler G L,Tarr D A.Inorganic Chemistry.3rd ed.無機化學(影印版).北京:高等教育出版社,2004
[9]Geoffrey R C.Description Inorganic Chemistry.2nd ed.New York:W.H.Freeman and Company,2000
[10]張祖德.無機化學.合肥:中國科學技術大學出版社,2008

