經腦間質微穿刺注射胞磷膽堿治療腦缺血的有效劑量范圍研究*
陳 翯 韓 鴻賓 傅 瑜 馬長城 彭 蕓 岳云龍 張學梅
(北京大學第三醫院放射科 磁 共振成像設備與技術北京市重點實驗室,北京 100191)
為避開血腦屏障(blood-brain barrier,BBB)對藥物的阻擋作用,使藥物和靶細胞有效接觸,減小藥物劑量,避免常規給藥途徑造成的毒副作用,學者們從20世紀末開始嘗試經腦間質微穿刺給藥,其中最成熟的例子就是對流增強給藥方式(convection enhanced delivery,CED)應用于治療惡性膠質瘤[1]。但自其發明至今已有16年的歷史,其發展緩慢主要是由于給藥過程缺乏有效的監測手段,并且由于CED采用加壓給藥的方式,有潛在導致腦間質水腫等并發癥的可能。最近本課題組利用小分子藥物在腦間質內擴散的規律,建立了微穿刺經腦間質簡單擴散給藥(simple diffusion delivery,SDD)的方式。盡管已證實經腦間質途徑給予5μl濃度為50 mmol/L 的胞磷膽堿(cytidine 5’-diphosphocholine,CDPC)可有效保護梗死區域[2],但藥物發揮作用的有效劑量范圍及作用機制都尚不清楚。為解決上述問題,本研究擬對50 mmol/L周圍的濃度進行試驗來進一步明確經腦間質途徑應用微量CDPC治療腦缺血的有效劑量范圍,為經腦間質途徑的微創給藥治療提供參考依據。
1 材料與方法
1.1 實驗動物
56只普通級成年雄性SD大鼠購自北京大學醫學部實驗動物科學部[SYXK(京)2011-0039],體重260~320 g。動物實驗設計經北京大學醫學部倫理委員會審批通過(LA2009-008)。
1.2 分組
56只雄性SD大鼠隨機分成7組,各8只:對照組,尾狀核中心注射生理鹽水5μl;腹腔組,腹腔注射 CDPC 2 g/kg[3];實驗組1~5,尾狀核中心注射CDPC 5μl,濃度分別為25、40、50、60和75mmol/L。7組均于注射后2 h行永久性大腦中動脈栓塞(permanent middle cerebral artery occlusion,pMCAO)模型。
1.3 經腦間質途徑給藥
實驗組1~5:CDPC注射液(山東齊魯藥業)用生理鹽水稀釋至用藥濃度后備用。大鼠經復合麻醉劑(3 ml/kg)腹腔注射麻醉后,俯臥位固定于大鼠腦立體定位儀。切開頭皮,分離骨膜,暴露前囟,使用微量注射器將5μl不同濃度的CDPC溶液以0.2 μl/min的速度均勻手推注入大鼠腦內尾狀核區(前囟前1 mm,旁開3 mm,深4.5 mm)。注射完畢后留針5 min,再緩慢移出針頭。對照組注射方法相同,注射藥物改為生理鹽水5μl。腹腔組為腹腔注射CDPC 2 g/kg。
1.4 pMCAO 模型制作[4]
注射CDPC或生理鹽水后2 h,復合麻醉劑(3 m l/kg)腹腔麻醉后取仰臥位固定。潤滑液潤濕后備皮,做頸部前正中切口。沿氣管一側向下鈍性分離肌肉筋膜組織,保持術野清晰干凈,兩側皮膚與皮下組織用小拉鉤固定于手術臺,剪斷二腹肌,用電凝器分離下端筋膜,分離暴露右側頸總動脈。向上于頜下腺下方找到頸總動脈分叉,距分叉下1 cm處用微動脈夾夾閉頸總動脈,雙線結扎頸外動脈,距根部約0.5 cm,兩線間保證一定距離,剪斷。用電凝器夾閉頸外動脈小分支,查看頸內動脈各分支,辨認翼腭動脈,夾閉頸內動脈主干。在頸外動脈上剪一小口,將線栓經小口插入頸外動脈,松開經內動脈處的動脈夾,將栓子送入頸內動脈,插入深度(距頸總動脈分叉處)約為18~22 mm,有抵抗感時停止。栓子送入后,用手術縫線固定線拴,松開頸總動脈處的動脈夾,清理手術視野后,縫合頸部皮膚。術中用電熱毯使大鼠保持恒定體溫,術野覆蓋濕紗布。
1.5 梗死灶體積定量[5]
pMCAO術后12 h斷頭取腦。在-20℃條件下對新鮮鼠腦進行速凍以增加硬度,將鼠腦置于腦切片模具中,沿視交叉向后切片,每片厚約2 mm。將腦片置于0.2%的2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl-tetrazolium chloride,TTC)染色液中,在37℃溫箱中染色15~30 min(染色期間不斷翻動使染色均勻)。染色后的腦片經4%多聚甲醛固定并攝片。用Image-Pro-Plus 6.0軟件測量梗死灶的體積百分比,計算公式如下:
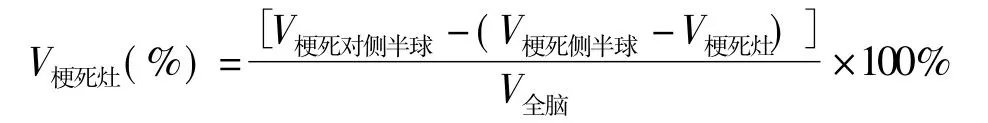
1.6 統計學分析
2 結果
見圖1,梗死灶體積百分比在pMCAO大鼠模型不同處理組間差異顯著(F=11.164,P=0.000)。實驗組2、3和4三組大鼠的平均梗死體積百分比明顯小于對照組(P均=0.000)。雖然實驗組1、5和腹腔組大鼠的平均梗死體積百分比與對照組相比有下降趨勢,差異無顯著性(P分別為0.419,0.965,0.423)。故認為經腦間質途徑應用CDPC治療腦梗死的有效濃度范圍是40~60 mmol/L。
3 討論
本研究證實,經腦間質途徑應用SDD微穿刺給予微劑量CDPC可成功避開BBB的阻擋,有效預防缺血性腦損傷,其有效濃度范圍是40~60 mmol/L,僅為常規腹腔給藥劑量的1/800,而神經保護效率卻極大提升,達到了微創治療的目的。盡管目前無法在腦缺血發生前對人體實施經腦間質途徑的預防性給藥,但是對于冠狀動脈旁路移植術后卒中的預防[6],或許這是一個潛在有效的替代措施。
腦間質自20世紀60年代發現以來,被認為是神經細胞與血液之間最重要的物質交換通道之一。正常腦組織中間質的平均容積分數超過20%[7],遠遠高于腦微血管占全腦容積的比例(<3%),為藥物在腦內的擴散與分布提供了解剖結構基礎。經腦間質給藥治療最早由Bobo等于1994年提出,其核心理念為CED,即通過施加一個正向液壓梯度向腦內持續注射藥物,該方法被認為是未來治療神經系統疾病的有效途徑[8]。CED的優勢在于大分子藥物在腦間質內擴散受限,應用持續加壓給藥可以使藥物到達靶區。由于CED采用持續加壓給藥,因此容易引起腦水腫等并發癥,有效性及穩定性仍待提高[9]。然而,對于小分子物質,如 CDPC,可以不借助任何外加壓力,只依賴局部濃度梯度所致的自由擴散運動就可到達靶區,這就使得非外加壓力性的微創、微劑量給藥(SDD)成為可能,并可有效避免CED因持續加壓注射引起的腦水腫等并發癥。
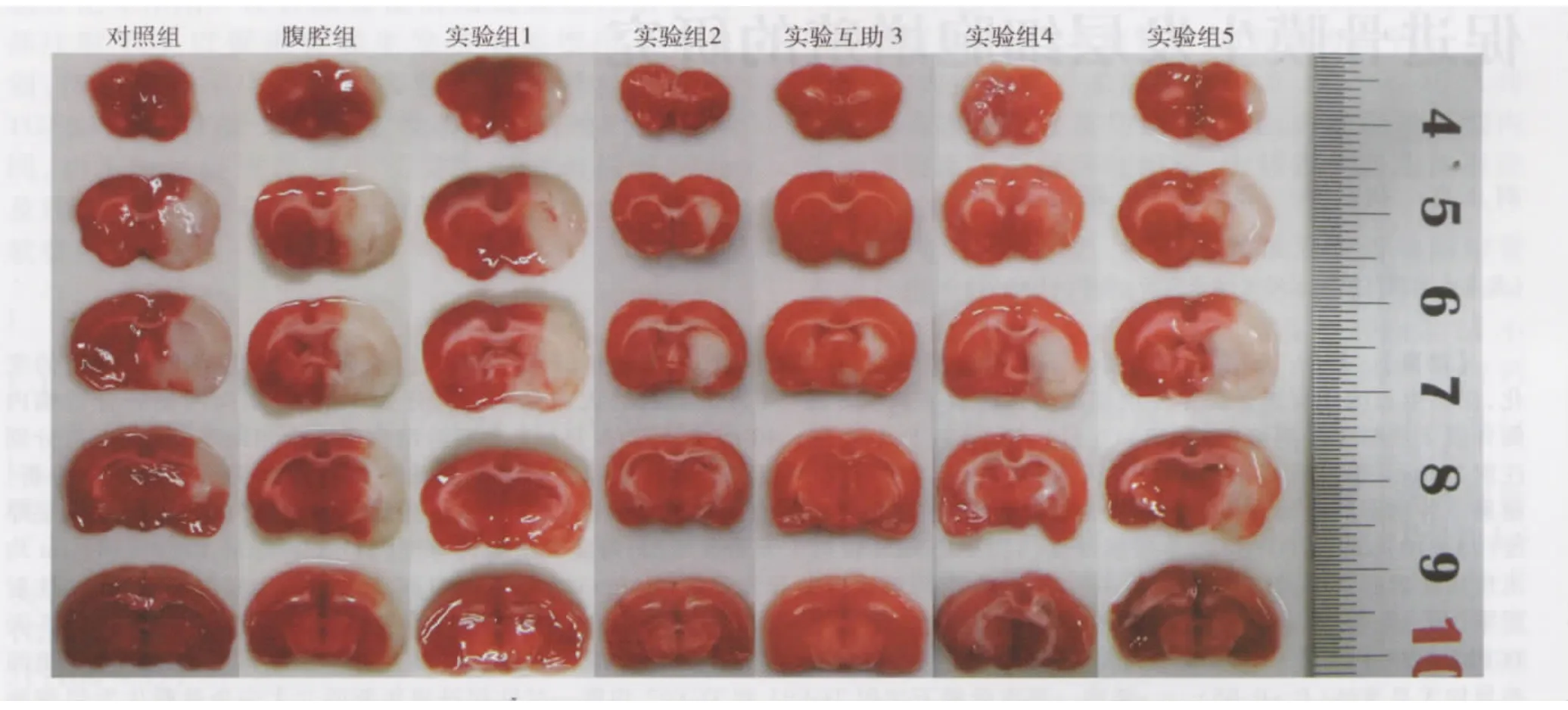
圖1 pMCAO大鼠模型不同處理組梗死灶的TTC染色結果(白色為梗死區,梗死體積百分比:對照組,27.7%±10.5%;腹腔組,24.0%±10.4%;實驗組1,27.5%±11.9%;實驗組 2,8.1%±4.1%;實驗組3,4.1%±2.0%;實驗組4,8.7%±2.4%;實驗組5,24.0%±12.9%)
決定CDPC神經保護效率的關鍵因素是到達靶組織的藥物局部濃度。根據擴散方程,腦ECS中的藥物濃度不僅依賴于擴散,還依賴于清除。既往關于腦脊液(cerebro-spinal fluid,CSF)腦內引流的研究表明,實驗所用放射性示蹤劑可在尾狀核內長時間貯留,2 h后僅有10%~15%的示蹤劑進入CSF團流[10],這一結論為本研究結果提供了佐證。而CDPC對側腦室旁組織和丘腦區的“乏保護”,則是清除速率過快的結果,推測與該區域BBB結構不完整有關[11]。此外,藥物清除還受到腦間質容積分數和迂曲度的影響,由腦缺血引起的細胞水腫,將會縮小腦間質的容積分數[12],增加迂曲度,從而降低藥物的清除速率,這可能也是CDPC藥效得以充分發揮的重要原因。
總之,本研究確定了經腦間質微穿刺注射CDPC治療腦缺血的有效藥物劑量范圍,為經腦間質途徑的微創給藥治療提供了有價值的參考依據。
1 Debinski W,Tatter SB.Convection-enhanced delivery for the treatment of brain tumors.Expert Rev Neurother,2009,9(10):1519-1527.
2 Han HB,Xia ZL,Chen H,et al.Simple diffusion delivery via brain interstitial route for the treatment of cerebral ischemia.Sci China C Life Sci,2011,54:235 -239.
3 Hurtado O,Moro MA,Cardenas A,et al.Neuroprotection afforded by prior citicoline administration in experimental brain ischemia:effects on glutamate transport.Neurobiol Dis,2005,18(2):336 -345.
4 Longa EZ,Weinstein PR,Carlson S,etal.Reversiblemiddle cerebral artery occlusion without craniectomy in rats.Stroke,1989,20(1):84-91.
5 Joshi CN,Jain SK,Murthy PS.An optimized triphenyltetrazolium chloride method for identification of cerebral infarcts.Brain Res Brain Res Protoc,2004,13(1):11 -17.
6 Hirsch WS,Ledley GS,Kotler MN.Acute ischemic syndromes following coronary artery bypass graft surgery.Clin Cardiol,1998,21(9):625-632.
7 Sykova E,Nicholson C.Diffusion in brain extracellular space.Physiol Rev,2008,88(4):1277 -1340.
8 Bobo RH,Laske DW,Akbasak A,et al.Convection-enhanced delivery ofmacromolecules in the brain.Proc Natl Acad Sci U SA,1994,91(6):2076 -2080.
9 Bidros DS,Vogelbaum MA.Novel drug delivery strategies in neurooncology.Neurotherapeutics,2009,6(3):539-546.
10 Szentistvanyi I,Patlak CS,Ellis RA,et al.Drainage of interstitial fluid from different regions of rat brain.Am JPhysiol,1984,246(6 Pt2):F835-F844.
11 Norsted E,Gomuc B,Meister B.Protein components of the bloodbrain barrier(BBB)in the mediobasal hypothalamus.J Chem Neuroanat,2008,36(2):107 -121.
12 Sykova E,Mazel T,Vargova L,et al.Extracellular space diffusion and pathological states.Prog Brain Res,2000,125:155 -178.

