類胡蘿卜素及其在番茄果實生長發育中的變化
劉云飛,萬紅建,袁 偉,俞 錁,楊悅儉
(1.浙江省農業科學院 蔬菜研究所,浙江 杭州 310021;2.南京農業大學 園藝學院,江蘇 南京 210095)
類胡蘿卜素是一類天然色素的總稱,是異戊二烯化合物,主要包括 β-胡蘿卜素、α-胡蘿卜素、葉黃素以及番茄紅素等。類胡蘿卜素廣泛存在于植物、動物、細菌以及真菌中,在人體內不能合成,必須由膳食中獲得。類胡蘿卜素具有極強的抗氧化活性,可延緩衰老。有研究報道,類胡蘿卜素可以減少冠心病、黃斑退化等與老化相關的疾病以及癌癥的發病率。番茄中的番茄紅素,雖然沒有維生素A的活性,但作為一種抗氧化和猝滅氧離子自由基的物質,是治療癌癥的一種有效物質[1]。另外,類胡蘿卜素中的β-胡蘿卜素是人和動物體內維生素A的合成前體。由此可見,類胡蘿卜素是人和動物進行正常生命活動必不可少的一類物質。番茄是提供類胡蘿卜素的重要蔬菜之一,也是研究類胡蘿卜素的模式植物,通過對番茄中類胡蘿卜素的研究,有助于深入了解類胡蘿卜素代謝途徑,更好的調控類胡蘿卜素的合成。
1 類胡蘿卜素的生理作用
對于植物本身而言,首先,類胡蘿卜素是葉綠體中重要的光合色素之一,它參與光合組織天線系統中光能的捕獲,同時也是光合反應中心葉綠素結合蛋白的重要組成部分。β-胡蘿卜素主要富集在PSI(光系統I)中,而在 PSII(光系統 II)中富集的是葉黃質,PSII反應中心的核心復合物上存在有β-胡蘿卜素。其次,類胡蘿卜素具有極強的抗氧化性能,它能猝滅由于強光或者生理生化反應產生的超氧陰離子自由基和單態氧離子等,進而保證有機體正常代謝功能的進行[2],有研究表明,β-胡蘿卜素的衍生物單環氧的玉米黃質也有類似功能[3]。此外,部分類胡蘿卜素還可與蛋白形成色素-蛋白復合體進而參與植物生理生化活動。植物類胡蘿卜素生物合成途徑中產生的環氧類胡蘿卜素堇菜黃質以及新黃質是植物激素脫落酸 (ABA)的生物合成的前體,類胡蘿卜素也與維持細胞膜的穩定性以及基因的表達有關。類胡蘿卜素合成過程中產生的新黃質在酶的作用下可以產生紫黃質,且這個反應可雙向進行,該反應與光強有關,可減少強光對植株的傷害。
2 類胡蘿卜素的理化特性
類胡蘿卜素是世界上最大的一類天然色素,是一類脂溶性物質。最早在胡蘿卜中發現,因此命名為胡蘿卜素,隨后又發現許多同胡蘿卜素相似的色素,最終將這一類物質定名為類胡蘿卜素,目前,已經發現超過600種的類胡蘿卜素。在植物中,類胡蘿卜素大量存在于紅色、黃色的花以及各種水果和蔬菜中[4]。類胡蘿卜素除了在光合系統中占有重要地位以外,它還參與植物花、果實等顏色的形成。有研究表明,類胡蘿卜素的總量在植物果實顏色的形成中并不起決定性作用,起決定性作用的是不同類胡蘿卜素的比例[4]。不同的類胡蘿卜素配比使植物的花、果實以及某些種類植物的葉片產生不同的顏色,以吸引昆蟲、鳥類或其他動物來幫助植物授粉和傳播種子,同時對園藝植物的觀賞性和經濟價值也有著重要作用。類胡蘿卜素是一類萜類化合物,萜類化合物的共同特點是由多個異戊二烯組成,即類胡蘿卜素具有很多雙鍵結構[5](圖1)。這些雙鍵決定著類胡蘿卜素的生理生化活性以及類胡蘿卜素的顏色,雙鍵具有較強的還原性,這就是類胡蘿卜素具有強抗氧化性的原因。類胡蘿卜素雙鍵系統中雙鍵的數目也與其顏色有關,類胡蘿卜素的顏色隨著分子結構中雙鍵數目的增加顏色越遠離紅色。

圖1 部分類胡蘿卜素的化學結構式
3 類胡蘿卜素的生物合成途徑
高等植物中類胡蘿卜素的合成途徑最早由Lincoln等[6]提出。Armstrong從一種光合細菌莢膜紅細菌中分離得到類胡蘿卜素生物合成的基因[7]。Misawa等[8]從菌類中克隆得到參與類胡蘿卜素生物合成途徑的相關基因。2001年 Moehs等[9]從高等植物中分離出類胡蘿卜素合成基因。
類胡蘿卜素在生物體中有多種合成途徑[10-11]。類胡蘿卜素可以在真菌和植物細胞液以及內質網上合成。在番茄果實中,類胡蘿卜素積累在特殊的質體 (載色體)中[12],合成途徑中的酶是由核內基因編碼并翻譯成蛋白質后轉運到質體中參與類胡蘿卜素的合成。類胡蘿卜素合成前體異戊二烯焦磷酸(IPP)是由乙酰CoA經羥甲基戊二酰-CoA形成甲羥戊酸,隨后再經激酶反應,產生甲羥戊酸焦磷酸,然后脫羧為 IPP,這一途徑稱為 MVA途徑。類胡蘿卜素生物合成途徑[12]如圖2所示。
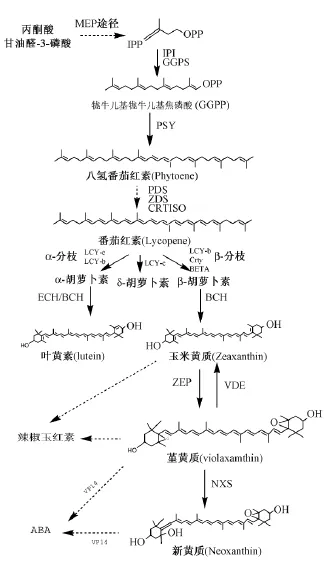
圖2 類胡蘿卜素合成途徑
丙酮酸和甘油醛-3-磷酸通過一系列酶合成牻牛兒基牻牛兒基焦磷酸 (GGPP)的合成前體,再經過IPP異構酶 (IPI)和牻牛兒基牻牛兒基焦磷酸合酶 (GGPS)的作用生成 GGPP,參與合成的丙酮酸和甘油醛-3-磷酸表明GGPP是由光合作用產生的葡萄糖轉化而來[13-14]。隨后,2個 GGPP在與膜相聯系的八氫番茄紅素合成酶 (PSY)的催化下縮合產生1,5-順式八氫番茄紅素,再在八氫番茄紅素脫飽和酶 (PDS)以及 ζ-胡蘿卜素脫氫酶(ZDS)等作用下產生番茄紅素。合成途徑中番茄紅素的下游,類胡蘿卜素生物合成反應主要分為2個分支:α-分支和 β-分支。其中 α-分支是番茄紅素在番茄紅素ε-環化酶 (LCY-e)和番茄紅素β-環化酶 (LCY-b)的作用下產生 α-胡蘿卜素和葉黃素;β-分支則是番茄紅素在 LCY-b等作用下生成β-胡蘿卜素。α-胡蘿卜素、葉黃素和 β-胡蘿卜素的生成并不是類胡蘿卜素合成途徑的終結,如產生的β-胡蘿卜素可以進一步作為其他類胡蘿卜素合成的原料,β-胡蘿卜素在一系列酶的催化下產生玉米黃質 (zeaxanthin),進而合成三色堇黃質和新黃質[12],產生的三色堇黃質和新黃質還可作為其他物質的合成前體。
4 類胡蘿卜素在番茄中的研究現狀
4.1 類胡蘿卜素在番茄果實中的變化
番茄是研究果實發育、進化以及生理生化等方面的模式植物[15]。番茄果實成熟過程可分為綠熟期、發白期、轉色期、粉紅期、紅熟Ⅰ期和紅熟Ⅱ期。紅果番茄中,各種類胡蘿卜素隨著果實不同成熟階段表現出不同的變化。程孫亮等[16-17]研究顯示,在番茄成熟過程中,類胡蘿卜素總體呈上升趨勢,最終類胡蘿卜素的含量達到果實未轉色時的10~14倍。番茄紅素在果實發白期開始出現,隨后積累量不斷增加,在果實粉紅期積累速度最快,紅熟Ⅱ期積累量達到最大;β-胡蘿卜素在綠熟期開始出現,含量在整個果實成熟過程中除在發白期略有下降之外,其余各階段皆處于上升狀態,在紅熟Ⅱ期達到頂峰;葉黃素的積累規律和 β-類胡蘿卜素積累規律相似,但其積累速度變化較 β-類胡蘿卜素相對平穩[16]。葉黃素和 β-胡蘿卜素在果實成熟過程中先降后升的原因可能是發白期前期合成的葉黃素和β-胡蘿卜素快速轉化為下游物質[17]。有研究[18]表明,類胡蘿卜素在果實的不同部位分布也有很大差異,β-胡蘿卜素在膠質中含量最高,番茄紅素在膠質中含量最低,大部分番茄紅素存在于果皮中,果實成熟期葉黃素的含量在膠質胎座中達到最大。
4.2 類胡蘿卜素合成途徑中相關基因的研究狀況
目前,類胡蘿卜素的合成途徑已經比較清晰,參與合成途徑的有關基因已取得一定的研究進展。植物中已有許多參與合成途徑的基因被克隆,其中不同來源的GGPP合成酶基因約有5個,其中有來自藻類的crtE,來自擬南芥的Ggps。在番茄中克隆的八氫番茄紅素合成酶基因有PSY1和PSY2,其中PSY1控制番茄花和果實成熟過程中的GGPP到八氫番茄紅素的合成過程,而PSY2控制綠色組織包括未轉色的果實中的相應過程[19-20]。番茄中除了擁有同其他植物共有的 β-環化酶基因 (LCY-b)外,還有其自身特有的類似基因 CYC-b[21],LCY-b與CYC-b有53%的相似性[20]。PDS定位于3號染色體上[22-24],其作用受到除草劑的抑制[20]。ZDS定位于1號染色體上,且發現該基因分子標記fc1.1[21]。CRTLSO 已 從 類 番 茄 中 克 隆 得 到,CRTLSO在番茄中催化合成反式番茄紅素的反應,解決了類胡蘿卜素異構化難題[25]。
番茄成熟時類胡蘿卜素各種成分及其含量決定著番茄果實的顏色,已發現控制番茄果實顏色有3對等位基因Y-y,R-r和 T-t,分別位于第1,3,10號染色體。另外,控制果色的基因還有 dg,B,MOB,hp,Del等。r基因是使類胡蘿卜素合成途徑中關鍵酶PSY喪失功能的突變基因,它阻礙GGPP向八氫番茄紅素轉化,使果實表現為黃色,且已發現與該基因連鎖的分子標記 TG621[22]。隱性純合tt基因使番茄果實中參與合成類胡蘿卜素的番茄紅素前體主要為順式結構,反式番茄紅素前體僅占2%[23]。高色素基因 (hp)和深綠色基因(dg)都可增加未成熟果實中葉綠素含量,葉綠素在番茄果實成熟過程中轉化為類胡蘿卜素,從而使類胡蘿卜素含量得到大幅度提高[22]。在番茄的生長過程中,果實內色素含量變化很大。果實中色素主要是類胡蘿卜素和葉綠素兩大類,其中類胡蘿卜素主要為番茄紅素、β-胡蘿卜素,葉綠素主要為葉綠素a和葉綠素b。番茄紅素是許多果實產生鮮亮紅色的主要原因[26],也是 β-胡蘿卜素的合成前體,它轉化為β-胡蘿卜素的過程由番茄紅素 β-環化酶 (LCY-b)催化,所以番茄紅素在果實成熟時的積累就要求低的 LCY-b表達活性[27],相反則需要增加其活性,可增加下游產物的合成量。除了直接合成的類胡蘿卜素外,葉綠體中色素在番茄果實成熟過程中會轉變為類胡蘿卜素,使整個葉綠體轉變為有色體。
4.3 番茄中類胡蘿卜素與果實成熟及糖含量的相關性
番茄中的類胡蘿卜素除影響果實顏色之外,還與果實的成熟以及果實成熟過程中糖的積累量有密切關系。類胡蘿卜素合成過程中產生的新黃質在酶的作用下產生紫黃質,新黃質與紫黃質已證實為ABA的合成前體[20],而ABA是果實成熟過程中的重要內源激素。在已經克隆的控制番茄果實成熟的Tom系列基因中,Tom5被定位在2,3號染色體上的八氫番茄紅素合成酶基因,其序列與莢膜紅細菌和歐文氏菌中發現的編碼原八氫番茄紅素焦磷酸合成酶的基因有較高的同源性[28],Dellapenna等[29]將Tom5的反義基因轉入番茄后發現類胡蘿卜素合成途徑受阻,果實成熟后呈黃色,而將Tom5基因正向導入黃色突變植株后可恢復合成番茄紅素能力。在番茄果實成熟過程中果糖和葡萄糖含量不斷升高,蔗糖含量不斷降低。有研究[18]顯示,糖含量的變化與類胡蘿卜素的含量呈現出一定的相關性,其中,番茄紅素和β-胡蘿卜素同果糖及葡萄糖的積累量呈現出顯著的正相關,而與蔗糖則表現為顯著的負相關性,這證明類胡蘿卜素合成前體物質GGPP由光合作用的葡萄糖轉化而來。
4.4 番茄中類胡蘿卜素合成途徑的調控
植物綠色組織主要通過感受光的強度以及光質來調控類胡蘿卜素合成,現已證實類胡蘿卜素合成在果實的調控機理與綠色組織中的有所不同[30-31]。Corona等[32-34]研究發現,在番茄進入轉色期以后,PSY1以及PDS的mRNA表達水平顯著提高,表明在此期間PSY1和PDS相當活躍,而參與下游合成的LCY-b等基因表達水平下降。目前發現的調控類胡蘿卜素合成的基因突變主要從3個方面進行影響合成:第1種是位于類胡蘿卜素合成途徑上游的基因發生突變,使得類胡蘿卜素含量整體降低,如t基因就是由于 CRTLSO缺失產生的[23,35];第 2種是合成途徑的下游尤其是番茄紅素之后的基因喪失功能,這會影響類胡蘿卜素各種組成的比例變化,但不會改變總體類胡蘿卜素的積累量,如已經發現的 Delta突變體[25,36];第3種可提高類胡蘿卜素總體含量的變異,如hp(高色素基因)能有效提植物高光合能力[37]。在類胡蘿卜素合成途徑中,除了轉錄水平上的調控外還存在轉錄后的調控,比如合成產物的積累會反作用于合成途徑的關鍵基因,使基因表達受到影響[20]。
5 基因工程在類胡蘿卜素方面的運用
自孟德爾遺傳規律發現以來,對于基因的研究一直是生物界的核心內容。從20世紀50年代起,人們在這一方面的研究取得了飛速發展。植物育種方面,已由原始的育種方式轉向與現代生物技術相結合的更為高效的育種方式,且更多的投入到控制某些性狀基因的研究。到目前為止,基因工程在提高植物中類胡蘿卜素含量等方面已經取得了一定的研究進展,較傳統遺傳育種方式更為明確、快速,運用范圍廣,而且番茄是研究類胡蘿卜素合成遺傳、生理生化以及分子生物學的模式植物,所以,利用基因工程對番茄類胡蘿卜素的研究越來越廣泛。
1956年就有研究[38]報道,hp突變植株能有效的提高類胡蘿卜素的水平,但是伴隨著這一突變而產生的植株矮小以及生活力衰退等問題,使得其在生產上的運用受到限制,含有該基因的漸滲系已被廣泛收集,這為提高類胡蘿卜素的研究提供了廣泛的資源[39]。許多類胡蘿卜素相關基因已成功導入番茄[40],但它們產生的作用各不相同。Bird等[41]將反義PSY1導入番茄,結果顯示類胡蘿卜素含量急劇下降,與此同時赤霉素含量上升;來自歐文氏菌的CrtI導入番茄后,β-胡蘿卜素增高而番茄紅素含量降低,同樣來源的CrtB導入番茄后則使八氫番茄紅素、番茄紅素以及-胡蘿卜素含量都增高[42-44];番茄 PSY1的 cDNA導入番茄,植株矮化,番茄紅素積累提前;來自擬南芥的 β-Lcy的cDNA導入番茄后,結果顯示在整體類胡蘿卜素含量不降低的情況下,β-胡蘿卜素得到增加[45];來自番茄的Det1導入番茄后,類胡蘿卜素及黃酮類增加[46]。但是另外一些基因在導入番茄后出現了在果實中不表達的情況,如來自副球菌的CrtW和CrtZ。為防止導入外源基因引起的不良反應,在導入基因中一般選擇番茄本身發現的基因,此外,啟動子的選擇也影響著基因的表達水平。有研究表明,Davuluri所用的啟動子DET1對于控制果實中類胡蘿卜素合成更為有效[46-47]。同樣,類胡蘿卜素在其他植物中也有研究,苦瓜中番茄紅素合成酶(PSY)與番茄紅素脫氫酶 (PDS)的表達程度是決定-胡蘿卜素積累量的關鍵因素[48],實驗中還通過組成成分分析 (PCA)證實,在果實不同成熟階段類胡蘿卜素的不同,且成熟果實中類胡蘿卜素含量比未成熟果實含量高。
抑制番茄環化酶的表達是增加番茄紅素含量最簡便而又有效的方法。目前已有通過基因庫中基因序列U46919和X86452構建成的在番茄果實中表達的有效載體,通過農桿菌轉化法成功導入番茄植株并獲得轉化植株,結果表明,通過 RNAi法(RNA干擾法)操縱類胡蘿卜素的合成可以高效提高植物中番茄紅素的含量[49]。不同來源的 PSY導入番茄后,對增加植物中類胡蘿卜素功效不同,Jacqueline Paine等[50]在研究黃金水稻中發現,來自黃水仙中的PSY在一定程度上限制 β-胡蘿卜素的積累,而把從玉米中發現的PSY與來自歐文氏菌體的CrtI組合后導入植株,可使植株中總類胡蘿卜素含量為普通黃金水稻的23倍,這也適用于其他植物。
除了通過導入類胡蘿卜素合成途徑中相關基因的方法來調控類胡蘿卜素合成外,Schofield等[51]又加以光處理的方法進行研究。番茄果實是在黑暗中被光照射打斷的條件下開始進入成熟,光中主要作用成分為紅光,實驗中暗處理過程用紅光或者紅光后加遠紅光 (R/FR)照射處理進行打斷,使果實進入成熟階段。實驗結果顯示,紅光處理的類胡蘿卜素積累量比在暗中或者R/FR處理的高50%,FR具有逆轉類胡蘿卜素積累作用,R/FR處理的類胡蘿卜素積累在PSY的活性峰中也表現明顯,這證實PSY可能是平衡調控基因。
6 番茄果實中類胡蘿卜素研究存在問題及其展望
雖然植物、真菌等中含有類胡蘿卜素,人及動物可從食物中獲得類胡蘿卜素,但類胡蘿卜素在植物等中的含量并不高,不能滿足人們的需要,因此,提高植物中類胡蘿卜素含量是解決這一矛盾的重要途徑。對于番茄而言,不同地區的人們傾向于不同色澤的果實,類胡蘿卜素作為番茄成熟果實中的主要色素,其含量及各種類胡蘿卜素的比例控制著成熟番茄果實的營養價值以及色澤。研究顯示,植物中類胡蘿卜素合成途徑基本相似,但不同物種中合成途徑相關基因在導入其他植物時其產生的效果各不相同,番茄中參與類胡蘿卜素合成基因在番茄果實類胡蘿卜素合成中的作用還有待進一步研究。目前許多研究者側重于已發現的合成途徑中主要限速酶及其基因的研究,可透徹了解這些環節的作用機制,但單純對其中的某個基因的研究并不足以全面的調控類胡蘿卜素的合成,因此對多個關鍵基因以及其他個別基因的研究也是不可或缺的。在研究控制番茄果實中類胡蘿卜素合成途徑中有關基因的同時也應注重基因間的相互作用和合成過程中產物對基因表達的調控,同樣也要注重其他物質對類胡蘿卜素的代謝的影響,比如糖類的積累。類胡蘿卜素在番茄果實中的積累控制著果實顏色,如何調整類胡蘿卜素在果實中的量及其各種類胡蘿卜素的比例狀況勢必成為育種中改變果實顏色的重要手段,此外,葉綠體向有色體的轉化及其轉化程度,也同樣控制著果實顏色,這些都有待進一步探討研究。
[1] Dias M C,Vieiralves N F L,Gomes M,et al.Effects of lycopene,synbiotic and their association on early biomarkers of rat colon carcinogenesis [J].Food and Chemical Toxicology,2010,48(3):772-780.
[2] Guil-Guerrero J,Rebolloso-Fuentes M.Nutrient composition and antioxidant activity of eight tomato (Lycopersicon esculentum)varieties[J].Journal of Food Composition and Analysis,2009,22(2):123-129.
[3] GilmoreA M, YamamotoH Y. Linearmodelsrelating xanthophylls and lumen acidity to non-photochemical fluorescence quenching.Evidence that antheraxanthin explains zeaxanthin-independent quenching [J]. Photosynthesis Research,1993,35(1):67-78.
[4] Rodríguez-Bernaldo de Quirós A, Costa H S.Analysis of carotenoids in vegetable and plasma samples:A review [J].Journal of Food Composition and Analysis,2006,19(2):97-111.
[5] RaoA, Rao L. Carotenoids and human health [J].Pharmacological Research,2007,55(3):207-216.
[6] Porter J,Lincoln R.1.Lysopersicon selections containing a high content of carotenes and colorless polyenes.2. The mechanism of carotene biosynthesis [J]. Archives of Biochemistryand Biophysics,1950,27:390-403.
[7] Armstrong G A.Genetics of eubacterial carotenoid biosynthesis:a colorful tale[J].Annual Reviews in Microbiology,1997,51(1):629-659.
[8] Misawa N,Nakagawa M,Kobayashi K,et al.Elucidation of the Erwinia uredovora carotenoid biosynthetic pathway by functional analysis of gene products expressed in Escherichia coli[J]. Journal of Bacteriology, 1990, 172 (12):6704-6712.
[9] Moehs C P,Tian L,Osteryoung K W,ey al.Analysis of carotenoid biosynthetic gene expression during marigold petal development[J].Plant Molecular Biology,2001,45(3):281-293.
[10] Bramley P M.Regulation of carotenoid formation during tomato fruit ripening and development[J].Journal of Experimental Botany,2002,53(377):2107-2113.
[11] Hirschberg J.Carotenoid biosynthesis in flowering plants[J].Current Opinion in Plant Biology,2001,4(3):210-218.
[12] Apel W,Bock R.Enhancement of carotenoid biosynthesis in transplastomic tomatoes by induced lycopene-to-provitamin A conversion[J].Plant Physiology,2009,151(1):59-66.
[13] Rodrigo M J,Marcos J F,et al.Biochemical and molecular analysis of carotenoid biosynthesis in flavedo of orange(Citrus sinensis L.)during fruit development and maturation [J].Journal of Agricultural and Food Chemistry,2004,52(22):6724-6731.
[14] Benedict C,Rosenfield C,Mahan J,et al.The chemical regulation of carotenoid biosynthesis in citrus [J]. Plant Science,1985,41(3):169-173.
[15] Sato S,Tabata S,Hirakawa H,et al.The tomato genome sequence provides insights into fleshy fruit evolution [J].Nature,2012,485:635-641.
[16] 程孫亮,周寶利,馬迎.紅果番茄果實成熟過程中類胡蘿卜素含量動態變化研究 [J].安徽農業科學,2007,35(22):6728-6728.
[17] Fraser P D,Truesdale M R,Bird C R,et al.Carotenoid biosynthesis during tomato fruit development(evidence for tissue-specific gene expression)[J].Plant Physiology,1994,105(1):405-413.
[18] 于洋,翁倩,周寶利.番茄果實成熟過程中不同部位類胡蘿卜素和糖含量變化及其相關性 [J].沈陽農業大學學報,2012,42(6):683-687.
[19] Fraser P D,Kiano J W,Truesdale M R,et al.Phytoene synthase-2 enzyme activity in tomato does not contribute to carotenoid synthesis in ripening fruit[J].Plant Molecular Biology,1999,40(4):687-698.
[20] 劉仲齊,薛俊,金鳳媚.番茄果實中類胡蘿卜素的合成及其調控 [J].天津農業科學,2005,11(1):6-11.
[21] Ronen G,Carmel-Goren L,Zamir D,et al.An alternative pathway to β-carotene formation in plant chromoplasts discovered by map-based cloning of Beta and old-gold color mutations in tomato[J].Proceedings of the National Academy of Sciences,2000,97(20):11102.
[22] Kinzer S,Schwager S,Mutschler M.Mapping of ripeningrelated or-specific cDNA clones oftomato (Lycopersicon esculentum)[J].Theoretical and Applied Genetics,1990,79(4):489-496.
[23] Isaacson T,Ronen G,Zamir D,et al.Cloning of tangerine from tomato reveals a carotenoid isomerase essential for the production of β-carotene and xanthophylls in plants [J].The Plant Cell,2002,14(2):333-342.
[24] 金鳳媚,薛俊,郟艷紅,劉仲齊.番茄果實顏色相關基因的研究進展 [J].天津農業科學,2006,12(4):3-6.
[25] Park H,Kreunen S S,Cuttriss A J,et al.Identification of the carotenoid isomerase provides insight into carotenoid biosynthesis, prolamellar body formation, and photomorphogenesis[J].The Plant Cell,2002,14(2):321-332.
[26] Skelton R L,Yu Q,Srinivasan R,et al.Tissue differential expression of lycopene β-cyclase gene in papaya [J].Cell Research,2006,16(8):731-739.
[27] Pecker I,Gabbay R,Cunningham F X,et al.Cloning and characterization of the cDNA for lycopene β-cyclase from tomato reveals decrease in its expression during fruit ripening[J].Plant Molecular Biology,1996,30(4):807-819.
[28] 李正國.果實成熟的基因調控 [J].生物工程進展,2000,20(3):30-34.
[29] DellaPenna D,Kates D S,Bennett A B.Polygalacturonase gene expression in Rutgers,rin,nor,and Nr tomato fruits [J].Plant Physiology,1987,85(2):502-507.
[30] Lintig J,Welsch R,Bonk M,et al.Light-dependent regulation of carotenoid biosynthesis occurs atthelevelofphytoene synthase expression and is mediated by phytochrome in Sinapis alba and Arabidopsis thaliana seedlings[J].The Plant Journal,1997,12(3):625-634.
[31] Fuentes P,Pizarro L,Moreno J C,et al.Light-dependent changes in plastid differentiation influence carotenoid gene expression and accumulation in carrotroots [J]. Plant Molecular Biology,2012:1-13.
[32] Carrari F,Fernie A R.Metabolic regulation underlying tomato fruit development[J].Journal of Experimental Botany,2006,57(9):1883-1897.
[33] Corona V,Aracri B,Kosturkova G,et al.Regulation of a carotenoid biosynthesis gene promoter during plant development[J].The Plant Journal,1996,9(4):505-512.
[34] Giovannoni J J. Fruit ripening mutants yield insights into ripening control[J].Current Opinion in Plant Biology,2007,10(3):283-289.
[35] Sandmann G.Molecular evolution of carotenoid biosynthesis from bacteria to plants[J].Physiologia Plantarum,2002,116(4):431-440.
[36] Ronen G,Cohen M,Zamir D,et al.Regulation of carotenoid biosynthesis during tomato fruit development:expression of the gene forlycopene epsilon-cyclase is down-regulated during ripening and is elevated in the mutant Delta[J].The Plant Journal,1999,17(4):341-351.
[37] Srinivas A,Behera R K,Kagawa T,et al.High pigment1 mutation negatively regulates phototropic signal transduction in tomato seedlings[J].Plant Physiology,2004,134(2):790-800.
[38] Reynard G.Origin of webb special(Black Queen)in tomato[J]. Report of the Tomato Genetics Cooperative,1956,6:22.
[39] Menda N,Semel Y,Peled D,et al.In silico screening of a saturated mutation library of tomato [J].The Plant Journal,2004,38(5):861-872.
[40] 馬敬,姜娜娜,王興軍.利用基因工程改良植物類胡蘿卜素的合成 [J].生物技術通報,2011(1):8-13.
[41] Bird C R,Ray J A,Fletcher J D,et al.Using antisense RNA to study gene function:inhibition of carotenoid biosynthesis in transgenic tomatoes[J].Nature Biotechnology,1991,9(7):635-639.
[42] R?mer S,Fraser P D,Kiano J W,et al.Elevation of the provitamin A content of transgenic tomato plants [J].Nature Biotechnology,2000,18(6):666-669.
[43] Fraser P D,Romer S,Shipton C A,et al.Evaluation of transgenic tomato plantsexpressing an additionalphytoene synthase in a fruit-specific manner[J].Proceedings of the National Academy of Sciences,2002,99(2):1092.
[44] 張建成,周文靜,鄧秀新.超表達草生歐文氏菌crtB基因促進轉基因番茄類胡蘿卜素合成的研究 [J].園藝學報,2010,37(3):390-396.
[45] Rosati C, AquilaniR, DharmapuriS, etal. Metabolic engineering of beta-carotene and lycopene content in tomato fruit[J].The Plant Journal,2000,24(3):413-420.
[46] Davuluri G R,Van Tuinen A,Fraser P D,et al.Fruit-specific RNAi-mediated suppression of DET1 enhances carotenoid and flavonoid content in tomatoes [J]. Nature Biotechnology,2005,23(7):890-895.
[47] Enfissi E M A,Fraser P D,Bramley P M.Genetic engineering of carotenoid formation in tomato[J].Phytochemistry Reviews,2006,5(1):59-65.
[48] Tuan P A,Kim J K,Park N I,et al.Carotenoid content and expression of phytoene synthase and phytoene desaturase genes in bitter melon(Momordica charantia)[J].Food Chemistry,2011,126(4):1686-1692.
[49] Wan Q,Zhang X G,Song M.Fruit-specific RNAi-mediated restraining expression of Lcy gene to enhance lycopene content in tomatoes[J].Chinese Journal of Biotechnology,2007,23(3):429-434.
[50] Paine J A,Shipton C A,Chaggar S,et al.Improving the nutritional value of Golden Rice through increased pro-vitamin A content [J]. Nature Biotechnology, 2005, 23 (4):482-487.
[51] Schofield A,Paliyath G.Modulation of carotenoid biosynthesis during tomato fruit ripening through phytochrome regulation of phytoene synthase activity [J]. Plant Physiology and Biochemistry,2005,43(12):1052-1060.

