LXRα-shRNA真核表達質(zhì)粒的構(gòu)建及抑制LXRα表達的有效序列篩選
張 琴 彭 俊 沈 薇 (重慶醫(yī)科大學附屬第二醫(yī)院消化內(nèi)科,重慶 40000)
肝X受體(LXRs)可參與機體多種生理活動調(diào)節(jié),包括脂肪代謝、膽固醇代謝等〔1,2〕。LXRs包括 LXRα 和 LXRβ 兩種亞型,其中前者主要表達于肝臟、脂肪組織等,后者廣泛表達于全身各組織〔3〕。在肝臟,LXRα是脂代謝的關(guān)鍵調(diào)控點,近年來研究顯示乙肝病毒X蛋白(HBx)可通過與LXRα相互作用調(diào)節(jié)參與脂肪酸和甘油三酯的酶如脂肪酸合酶(FAS)等的轉(zhuǎn)錄,從而引起脂代謝紊亂和肝細胞脂肪變性〔4〕。RNA干擾(RNAi)技術(shù)是近年來發(fā)展起來的一項特異性抑制基因表達的新方法,具有特異性、轉(zhuǎn)染效率高、作用強等優(yōu)點,已廣泛用于抗病毒抗腫瘤等研究〔5〕。我們前期實驗提示HBx可以上調(diào)LXRα的表達引起肝細胞脂肪變,為了進一步研究HBx的作用機制,本研究擬構(gòu)建能產(chǎn)生針對LXRα基因的短發(fā)夾小干擾RNA(shRNA)真核表達質(zhì)粒,并用構(gòu)建質(zhì)粒轉(zhuǎn)染HepG2.2.15細胞,篩選出高效沉默LXRα基因的序列,將對研究乙肝合并肝脂肪變的發(fā)生機制提供有力的工具。
1 材料與方法
1.1 主要試劑 載體pGenesil-1.1(含hU6啟動子、Kan/Neo抗性、EGFP熒光)及大腸桿菌 DH5α(武漢晶賽公司);HepG2.2.15細胞由本實驗室保存;T4DNA連接酶、限制性內(nèi)切酶Eco31I和SacI(Takara公司);通用陰性對照質(zhì)粒(武漢晶賽公司);質(zhì)粒小抽提試劑盒(BioRad公司);凝膠DNA回收試劑盒(美國Promega公司);轉(zhuǎn)染試劑PolyJetTM(SignaGen公司);小鼠抗人LXRα單克隆抗體(Abcam公司);山羊抗小鼠β-actin抗體(北京天根公司);總RNA抽提及逆轉(zhuǎn)錄試劑盒(Bioteke公司);核蛋白提取試劑盒(凱基生物),胎牛血清(杭州四季青公司)。
1.2 方法
1.2.1 靶序列的選擇 在GenBank中找到LXRα mRNA基因序列(基因NM號:001130101),通過www.genscript.com網(wǎng)站,根據(jù)RNA干擾設計原則設計三個siRNA作用的靶序列(表1)。
1.2.2 LXRα基因的shRNA真核表達質(zhì)粒的構(gòu)建 轉(zhuǎn)錄模板合成的引物結(jié)構(gòu)為CACC+Sense+Loop+Antisense+終止信號 +SacI,構(gòu)建質(zhì)粒載體插入的DNA模板序列見表2。模板中l(wèi)oop結(jié)構(gòu)選用了TTCAAGACG以避免形成終止信號,轉(zhuǎn)錄終止采用T6結(jié)構(gòu)(正義鏈和反義鏈由上海生工公司合成)。合成 DNA oligo 分別用 30 μl annealing buffer溶解,再各取 2 μl與16 μl annealing buffer混勻,94℃水浴退火自然冷卻至室溫,各取1 μl退火產(chǎn)物加入99 μl H2O做100倍稀釋。退火處理后的shRNA模板用于連接反應。

表1 LXRα基因的shRNA序列

表2 LXRα基因shRNA表達載體的模板序列
1.2.3 酶切和連接反應 質(zhì)粒載體pGenesil-1.1用Eco31Ⅰ酶切,1%瓊脂糖凝膠回收大片段。稀釋退火片段分別與線性化的pGenesil-1.1質(zhì)粒表達載體連接。連接反應條件:取稀釋退火片段 1 μl,線性化質(zhì)粒載體 1 μl,10 × ligase buffer 1 μl,T4 DNA ligase 1 μl,H2O 6 μl,置于 37℃水浴過夜。
1.2.4 重組質(zhì)粒載體的轉(zhuǎn)化、篩選 各取5 μl過夜的鏈接產(chǎn)物轉(zhuǎn)化感受態(tài)細胞DH5α,分別涂布與含kana抗性(終濃度為30 μg/ml)的LB平板上,37℃恒溫箱培養(yǎng)過夜。從每個培養(yǎng)皿上各挑取3個單克隆菌落接種于3 ml含kana抗性卡那抗性(終濃度為30 μg/ml)的LB培養(yǎng)基中,37℃恒溫搖床培養(yǎng)過夜。質(zhì)粒抽提試劑盒抽提重組質(zhì)粒,保存于-20℃冰箱備用,分別用SacI做酶切鑒定。酶切反應條件:質(zhì)粒DNA8.5 μl,10×ligase buffer 1 μl,SacI 0.5 μl,37℃水浴反應 3 h。
1.2.5 重組質(zhì)粒鑒定 ①酶切鑒定酶切后產(chǎn)物經(jīng)1%Agarose凝膠電泳,EB染液染色10 min,紫外燈觀察結(jié)果。②測序鑒定擴增菌液送上海生工公司測序。
1.2.6 細胞培養(yǎng)和分組HepG2.2.15細胞培養(yǎng)于含15%胎牛血清、200 μg/mlG418的 RPMI-1640培養(yǎng)基,37℃、5%二氧化碳孵箱培養(yǎng),每2~3天用25%胰酶消化傳代細胞分為5組,第1組為空白對照組;第2組為陰性對照組(HK組);第3、4、5組分別為 shRNA-LXRα1組、shRNA-LXRα2組、shRNA-LXRα3組。
1.2.7 質(zhì)粒轉(zhuǎn)染 待細胞長至80%~90%融合時接種于6孔板,次日按轉(zhuǎn)染試劑說明書操作步驟轉(zhuǎn)染細胞。第1組未轉(zhuǎn)染任何質(zhì)粒;第2 組以轉(zhuǎn)染試劑 PolyJetTM 4 μl∶1.5 μg HK 質(zhì)粒轉(zhuǎn)染細胞;第 3、4、5 組分別以 PolyJetTM 4 μl∶1.5 μg LXRα1、LXRα2、LXRα3質(zhì)粒DNA轉(zhuǎn)染細胞。轉(zhuǎn)染后10~18 h細胞換液。48 h后在熒光顯微鏡下觀察綠色熒光的表達。并計算轉(zhuǎn)染效率。EGFP為綠色熒光標志物,故根據(jù)細胞內(nèi)綠色熒光的數(shù)量可以判斷轉(zhuǎn)染陽性細胞的數(shù)量〔6〕。白光下固定一視野,細胞總數(shù)計數(shù),再轉(zhuǎn)換熒光光源計數(shù)攜帶綠色熒光的細胞數(shù),則轉(zhuǎn)染效率(%)=有熒光表達的細胞數(shù)/細胞總數(shù)×100%,每孔細胞隨機選取5個視野,重復3次,取其平均值。
1.2.8 RT-PCR檢測LXRα mRNA的表達 細胞轉(zhuǎn)染48 h后抽提各組細胞的總RNA,逆轉(zhuǎn)錄獲得cDNA,再以5 μl cDNA為模板,擴增 LXRα基因片段。LXRα基因引物為:上游:5'-GGAACAACTGGGCATGATCG-3',下 游:5'-ATAGCAATGAGCAAGGCAAACT-3'。產(chǎn)物長度:462 bp。β-actin引物為:上游:5'-TGACGGTCAGGTCATCACTATCGGCAATGA-3',下 游:5'-TTGATCTTCATGGTGATAG GAGCGAGGGCA-3'。 產(chǎn) 物 長 度:259 bp。PCR反應條件為:94℃預變性5 min,94℃變性30 s,57℃退火30 s,72℃延伸30 s,共35個循環(huán),最后72℃終延伸2 min。PCR產(chǎn)物經(jīng)2%瓊脂糖凝膠電泳,相對表達量用LXRα與β-actin灰度值的比值表示,采用Quantity-one軟件進行半定量分析。
1.2.9 Western印跡檢測LXRα蛋白的表達 質(zhì)粒轉(zhuǎn)染48 h后,細胞用胰酶消化,4℃離心,5 min收集細胞,預冷PBS洗3次,根據(jù)核蛋白提取試劑盒操作步驟提取各組細胞核蛋白。BCA法測定蛋白濃度,-70℃保存。上樣前蛋白樣品與等量2×蛋白處理液混勻,煮沸5 min,上樣到12%SDS-PAGE中,每孔按100 μg上樣,電泳分離后轉(zhuǎn)至硝酸纖維素膜,用5%脫脂奶粉搖床上封閉1 h,加入LXRα抗體(1∶2 000),4℃孵育過夜,次日PBST漂洗三次后加入二抗(1∶5 000),室溫孵育2 h,ECL顯色。用LXRα與內(nèi)參灰度比值表示LXRα蛋白的相對表達量,Quantity-one軟件比較后進行半定量分析。
1.3 統(tǒng)計學處理 采用SPSS13.0軟件,實驗數(shù)據(jù)用s表示。多樣本均數(shù)比較用方差分析。
2 結(jié)果
2.1 重組質(zhì)粒的酶切及測序 質(zhì)粒pGenesil-1.1的多克隆位點(MCS)如下:-MluI-hU6 promoter-Insert DNA-SacI-,在插入的目的基因片段里,我們分別設計了一個SacI的酶切位點,而質(zhì)粒載體pGenesil-1.1本身有一個SacI的酶切位點,若插入正確,質(zhì)粒就能被SacI酶切出一條約916 bp的DNA小帶。經(jīng)酶切鑒定分析三條重組質(zhì)粒均符合設計要求(圖1),送轉(zhuǎn)化菌液測序插入的片段堿基序列完全符合設計要求。

圖1 重組質(zhì)粒酶切圖譜
2.2 細胞轉(zhuǎn)染效率 陰性對照組和轉(zhuǎn)染重組質(zhì)粒的三組細胞內(nèi)均可見綠色熒光,未轉(zhuǎn)染質(zhì)粒的空白對照組細胞內(nèi)未見熒光(圖2);HK轉(zhuǎn)染組及 shRNA-LXRα1組、shRNA-LXRα2組、shRNA-LXRα3組平均轉(zhuǎn)染效率分別為:79.21% ±0.06%、79.19±0.0798%、79.24% ±0.08%、79.10% ±0.13%,各組細胞間轉(zhuǎn)染效率差異無統(tǒng)計學意義(P>0.05)。
2.3 RT-PCR檢測結(jié)果 空白對照組、HK組、shRNA-LXRα1組、shRNA-LXRα2組和 shRNA-LXRα3組 LXRα/β-actin比值分別為:0.83±0.02、0.84±0.03、0.28±0.03、0.52±0.04、0.53±0.03。與空白對照組和 HK 組比較,LXRα1、LXRα2和 LXRα3組中 LXRα mRNA表達較低,且 LXRα1組表達量明顯低于LXRα2和LXRα3組(P<0.05)(圖3)。
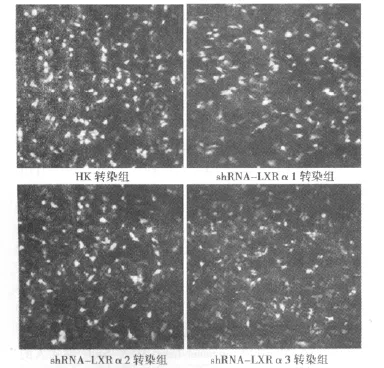
圖2 熒光顯微鏡觀察各組細胞轉(zhuǎn)染效率(×100)
2.4 Western印跡檢測結(jié)果 空白對照組、HK組、shRNALXRα1組、shRNA-LXRα2組和 shRNA-LXRα3組電泳條帶灰度值 LXRα/β-actin比值分別為:0.78±0.02、0.77±0.03、0.30±0.03、0.54 ±0.02、0.53±0.02。其中 LXRα1、LXRα2 和 LXRα3組LXRα蛋白表達低于空白對照組和HK組,且LXRα1組表達量明顯低于LXRα2和LXRα3組(P<0.05)(圖4)。
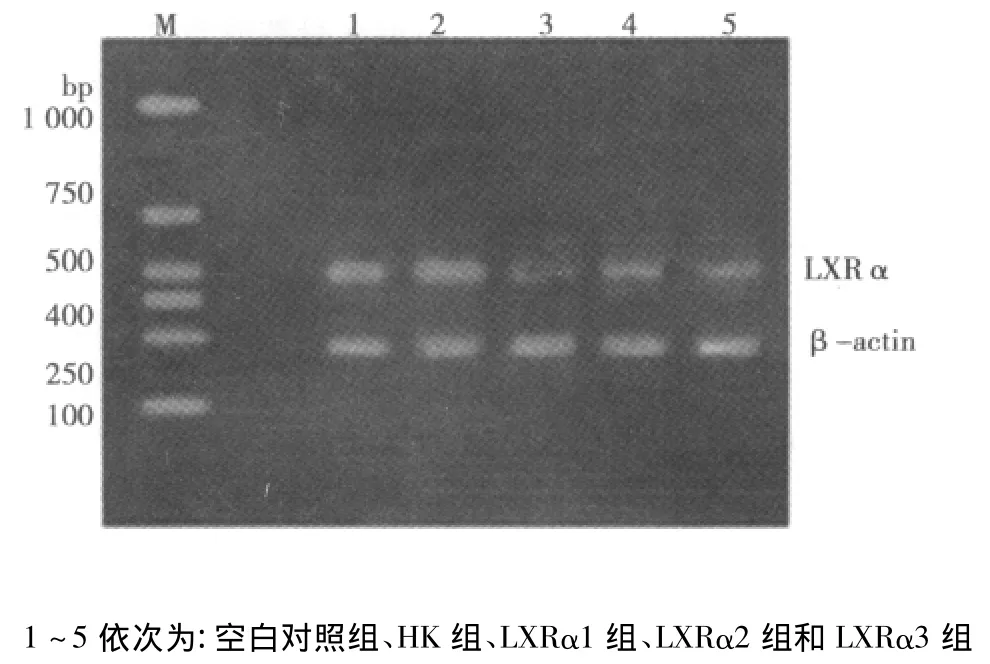
圖3 各組細胞LXRα mRNA的表達

圖4 各組細胞內(nèi)LXRα蛋白的表達
3 討論
LXRs是一種可以通過結(jié)合配體而激活的轉(zhuǎn)錄因子,屬于核受體家族成員,其主要包括LXRα和LXRβ兩個亞型,二者具有相同的核受體結(jié)構(gòu)〔7,8〕,LXRβ 表達廣泛,而 LXRα 僅在與脂代謝密切的肝臟、小腸、脂肪和巨噬細胞中高表達。LXRs與脂肪代謝有密切關(guān)系,被認為是全身脂質(zhì)代謝的感受器之一,它可以上調(diào)SREBP1c的表達從而調(diào)節(jié)多種參與脂肪酸和甘油三酯合成的酶的轉(zhuǎn)錄,包括FAS、ACC等,從而導致宿主細胞脂代謝紊亂和脂肪變性〔9〕。研究顯示LXRs激動劑可導致肝臟內(nèi)的脂肪沉積和血漿中甘油三酯水平升高,甚至發(fā)生肝脂肪變性,說明LXRs在肝脂肪變中起重要作用。近年來研究證實病毒性肝炎常合并不同程度的肝脂肪變,我們前期實驗提示乙肝病毒X蛋白(HBx)是乙肝合并肝脂肪變的主要病毒因素,且可能通過上調(diào)LXAα起作用,但其作用機制尚不明了。RNAi技術(shù),是近幾年來出現(xiàn)的一種轉(zhuǎn)錄后水平的基因沉默技術(shù),許多研究表明RNAi有很強的抑制目的基因的作用,具有穩(wěn)定性高、特異性強、效果顯著等優(yōu)點,被認為是PCR技術(shù)之后又一劃時代的基因工程方法。目前RNAi已經(jīng)廣泛用于抗病毒、抗腫瘤及疾病的基因治療的研究,并取得了良好的應用前景〔10〕。HepG2.2.15細胞系是將克隆的HBV DNA及含有新霉素抗性基因的質(zhì)粒導入人肝癌細胞建立的細胞株,它可以持續(xù)表達HBx。為了進一步研究HBx參與肝脂肪變性的作用機制,本研究擬用HepG2.2.15細胞為研究對象,構(gòu)建靶向LXAα的shRNA真核表達質(zhì)粒,為下一步研究提供基礎。
本實驗中的質(zhì)粒載體是帶有EGFP綠色熒光蛋白的,質(zhì)粒轉(zhuǎn)染后直接在熒光顯微鏡下觀察綠色熒光即可判斷轉(zhuǎn)染效率。高效的靶基因RNAi序列和通過有效的方法將質(zhì)粒導入細胞是RNAi成功的關(guān)鍵〔11〕,本研究設計的RNA干擾序列是根據(jù)通過計算機網(wǎng)絡和Tuschl新算法的設計原則設計的,通過酶切和測序鑒定提示序列的設計是完全符合要求的。以適宜比例的PolyJetTM和質(zhì)粒瞬時轉(zhuǎn)染入細胞,實驗發(fā)現(xiàn)細胞轉(zhuǎn)染后48 h綠色熒光蛋白的表達最高,且轉(zhuǎn)染效率都在78%以上,說明質(zhì)粒成功導入細胞,且我們設計合成的三條質(zhì)粒均能有效抑制LXRα mRNA及蛋白的表達,以shRNA-LXRα1沉默效果最好,我們的研究為進一步探索HBx對肝細胞脂肪變性的作用機制奠定了堅實的基礎。
1 Lee JH,Zhou J,Xie W.PXR and LXR in hepatic steatosis:a new dog and an old dog with new tricks〔J〕.Mol Pharm,2008;5(1):60-6.
2 Geyeregger R,Zeyda M,Stulnig TM,et al.Liver X receptors in cardiovascular and metabolic disease〔J〕.Cell Mol Life Sci,2006;63(5):524-39.
3 Zelcer N,Tontonoz P.Liver X receptors as integrators of metabolic and inflammatory signaling〔J〕.J Clin Invest,2006;116:607-14.
4 Kim K,Kim KH,Kim HH,et al.Hepatitis B virus X protein induces lipogenic transcription factor SREBP1 and fatty acid synthase through the activation of nuclear receptor LXRα〔J〕.Biochem J,2008;416(2):219-30.
5 Grimm D.Small silencing RNAs:state-of-the-art〔J〕.Adv Drug Deliv Rev,2009;61(9):672-703.
6 Erfle H,Simpson JC,Bastiaens PI,et al.siRNA cell arrays for high-content screening microscopy〔J〕.Biotechniques,2004;37(3):454-8.
7 Talukdar S,Hillgartner FB.The mechanism mediating the activation of acetyl-coenzyme A carboxylase-alpha gene transcription by the liver X receptor agonist t0901317〔J〕.J Lipid Res,2006;47(11):2451-61.
8 Wente W,Brenner MB,Zitzer H,et al.Activation of liver X receptors and retinoid X receptors induces growth arrest and apoptosis in insulin secreting cells〔J〕.Endocrinology,2007;148(4):1843-9.
9 Na TY,Shin YK,Roh KJ,et al.Hepatology liver X receptor mediates hepatitis B virus X protein-induced lipogenesis in hepatitis B virus-associated hepatocellular carcinoma〔J〕.Hepatology,2009;49(4):1122-31.
10 Withey JM,Marley SB,Kaeda J,et al.Targeting primary human leukaemia cells with RNA interference:Bcr-Abl targeting inhibits myeloid progenitor self-renewal in chronic myeloid leukaemia cells〔J〕.Br J Haematol,2005;129(3):377-80.
11 Ohnishi Y,Tokunaga K,Hohjoh H.Influence of assembly of siRNA elements into RNA-induced silencing complex by fork-siRNA duplex carrying nucleotide mismatches at the 3'-or 5'-end of the sense-stranded siRNA element〔J〕.Biochem Biophys Res Commun,2005;329:516-21.

