清肺化痰膠囊對慢性阻塞性肺疾病大鼠氣道上皮水通道蛋白-5表達(dá)的實驗研究
尹新中,劉桂穎,朱振剛,狄冠麟,陳 磊
(1.天津中醫(yī)藥大學(xué)第一附屬醫(yī)院呼吸科,天津 300193;2.天津中醫(yī)藥大學(xué)附屬保康醫(yī)院,天津 300193)
慢性阻塞性肺疾病(COPD)是一種具有氣流受限特征的可以預(yù)防和治療的疾病,氣流受限不完全可逆,呈進行性發(fā)展[1]。其患病人數(shù)多,病死率高[2]。
痰液是影響COPD病情和預(yù)后的危險因素,同時也是其病理產(chǎn)物,更是治療COPD的關(guān)鍵。本實驗通過清肺化痰膠囊對COPD大鼠氣道上皮細(xì)胞水通道蛋白-5(AQP-5)表達(dá)和肺組織勻漿中的中性粒細(xì)胞彈性蛋白酶(NE)水平的影響進而探討中藥治療COPD的作用機制。
1 材料與方法
1.1 材料
1.1.1 動物 雄性Wistar成年大鼠,鼠齡200 d,體質(zhì)量(200±20)g,由天津中醫(yī)藥大學(xué)實驗動物中心提供。
1.1.2 試劑 AQP-5免疫組化試劑盒(武漢博士德生物工程有限公司)、NE酶聯(lián)免疫吸附實驗(ELISA)A試劑盒(北京尚柏生物工程有限公司)。
1.2 方法
1.2.1 動物分組及造模 大鼠實驗環(huán)境馴養(yǎng)1周后,36只大鼠按隨機數(shù)字表法分為6組(模型組、空白組、清肺化痰組、氨溴索組、痰熱清組、紅霉素組),每組6只。參照文獻(xiàn)宋一平[3]、李澤庚[4]的方法制備COPD大鼠模型:6個實驗的大鼠除空白組外均參照文獻(xiàn)進行造模,即第1天和第14天氣管內(nèi)注入脂多糖(LPS)200 μg/200 μL,第 2~13 天、第 15~28天在72 L密閉箱內(nèi)熏5%大前門牌香煙,0.5 h,每日上午。
1.2.2 藥物制備及給藥方法 實驗用藥由天津中醫(yī)學(xué)院第一附屬醫(yī)院藥房統(tǒng)一購進。大鼠的用藥劑量按體表面積[5]比值進行換算,持續(xù)給藥14 d。模型組給予10 mL/kg生理鹽水灌胃;空白組不給藥;清肺化痰組給予清肺化痰膠囊溶液灌胃,按劑量0.56 g/(kg·d)給藥(清肺化痰膠囊配制成0.14 g/mL混懸液);氨溴索組給予鹽酸氨溴索注射液腹腔注射,2.7 mg/(kg·d);痰熱清組給予痰熱清注射液腹腔注射,1.8 mL/(kg·d);紅霉素組給予乳糖酸紅霉素腹腔注射,0.09 g/(kg·d)。
1.2.3 標(biāo)本制備 實驗第29天將大鼠頸椎脫臼處死。自劍突下由皮膚至皮下向上剪開胸腔,迅速暴露肺部,取左肺上葉和主支氣管,生理鹽水漂洗干凈,吸水紙拭干,置于10%中性甲醛溶液中固定,乙醇梯度脫水,二甲苯透明標(biāo)本,浸蠟,包埋,切片。0.2 g右肺中葉組織勻漿分別離心后留取上清液待檢測。
1.2.4 檢測方法
1.2.4.1 AQP-5的檢測 參照陳國兵[6]、王可[7]、劉少濱[8]的方法,5 μm切片脫蠟至水,3%的過氧化氫(H2O2)滅活內(nèi)源性過氧化物酶5~10 min,熱修復(fù)抗原,10%正常血清封閉 20 min,一抗(1∶1600)為兔抗大鼠AQP-5多克隆抗體,4℃過夜,加生物素化山羊抗兔 IgG(二抗),37℃,20 min,滴加鏈霉素和素復(fù)合體(SABC),37℃,20 min,各步后均在磷酸鹽緩沖液(PBS)中漂洗數(shù)次。二氨基聯(lián)苯胺(DAB)顯色,蒸餾水洗滌,蘇木素輕度復(fù)染,脫水,透明,封片,電子顯微鏡觀察,照相。陰性對照組滴加PBS代替AQP-5一抗,處理同前。染色結(jié)果判定:肺組織出現(xiàn)明確的棕黃或棕褐色顆粒為陽性。每組于400倍高倍鏡下隨機選取30個視域,用HMIAS-2000高清晰度彩色病理圖像分析系統(tǒng)進行定量分析。以0.207 μm 象素點長,在 1.8256×104μm2測量窗下,測量棕黃色反應(yīng)物信號的總面積(一個視域中陽性信號的總面積)、面積百分比(總面積與參考面積之比,也稱面密度)、積分光密度(各個單獨探測象素密度分布的總和,反應(yīng)陽性信號的強度),分析各組大鼠肺細(xì)支氣管上皮對AQP-5表達(dá)的相對水平。
1.2.4.2 NE的檢測 按照中性粒細(xì)胞彈性蛋白酶ELISA說明書,測定肺組織勻漿上清的NE。操作步驟簡述如下:1)加樣。2)棄去液體,甩干,不用洗滌。3)溫育,棄液,甩干,洗板。4)加檢測溶液B工作液,溫育。5)棄液,甩干,洗板。6)加底物溶液,顯色。7)加終止液。8)用酶聯(lián)儀在450 nm波長依序測量各孔的光密度(OD值)。在加終止液后立即進行檢測。
1.3 統(tǒng)計學(xué)處理 采用SPSS 18.0統(tǒng)計軟件進行。實驗數(shù)據(jù)均用均數(shù)±標(biāo)準(zhǔn)差(±s)表示,組間比較用t檢驗,P<0.05有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 各組大鼠肺組織病理改變 光鏡下(×100、×400)觀察:模型組大鼠支氣管上皮變性、壞死,纖毛缺失;管壁增厚,部分區(qū)域黏膜層上皮細(xì)胞脫落、不完整。肺泡壁可見塌陷、肺泡腔擴大及大泡形成;間質(zhì)及大氣管黏膜下可見大量淋巴細(xì)胞、中性粒細(xì)胞及組織細(xì)胞浸潤,小動脈壁明顯增厚。空白組未見上述改變。其余各治療組大鼠肺組織病理改變均輕于模型組,鏡下可見支氣管上皮輕度變性、脫落,部分纖毛缺失;管壁輕度增厚。肺泡壁未見明顯塌陷,偶見肺泡腔輕度擴大,未見大泡形成;間質(zhì)可見少量淋巴細(xì)胞浸潤。小動脈壁輕度增厚。見圖1、圖2。
2.2 各組大鼠肺細(xì)支氣管上皮細(xì)胞AQP-5免疫組化染色結(jié)果肺細(xì)支氣管上皮細(xì)胞AQP-5蛋白面積百分比、積分光密度模型組明顯低于清肺化痰組、沐舒坦組、紅霉素組、痰熱清組和空白組(P<0.05);清肺化痰組與空白組比較差異無統(tǒng)計學(xué)意義(P>0.05);清肺化痰組高于沐舒坦組、紅霉素組、痰熱清組,差異均有統(tǒng)計學(xué)意義(P<0.05)。見表1。

圖1 6組大鼠肺組織HE染色(×100)Fig.1 Lung tissue HE staining of six groups(×100)

圖2 6組大鼠肺細(xì)支氣管上皮細(xì)胞AQP-5免疫組化染色(×400)Fig.2 The immunohistochemical staining of AQP-5 bronchial epithelial cells(×400)
表1 各組大鼠肺細(xì)支氣管上皮細(xì)胞AQP-5表達(dá)(±s)Tab.1 Expression of AQP-5 in the bronchiolar epithelial cells of lung in rat(±s)

表1 各組大鼠肺細(xì)支氣管上皮細(xì)胞AQP-5表達(dá)(±s)Tab.1 Expression of AQP-5 in the bronchiolar epithelial cells of lung in rat(±s)
組別 n模型組 6空白組 6清肺化痰組 6痰熱清組 6紅霉素組 6沐舒坦組 6面積百分比(%)積分光密度(IOD值)1.353±0.5060112.958±44.1786.480±3.0001063.440±553.9425.230±1.6960599.235±166.3783.835±2.1210375.775±200.2041.679±1.0050201.229±128.0672.574±1.0940233.918±97.064
2.3 肺組織勻漿的NE含量檢測結(jié)果模型組明顯高于清肺化痰組、沐舒坦組、紅霉素組、痰熱清組和空白組,差異有統(tǒng)計學(xué)意義(P<0.05);而清肺化痰組與空白組、痰熱清組、紅霉素組比較,差異無統(tǒng)計學(xué)意義(P>0.05),清肺化痰膠囊組明顯低于沐舒坦組,差異有統(tǒng)計學(xué)意義(P<0.05)。見表2。
表2 各組大鼠肺組織勻漿NE水平(±s)Tab.2 The quantity of NE in the lung homogenate(±s)mg/mL
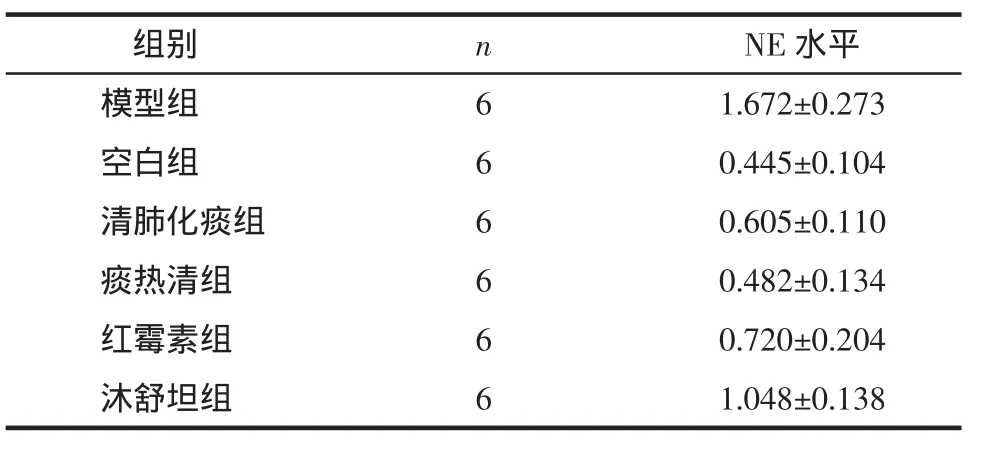
表2 各組大鼠肺組織勻漿NE水平(±s)Tab.2 The quantity of NE in the lung homogenate(±s)mg/mL
組別 n NE水平模型組 61.672±0.273空白組 60.445±0.104清肺化痰組 60.605±0.110痰熱清組 60.482±0.134紅霉素組 60.720±0.204沐舒坦組 61.048±0.138
3 討論
清肺化痰膠囊是本院呼吸科的協(xié)定處方,臨床用于治療COPD急性期患者頗有成效[9-10]。其依據(jù)COPD急性期以標(biāo)實為主,多見“痰、熱、瘀”,以清肺化痰,活血化瘀為主要治法而擬成。方中炙麻黃、生石膏一辛溫,一辛寒,一宣肺,一清肺,且能透邪于外,合用則相反之中寓相輔之意,宣肺平喘而不助熱,清解肺熱而不涼遏。杏仁降利肺氣而平喘咳,與麻黃相配則宣降相因,與石膏相伍則清肅協(xié)同。吳繼全[11]認(rèn)為肺系病常影響腸胃功能,肺氣不降易致胃氣不降,而有脹滿、大便不暢等表現(xiàn),常選具有肺胃同治藥物,如杏仁。黃芩、瓜蔞清肺化痰,半夏、厚樸降氣化痰止咳,桃仁祛瘀通絡(luò)平喘,炙甘草調(diào)和諸藥。諸藥相伍,共奏清肺化痰、活血祛瘀之功效。
黏液的黏稠度由黏蛋白和水分的多少決定,AQP-5是一參與水分轉(zhuǎn)運的跨膜蛋白,其表達(dá)與功能異常將引起水鹽代謝失衡而影響氣道黏液的黏稠度[12]。AQP不僅與水轉(zhuǎn)運有關(guān),還可能參與氣道黏液分泌調(diào)節(jié)以及氣道反應(yīng)性的調(diào)節(jié),因而AQP可能與氣道阻塞性疾病如COPD、肺囊性纖維化、哮喘等有關(guān)[13]。從目前的研究來看,已發(fā)現(xiàn)10余種AQP,其中AQP-5決定著氣道表面液體層的含水量,進而影響氣道表面液體層的理化性質(zhì),影響著黏液纖毛清除系統(tǒng)的功能,從而影響?zhàn)ひ悍置跔顟B(tài),因此,與呼吸道黏液高分泌相關(guān)的水通道蛋白多選用AQP-5[14]。陳智鴻等通過實驗研究表明AQP-5基因缺失可能使小鼠氣道過敏原的應(yīng)激性提高,從而促進黏液高分泌[15]。王可等[7]的研究表明,COPD患者的黏膜下腺AQP-5較對照組表達(dá)降低,氣道上皮分泌的哮喘氣道黏蛋白(MUC5AC)以及黏膜下腺分泌的黏蛋白較對照組均增加,且AQP-5的表達(dá)與MUC5AC和黏蛋白的分泌具有負(fù)相關(guān)關(guān)系,提示AQP-5可能參與了COPD患者氣道黏液分泌。
NE可使腺體分泌增多,纖毛上皮細(xì)胞受損,還能誘導(dǎo)白細(xì)胞介素-8(IL-8)的分泌,或分解激肽釋放酶原使激肽釋放酶具有活性,放大炎癥反應(yīng)。另外,NE可增強病原菌與上皮細(xì)胞間的黏附力,使感染容易發(fā)生,還可降低補體或抗體的調(diào)理作用,降低病原菌的清除率,并且是目前已知的促黏蛋白生成和分泌的最強刺激因子,并呈時間依賴性增加氣道黏蛋白的表達(dá)[16]。NE能夠消化、降解細(xì)胞外基質(zhì)和上皮連接結(jié)構(gòu)造成氣道上皮完整性破壞和肺組織損傷,并通過促進炎性細(xì)胞聚集,引起黏液高分泌等機制促使慢性阻塞性肺疾病氣道炎癥與重構(gòu)的發(fā)生[17]。
本實驗結(jié)果表明,清肺化痰膠囊治療COPD,其機制在于能調(diào)節(jié)AQP-5的表達(dá),調(diào)節(jié)黏蛋白分泌,抗炎癥反應(yīng),抑制NE的表達(dá),調(diào)節(jié)蛋白酶-抗蛋白酶失衡,從而改善黏液高分泌狀態(tài),起到緩解COPD臨床癥狀、促進排痰、提高生活質(zhì)量的目的。本實驗設(shè)計中還存在不足,比如所用大鼠數(shù)量少,兩組實驗數(shù)據(jù)的相關(guān)性分析未完成。最后,因中藥的多靶點效應(yīng),清肺化痰膠囊調(diào)節(jié)大鼠氣道上皮APQ-5表達(dá)的作用途徑尚不明確,有待更進一步探索研究。
[1]中華醫(yī)學(xué)會呼吸病學(xué)分會慢性阻塞性肺疾病學(xué)組.慢性阻塞性肺疾病診治指南(2007年修訂版)[J].中華結(jié)核和呼吸雜志,2007,30(1):8-17.
[2]林旋齡,鐘亮環(huán),劉小虹.治喘之法,不只在于肺腎亦在于脾[J].天津中醫(yī)藥大學(xué)學(xué)報,2010,29(4):177-178.
[3]宋一平.慢性阻塞性肺疾病大鼠模型的建立及藥物干預(yù)的影響[J].中華內(nèi)科雜志,2000,39(8):556-557.
[4]李澤庚,王傳博,彭 波,等.慢性阻塞性肺疾病痰瘀阻肺證大鼠模型的建立[J].天津中醫(yī)藥,2010,27(1):43-45.
[5]徐叔云,卞如濂,陳 修,等.藥理實驗方法學(xué)[M].北京:人民衛(wèi)生出版社,2006:195-201.
[6]陳國兵,許 峰,盧仲毅,等.不同發(fā)育階段大鼠肺水通道蛋白表達(dá)的變化[J].中國當(dāng)代兒科雜志,2008,10(4):523-526.
[7]王 可,馮玉麟,文富強,等.慢性阻塞性肺疾病患者氣道上皮水通道5的表達(dá)與黏液高分泌[J].中國呼吸與危重監(jiān)護雜志,2006,5(5):357-360.
[8]劉少濱,歐陽金生,黃紹光,等.氨溴索對脂多糖-煙霧誘導(dǎo)大鼠水通道蛋白5的影響[J].上海交通大學(xué)學(xué)報(醫(yī)學(xué)版),2008,28(3):307-310.
[9]劉蘭萍,尹新中,劉貴穎,等.清肺化痰膠囊治療COPD急性發(fā)作期臨床觀察 [J].遼寧中醫(yī)雜志,2008,35(12):1867-1868.
[10]尹新中,劉貴穎,張慧琪,等.中西醫(yī)結(jié)合治療慢性阻塞性肺疾病急性加重期 30 例臨床分析[J].天津中醫(yī)藥,2005,22(2):117-118.
[11]吳繼全,王雪京,張洪春,等.晁恩祥教授治療肺系病的特色經(jīng)驗[J].天津中醫(yī)藥,2008,25(5):358-359.
[12]周 正,劉劍波.糖皮質(zhì)激素對哮喘小鼠肺組織水通道蛋白5表達(dá)的影響[J].江蘇醫(yī)藥,2010,36(8):924-926.
[13]郭 玉,劉少濱.呼吸道水通道蛋白研究進展[J].國際呼吸雜志,2007,27(17):1352-1355.
[14]陳智鴻,白春學(xué).氣道黏液高分泌與上皮通道蛋白關(guān)系的研究進展[J].國際呼吸雜志,2007,27(11):870-872.
[15]陳智鴻,沈 瑤,董春玲,等.水通道蛋白敲除對支氣管哮喘小鼠氣道黏蛋白譜表達(dá)的影響[J].國際呼吸雜志,2008,28(23):1409-1412.
[16]張 偉,蔡映云.中性粒細(xì)胞彈性蛋白酶與炎癥性肺部疾病[J].國外醫(yī)學(xué)·呼吸系統(tǒng)分冊,2002,22(4):171-174.
[17]胡雪華,張洪玉,龐寶森.中性粒細(xì)胞彈性蛋白酶與慢性阻塞性肺疾病[J].國際呼吸雜志,2007,27(13):989-991.