αB-晶狀體蛋白在不同周齡正常大鼠晶狀體中的表達
劉志濤,張 輝*,邊立娟,謝明明,房學迅
(1.吉林大學第二醫院 眼科醫院,吉林 長春130041;2.吉林大學分子酶學教育部 重點實驗室)
晶狀體是人體內蛋白質含量最高的組織,晶狀體蛋白是晶狀體上皮細胞的主要成分,約占晶狀體中水溶性蛋白的90%,依據其在電場中的遷移能力,分為α、β、γ-晶狀體蛋白。其中,α-晶狀體蛋白(α-crystallin)是最主要的結構蛋白,它由αA 和αB兩個亞單位構成[1],兩種亞單位在結構上與小熱休克蛋白(small heat shock proteins,sHSPs)呈高度同源性,具有分子伴侶(molecular chaperone)的效應,主要表現為抑制蛋白質的聚集以及酶的失活[2],有利于維持晶狀體的透明。
αB-晶狀體蛋白(αB-crystallin)廣泛表達于多種組織細胞中,以晶狀體和橫紋肌(心肌和骨骼肌)表達量最高[3]。在晶狀體中,αB-晶狀體蛋白與αA-晶狀體蛋白以1:3的方式組成四聚體,發揮其生物學作用。αB-晶狀體蛋白的基本功能是識別并結合有聚集傾向的非天然蛋白質或蛋白質折疊過程中的中間產物,穩定靶蛋白分子的構象,防止形成不可逆的蛋白質聚集產物[4]。因此,αB-晶狀體蛋白對細胞內蛋白質的數量和質量的穩定以及細胞內環境的穩定有著十分重要的作用,近年來發現αB-晶狀體蛋白參與多種細胞生理和應激過程,表現出某種抗組織細胞損傷的保護功能[4]。
在以往的試驗中,我們通過免疫組織化學法證實,αB-晶狀體蛋白在先天性白內障大鼠晶狀體中的免疫活性,與相同周齡正常對照組相比較,隨周齡的增長明顯降低[5]。本實驗通過SDS-PAGE凝膠電泳及Western blot方法檢測αB-晶狀體蛋白在不同周齡正常大鼠晶狀體中的含量變化(以灰度值表示),探討αB-晶狀體蛋白在年齡相關性白內障的形成過程中的作用。
1 材料與方法
1.1 實驗動物
3、6、9、12周齡健康清潔級 Wistar大鼠各10只(吉林大學實驗動物中心提供),雌雄兼有,體重分別為(60±5)、(180±5)、(300±5)、(380±5)g,裂隙燈下觀察晶狀體均透明。
1.2 主要試劑
αB-晶狀體蛋白單克隆第一抗體(美國SΑNTΑ CRUZ生物制品公司);β-肌動蛋白單克隆第一抗體(北京博奧森生物試劑公司);羊抗兔第二抗體(鼎國生物技術有限公司);標準牛血清蛋白(BSA)(寶泰克生物技術有限公司);蛋白酶抑制劑復合物(華特生生物技術有限公司);BCA蛋白濃度測定試劑盒(上海碧云天生物技術有限公司);預染蛋白Marker(北京博邁德生物技術有限公司);硝酸纖維(PVDF)膜(英國Αmersham公司);ECL顯色液(北京金式生物技術有限公司)。阿爾梅醫用X射線膠片(天津國源醫療器械有限公司)。實驗中的其他試劑如:樣品緩沖液、SDS-PΑGE配制液、PMSF、上樣Buffer、Tris-HCL、電泳液、電濕轉液、TBS、TBST等緩沖液,均由吉林大學酶工程實驗室提供、配制。
1.3 主要儀器
101-2B型干燥箱(天津泰斯特儀器有限司);垂直板電泳槽 (北京六一儀器廠);穩壓穩流電泳儀(北京六一儀器廠);玻璃勻漿器(長春市源金醫療器械公司);78-1型磁力攪拌器(上海南江電訊器材廠);濕性轉移電泳儀(大連競邁生物科技有限公司);1700型紫外分光光度計(日本島津公司);工XUS800數碼相機 (日本佳能公司);CR-21G高速冷凍離心機(日本日立公司);SHZ-工I工型循環水真空泵(上海亞榮生化儀器廠);工T-1型裂隙燈(日本TOPCON公司)。
1.4 實驗方法
1.4.1 晶狀體蛋白的提取 頸椎脫臼法處死大鼠,用顯微剪于角膜緣處剪開角膜,摘出完整晶狀體,觀察晶狀體是否完全透明并凍存。取各周齡透明大鼠晶狀體各10枚,冰上切碎,移入勻漿器,并加入樣品緩沖液3ml(蛋白酶抑制劑、50mM Tris-HCl pH值8.0、1mMβ-琉基乙醇、2mM EDTΑ、100mM PMSF混合物),然后將其置于冰盒中勻漿約5 min,再將混合液移至EP管中(上述操作均在4℃的層析室中進行)。將混合液離心,12 000rp,20 min,4℃。棄沉淀,取上清,EP管中分裝,于-80℃冰箱保存備用。
1.4.2 總蛋白濃度測定 根據標準品和樣品數量,按50體積BCΑ試劑Α加1體積BCΑ試劑B(50∶1)配制適量BCΑ工作液,充分混勻。取10微升標準品用PBS稀釋至100微升,使終濃度為0.5mg·ml-1。將標準品按0,1,2,4,8,12,16,20微升加到96孔板的蛋白標準品孔中,加PBS補足到20微升。加適當體積樣品到96孔板的樣品孔中,補加PBS到20微升。各孔加入200微升BCΑ工作液,37℃放置30分鐘。冷卻到室溫,用酶標儀測定各樣品孔在550nm處的吸光度,根據標準曲線計算出蛋白濃度。根據所測樣品總蛋白濃度,將上述各組樣品總蛋白濃度調至0.3mg·ml-1水平后備用,在-80℃冰箱保存。
1.4.3 SDS-PΑGE(聚丙烯酰胺)凝膠電泳 配制15%的分離膠,5%的濃縮膠,薄膠厚度為1.5mm;取上述己調平濃度的四組樣品各20μl,分別加5×SDS上樣Buffer 5μl,100℃的水浴煮5min,之后離心1min,12 000rp,未見沉淀;加預染蛋白Mαrker 5μl到上樣孔內,再將各組樣品15μl依次加到上樣孔;采用穩流40mΑ,通電90分鐘后,前沿條帶跑至分離膠底沿時,預染蛋白Mαrker出現6條清晰彩色條帶,終止電泳。
1.4.4 αB-晶狀體蛋白蛋白印記及反應顯色 將樣品分離膠切成合適大小,再剪裁同樣大小的PVDF膜和濾紙。PVDF膜先在甲醇溶液中浸泡5min,再在濕轉液中浸泡5min。按“正極”—海綿—濾紙—PVDF膜—膠塊—濾紙—海綿— “負極”的順序放好,加入適量電轉液,采用穩流80mA,轉膜2小時。預染蛋白Mαrker的清晰條帶印在PVDF膜上。先用TBS緩沖液洗膜,再用麗春紅染色后PVDF膜上出現蛋白清晰條帶,后用TBS緩沖液洗膜至無色。4℃的環境下,5%BSΑ封閉過夜。用TBS緩沖液洗膜3次,每次10min,然后加兔抗大鼠αB-晶狀體蛋白單克隆第一抗體(1∶2 000稀釋),4℃,搖床4小時。用TBS緩沖液洗膜3次,每次10min,加羊抗兔第二抗體(1∶4 000稀釋),室溫搖床搖1小時。用TBS緩沖液洗膜3次,每次10 min,于暗室內行ECL顯色液顯色。照相,封存。
1.4.5 β-肌動蛋白印記及反應顯色 一抗采用β-肌動蛋白單克隆第一抗體(1∶1000稀釋),4℃,搖床4小時。余實驗步驟同2.4。
1.4.6 將上述曝光照片用Bandscan掃瞄分析軟件進行分析。
2 結果
各周齡大鼠晶狀體樣品中αB-晶狀體蛋白條帶的顯色情況、經Bandscan掃描的總灰度值,及各周齡條帶灰度值與3周齡條帶灰度值比較結果一致表明:不同周齡正常 Wistar大鼠晶狀體中水溶性的αB-晶狀體蛋白的含量隨著周齡的增加呈明顯下降趨勢(圖-1、2,表-1)。
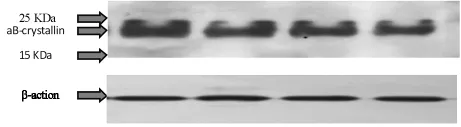
圖1 晶狀體中αB-晶狀體蛋白的檢測結果
通過圖1,我們可以發現,3、6、9、12周齡正常大鼠晶狀體中的αB-晶狀體蛋白條帶,位于15KDa和25KDa預染蛋白標記帶之間,其分子量大約為23.5KDa。β-肌動蛋白(β-Actin蛋白)在細胞的表達水平通常不會隨著年齡的增長發生改變,因此被廣泛用于Western時上樣量是否一致的參照,本實驗各周齡對應的β-肌動蛋白顯色程度均一無差別,進一步證明各個樣品上樣總蛋白含量相同。
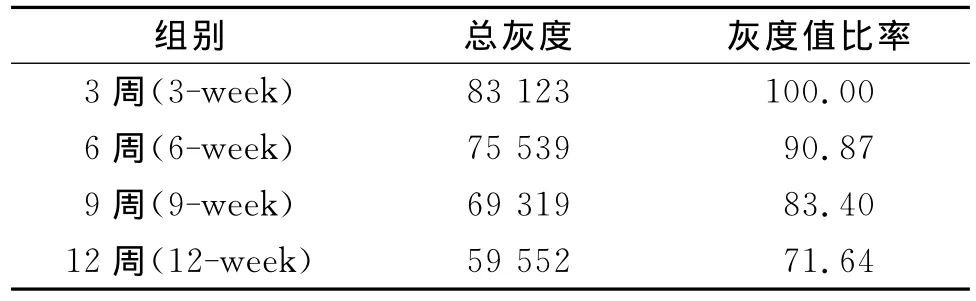
表1 Bandscan掃描的總灰度值分析結果
通過表1,我們可知3、6、9、12周齡正常大鼠晶狀體中的αB-晶狀體蛋白條帶經Bandscan掃描的總灰度值分別為:83 123,75 539,69 319,59 552。αB-晶狀體蛋白的含量隨著周齡的增加呈明顯下降趨勢。

圖2 各周齡條帶灰度值與3周齡條帶灰度值比較結果
通過圖2,我們可以發現,各周齡正常大鼠晶狀體中αB-晶狀體蛋白條總灰度值與3周齡對比顯示,6、9、12周齡的蛋白含量水平分別降至3周齡含量水平的90.87%、83.40%、71.64%,呈明顯下降趨勢。
3 討論
αB-晶狀體蛋白的基因(CRYAB)定位于染色體11q12-q23,編碼由 175 個氨基酸組成蛋白質[4]。αB-晶狀體蛋白的結構可分為三個部分:(1)從第60位到第151位共92個氨基酸是小分子熱休克蛋白(sHSP)家族特征性的保守核心結構域,是其識別和結合非天然蛋白質底物,發揮分子伴侶功能的關鍵部位。(2)在核心區域的氨基端由59個氨基酸組成N末端區,主要包含有Ser19/45/59三個磷酸化位點和Met1乙酰化位點,該部分對αB-晶狀體蛋白的分子構象、聚合物大小及分子伴侶的功能有一定的調節作用。(3)αB-晶狀體蛋白核心區域的羧基端由24個氨基酸組成,稱為C末端尾部。
αB-晶狀體蛋白作為晶狀體蛋白的重要組成部分,其特有的分子伴侶活性對各種致病因素造成的晶狀體蛋白的非特異性凝聚具有抑制作用,其活性的減弱或喪失與白內障的發病密切相關[6-8]。Carver等[9]發現隨年齡增長,伴隨著α-晶狀體蛋白量的減少,高相對分子量的蛋白數量增加,而高相對分子量蛋白主要由高度聚合狀態的α-晶狀體蛋白組成,α-晶狀體蛋白的四級空間結構發生變化,導致分子伴侶活性下降和水溶性的降低。也有研究認為α-晶狀體蛋白在聚合成高分子量蛋白的過程中,β片層構象增加,導致α-晶狀體蛋白部分去折疊,使疏水作用強于α-晶狀體蛋白,進而水溶性的降低及分子伴侶活性下降。1993年Kelly等[10]發現在大鼠白內障晶狀體中內切肽酶Calpain II導致αB-晶狀體蛋白的分子活性伴侶減弱。1997年Inomata等[8]觀察到在白內障大鼠晶狀體中αB-晶狀體蛋白被Calpain分解成多肽片段,且部分降解產物為不可溶性。
在以往的試驗中,我們通過探討多種內切肽酶和外切肽酶在先天性白內障大鼠、正常大鼠及年齡相關性白內障患者晶狀體中的含量及免疫活性的變化,推測在白內障的形成過程中,晶狀體在受到各種致病因素的作用下,晶狀體內的Ca2+濃度升高使得某些蛋白溶解酶活性增強,αB-晶狀體蛋白被降解,其水溶性及生物活性下降。
本實驗研究結果表明,不同周齡正常Wistar大鼠晶狀體中可溶性αB-晶狀體蛋白的含量隨著周齡的增加呈明顯下降趨勢。提示在晶狀體的發育過程中,αB-晶狀體蛋白被某些活化性的蛋白水解酶降解,從而使α-晶狀體蛋白喪失其水溶性,由可溶性蛋白變為不可溶性蛋白,而其分子伴侶活性的降低引起,導致其保護其他蛋白(β-和γ-晶狀體蛋白)避免變性的作用下降[9]。晶狀體內若沒有足夠的水溶性蛋白,其透明性及屈光作用的降低,導致白內障的形成及視力障礙。
白內障的病因學研究是一個相當復雜的課題,在白內障的形成過程中存在復雜的病理及生化現象。近年來,隨著分子生物學、生物化學及基因工程的迅猛發展,白內障的發病機制研究取得重大進步。就其白內障的預防工作而言,應盡可能早的采取積極措施,避免各種致病因素,保護晶狀體蛋白少受變性影響,延緩或阻止晶狀體蛋白的降解、聚集,這將是預防白內障的有效手段。
[1]Bloemendal H,Jong W de,Jaenicke R,et al.Slingsby,A.Tardieu,Ageing and vision:structure,stability and function of lens crystallins[J].Prog Biophys Mol Biol,2004,86:407.
[2]Derham BK,Harding JJ.Effects of modifications ofα2crystallin on its chaperone and other p roperties[J].Biochem J,2002;364(Pt3):712.
[3]Delaye M,Tardieu A.short-range order of crystalline proteins accounts for eye len transparency[J].Nature,1983,302(5907):415.
[4]劉 雙,肖獻忠.aB-晶體蛋白的功能與疾病[J].生命的化學,2005,25(2):89.
[5]張 輝,趙梅生,于維芹,田 蕊.αB-晶狀體蛋白在先天性白內障大鼠晶狀體中免疫活性的變化[J].眼科新進展,2006,26(12):893.
[6]Muchowski PJ.Bassuk JA.Lubsen NH,et al.Human Alpha B-crystallin,small heat shock protein and molecular chaperonne[J].Biol Chem,1997,272(4):2578.
[7]Shumiya S.Estabablishment of the hereditary cataract strain(SCR)and genetic analysis[J].Lab Anim Sci,1995,45(6):671.
[8]Inomata M,Nomura K,Takehana M,et al.Evidence for the involvement of calpain in cataract ogenesis in Shumiy acataract rat(SCR )[J].Biochim Biophys Acta,1997,1362(1):11.
[9]Carver JA,Aquilina JA,Cooper PG,et al.Alpha-crystallin:molecular chaperone and protein surfactant[J].Boechim Biophys Acta,1994,1204(2):195.
[10]Kelley MJ,David LL;Iwasaki N.alpha-Crystallin chaperone activity is reduced by calpainⅡin vitro and in selenite cataract[J].Biol Chem,1993,268:18844.

