小麥秸稈同步糖化發酵制取燃料乙醇*
張偉,李文,趙繼東,林燕,彭兆城,王欣澤
1(上海交通大學環境科學與工程學院,上海,200240)2(長安大學環境科學與工程學院,陜西 西安,710064)3(大理州環境保護局,云南大理,671000)
生物質燃料,作為一種能夠替代傳統化石燃料的新興能源,越來越受到世界各國的重視[1]。其中,燃料乙醇作為一種環境友好型的生物質燃料,具有燃燒值較高,燃燒后的產物主要為水和二氧化碳,無其他有害氣體,所以更受青睞。相對于美國和巴西以玉米和甘蔗為主要原料的燃料乙醇生產方式反而可能導致的CO2排放量增加問題[2](達到生物質燃料溫室氣體總削減量的17~420倍[3]),利用農業廢棄物,如秸稈類木質纖維素原料來生產生物質燃料,能快速、持續降低溫室氣體的排放,溫室氣體排放量減少達86%[4],且能避免與人爭糧的問題,具有廣闊的應用前景。
利用秸稈類木質纖維素來生產燃料乙醇主要包括以下3個步驟:預處理、纖維素酶水解、乙醇發酵[5]。同步糖化發酵(SSF)是將纖維素酶水解過程和乙醇發酵過程整合在一個反應器中同時進行,具有乙醇產率較高,反應速率較快,可降低產物(糖)對纖維素酶活性的抑制作用,且由于反應在同一反應器中進行,具有前期投資成本及運行費用較低等優點。盡管如此,此技術目前尚存在一些難題,如通常釀酒酵母的最佳溫度為30~35℃,而纖維素酶水解的最佳溫度為45~50℃[6],反應過程中秸稈的固體含量較低,難以提高等問題[7]。
目前提高秸稈SSF過程中乙醇發酵效率主要是利用耐高溫酵母或通過溫度變化,采用非等溫發酵等來實現。Pessani等人以經過熱水預處理的柳枝為原料,初始固體含量為8.0%(m/V),利用篩選出的耐熱Kluyveromyces maxianus IMB3,在45℃同步糖化發酵168 h后,乙醇濃度達最大值,為22.5g/L[8]。Kang等人以經過氨纖維爆破的大麥秸稈為原料,初始固體含量為16%(m/V),利用耐熱Kluyveromyces maxianus CHY1612,通過變化發酵溫度:45℃發酵24 h,35℃發酵48 h,最終乙醇濃度可達34.3 g/L,較45℃發酵 72 h 提高了 12.1 g/L[5]。
以上研究考慮了溫度對同步糖化發酵的影響,利用酵母對高溫的耐受性,從而提高乙醇濃度和產率。然而,秸稈同步糖化發酵產乙醇的過程非常復雜,影響因素也較多,僅從溫度方面進行研究和考察,效果還很有限。本文以小麥秸稈為原料,在已實現耐高溫發酵性能的發酵系統中,系統研究并考察了溫度、固體含量、纖維素酶投加量、酵母菌濃度,對最終SSF系統乙醇濃度及產率的影響,達到了纖維素酶水解和酵母發酵溫度的協調,使得同步糖化發酵過程在高溫、高固體含量的條件下仍能保持較高的乙醇產率,提高了原料的利用效率,縮短了反應所需的時間,同時也可降低后續乙醇蒸餾的成本。
1 材料與方法
1.1 材料與酶制劑
小麥秸稈:取自太湖周邊農村,經1.0%NaOH預處理、105℃烘干、粉碎、過80目篩,待用。
預處理后的小麥秸稈中纖維素、半纖維素和木質素含量如表1所示。

表1 NaOH預處理小麥秸稈成分
纖維素酶:ATCC26921,購自Sigma公司,酶活性為82.22 FPU/mL。
1.2 菌種和培養基
釀酒酵母:S.cerevisiae BY4742,本實驗室馴化后得到的耐高溫高產菌株。
液體培養基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,121℃滅菌30 min。
1.3 酵母菌復活及擴培方法
1.3.1 酵母菌復蘇
取保存于-80℃的釀酒酵母S.cerevisiae BY4742,于37℃恒溫180 r/min振蕩培養14~18 h,然后將培養后菌體混合液在4 000 r/min條件下離心5 min,棄上清液,加200 mL無菌水,混勻,離心,直至上清液澄清。
1.3.2 酵母菌擴培
在離心過后的菌體中加入50 mL無菌水,混勻,分別取0.5 mL接種于8個裝有250 mL培養基的錐形瓶中,于37℃搖床恒溫180 r/min振蕩培養14~16 h。擴培的酵母菌在4 000 r/min條件下離心5 min,棄上清液,加200 mL無菌水,混勻,離心,直至上清液澄清。
1.4 秸稈同步糖化發酵操作
小麥秸稈同步糖化發酵過程中的影響因子及其水平設計如表2所示。所有同步糖化發酵實驗均做3個平行樣,每個樣品總有效體積為10 mL,并通過檸檬酸-檸檬酸鈉緩沖液控制pH為4.0,總發酵時間為120 h,每24 h取樣,4 000 r/min離心10 min,取上清液,樣品經0.45 μm濾膜過濾后于2 mL棕色樣品瓶中4℃保存。
1.5 分析方法
1.5.1 成分分析方法
預處理小麥秸稈中纖維素、半纖維素、木質素含量的測定根據NREL標準方法[9]進行。
1.5.2 濾紙纖維素酶活測定
Sigma纖維素酶的濾紙纖維素酶活的測定根據IUPAC標準方法[10]。濾紙纖維素酶活力的單位為FPU/mL,1FPU定義為1min內,纖維素酶水解Whatman No.1濾紙所產生的葡萄糖量[11]。
1.5.3 還原糖和乙醇的測定
葡萄糖、木糖、乙醇濃度通過高效液相色譜(Shimadzu 10-AD,Kyoto,Japan)進行定量分析,檢測器為示差折光檢測器(RID-10A,Shimadzu,Kyoto,Japan)。色譜柱使用 Aminex HPX-87P column(Bio-Rad,USA),并帶有保護柱。柱溫為65℃,檢測器溫度為40℃,流動相為超純水,流速為0.8 mL/min,注射體積為 20 μL。
1.5.4 計算公式
纖維素水解產生葡萄糖的化學方程式如公式(1)所示,理論上,100 g纖維素可產生111.1 g葡萄糖。葡萄糖發酵產乙醇的化學方程式如公式(2)所示。理論上,100 g葡萄糖產生51.1 g乙醇和48.9 g CO2。則100 g纖維素理論上產生56.8 g乙醇。預處理小麥秸稈中纖維素含量為58.84%,則100 g預處理小麥秸稈理論上最多能產生33.4 g乙醇。
本研究中定義乙醇產率(Y)為同步糖化發酵過程中,每克預處理小麥秸稈產生的乙醇量與理論產量的比值,如公式(3)所示。

2 結果與分析
2.1 溫度對秸稈同步糖化發酵的影響
溫度是同步糖化發酵最為重要的一個影響因素,纖維素酶和酵母菌最佳反應溫度之間的差異也是影響同步糖化發酵應用最為重要的一個方面。圖1為溫度對同步糖化發酵過程中乙醇濃度和產率的影響,其中,溫度設置為 35,37,38,40,42℃五個水平,所有樣品均取自NaOH預處理小麥同步糖化發酵120 h后的發酵液。從圖1可以看出,在35~38℃,隨著溫度的上升,乙醇濃度、產率逐步增加,但趨勢逐漸減緩。38℃時乙醇產率達到最大值,為61.08%。溫度的升高增強了纖維素酶活性,促進了酶解反應的進行;同時,酶解產生的葡萄糖能為酵母菌迅速利用,一方面減輕了葡萄糖對纖維素酶活性的反饋抑制,促進了酶解反應的進一步進行[12];另一方面,在釀酒酵母的耐受溫度范圍內,溫度的提高能增強細胞中酶活性及維持細胞膜的高滲透性,有利于營養物的進入和乙醇、CO2的排出[13],從而提高了乙醇的濃度和產率。但隨著溫度的進一步升高,酵母菌的活性受到較大程度的抑制[14],超過耐受溫度時,細胞生長速率下降,導致細胞蛋白、RNA、DNA及游離氨基酸都減少,同時,高溫也會使細胞膜流動性下降,溶質和必需的營養物質難以進入細胞膜,使酵母呼吸活性明顯下降,乙醇產率反而出現下降。Laluce等人利用基因改造S.cerevisiae 63M,優化同步糖化發酵實驗,固定原料濃度為100 g/L,發酵溫度為30~40℃,乙醇產率呈現先增高后減少的趨勢[15]。在本研究中,秸稈同步糖化發酵的最佳溫度為38℃,可實現61.08%的發酵效率。
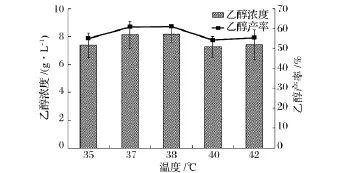
圖1 溫度對同步糖化發酵過程中乙醇濃度和乙醇產率的影響
2.2 固體含量對秸稈同步糖化發酵的影響
利用秸稈類木質纖維素原料同步糖化發酵生產乙醇,為了降低后續乙醇蒸餾回收成本,應盡可能提高發酵液中乙醇濃度,即應盡可能提高同步發酵過程中底物的固體含量[16]。圖2為不同秸稈固體含量下同步糖化發酵120h后發酵液中乙醇濃度和產率。研究發現,固體含量的增加有助于提高乙醇濃度,固體含量為16%(w/v)時乙醇濃度達最大值,為29.06g/L,產率為54.38%。固體含量繼續增加到20%(w/v)時,發酵液中乙醇濃度停止增加,并出現了下降。乙醇產率隨著固體含量的增加而呈現逐漸下降的趨勢。固體含量的提高增加了混勻難度,不利于纖維素酶與秸稈的充分接觸;同時低水分的環境也不利于酵母菌的生長和代謝,從而降低了乙醇產率。
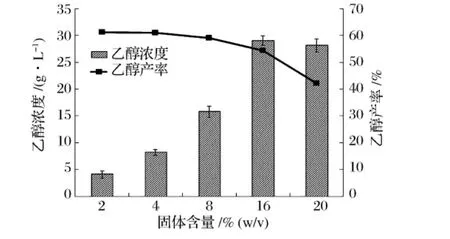
圖2 固體含量對同步糖化發酵過程中乙醇濃度和產率的影響
有報道稱,一個經濟的同步糖化發酵工藝需要秸稈固體含量大于 15%(m/V)[17]。Tomás-Pejó等人研究了固體含量對同步糖化發酵過程中乙醇濃度的影響,初始固體含量設置為10%(m/V),同步糖化發酵12 h后,添加4%(m/V)底物,最終乙醇濃度達最大值,為 36.2 g/L[18]。
本研究中,秸稈固體含量為16%(m/V)時,最終乙醇濃度比固體含量為2%(m/V)時提高了24.97 g/L,且乙醇產率只下降了6.85%,因此,選取秸稈固體含量16%(m/V)為本研究中最佳的固體含量。
2.3 纖維素酶投加量對秸稈同步糖化發酵的影響
同步糖化發酵過程中,固體含量一定時,纖維素酶投加量越高,越有利于底物的轉化,但是纖維素酶投加量的增大無疑將增大生產的成本[19]。因此,有必要研究纖維素酶投加量對秸稈同步發酵的影響,結果如圖3所示。隨著纖維素酶投加量的增加,乙醇濃度和產率均得到了提高。乙醇濃度和產率在纖維素酶投加量為35 FPU/g底物時基本達到最大值,為32.44 g/L和60.70%。
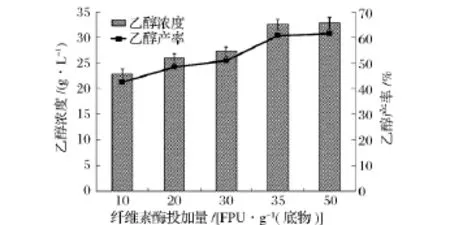
圖3 纖維素酶投加量對同步糖化發酵過程中乙醇濃度和產率的影響
Zhao等人利用重組S.cerevisiae ZU-10以經過堿預處理過的玉米秸稈為底物,初始濃度為80 g/L,纖維素酶投加量為20 FPU/g底物,在33℃下進行同步糖化發酵實驗,經過72 h后,乙醇濃度達到27.8 g/L[20]。本研究中,纖維素酶投加量為35 FPU/g秸稈時,秸稈中纖維素的有效部位已經被纖維素酶充分吸附,纖維素酶只有吸附于纖維素,水解反應才能進行。纖維素酶投加量為50 FPU/g秸稈時,多余的纖維素酶游離于混合體系中,無助于提高秸稈的水解效率,乙醇濃度和產率基本不變,只比35 FPU/g底物時增加了0.35 g/L和0.66%,故選取35 FPU/g底物作為最佳的纖維素酶投加量。
2.4 酵母菌濃度對秸稈同步糖化發酵的影響
酵母菌濃度對秸稈同步糖化發酵過程中乙醇濃度和產率的影響如圖4所示。結果表明,酵母菌濃度的增加總體上有利于乙醇濃度和產率的提高,這是由于隨著初始酵母菌濃度的增加,有利于將纖維素酶水解產生的葡萄糖快速發酵轉化成乙醇,減少了由于葡萄糖的積累對纖維素酶的毒害作用,促進了反應的進行。
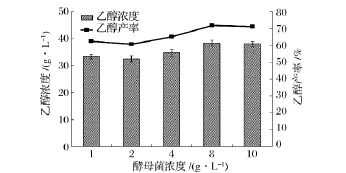
圖4 酵母菌濃度對同步糖化發酵過程中乙醇濃度和產率的影響
本研究中,當酵母菌濃度為8 g/L時,乙醇濃度和產率達到最大值,為38.32 g/L和71.71%。當初始酵母菌濃度增加到10 g/L時,由于生物量太大,而酶解產生的葡萄糖有限,不能維持酵母菌正常的生成和代謝,乙醇濃度和產率均開始下降。適宜的酵母菌濃度能縮短同步發酵周期,提高乙醇產率。本研究中選取8 g/L為酵母菌濃度。
2.5 時間對秸稈同步糖化發酵的影響
圖5為時間對同步糖化發酵過程的影響。可以看出,NaOH預處理過的小麥秸稈同步糖化發酵24 h后,發酵液中的乙醇濃度即可達到30.02 g/L,產率為56.18%。木糖濃度在24 h后基本已達最大值,為13.34 g/L。延長同步糖化發酵時間,乙醇濃度逐漸增加,但變化趨勢相對緩慢,120h時乙醇濃度達38.32 g/L,產率達 71.71%,較 24h時提高了15.53%,此時木糖濃度為12.94 g/L。0~24 h乙醇平均生產率達1.25 g/(L·h),0~120 h乙醇平均生產率則下降為0.32 g/(L·h)。
時間的延長有利于乙醇濃度和產率的增加,但平均發酵速率卻逐漸減小。這是由于0~24 h由于纖維素酶對秸稈中纖維素的快速吸附水解,產生的葡萄糖為酵母菌快速發酵產生乙醇,使得乙醇濃度較快增加。之后,一方面由于隨著可供水解底物的減少,產生的乙醇對纖維素酶活性的抑制以及纖維素酶的脫附等因素,水解速率減緩,同時,隨著發酵液中乙醇濃度的增加,乙醇對酵母菌毒性增大,細胞形態發生變化,細胞結構變得松散,細胞呼吸、生長受到抑制,甚至不再增長,發酵能力削弱;另一方面,由于酵母菌自身的增殖,需消耗較多營養維持自身正常生長,從而降低了乙醇平均產率。
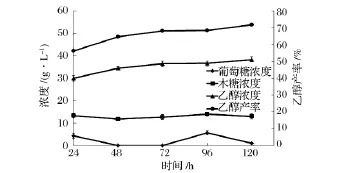
圖5 最優同步糖化發酵條件下葡萄糖、木糖、乙醇濃度、產率隨時間的變化
本實驗中,考慮到120 h時乙醇濃度、產率和對原料的利用效率均較高,故選取120 h為小麥秸稈同步糖化發酵時間。
3 結論
利用S.cerevisiae BY4742同步糖化發酵NaOH預處理小麥秸稈制取燃料乙醇,通過考察溫度、固體含量、纖維素酶投加量以及酵母菌濃度對其發酵性能的影響,得出同步糖化發酵最優條件為:發酵溫度38℃,固體含量16%(m/V),纖維素酶投加量35 FPU/g底物,酵母菌濃度8 g/L。在此條件下,經過120 h同步糖化發酵后,乙醇濃度達到最大值,為38.32 g/L,產率達理論產率的71.71%,乙醇平均生產率為0.32 g/(L·h),此時木糖濃度為12.94 g/L。
通過此項研究,使得纖維素酶最佳水解溫度和酵母菌發酵溫度得到了很好的耦合,且使發酵過程中底物固體含量得到了較大程度的提高,達16%(m/V),大大提高了乙醇濃度和原料的利用效率,還可降低后續蒸餾的成本,促進了利用農業廢棄物秸稈制取燃料乙醇的工業化進程。
[1]張桂英,張成明,姜立,等.木薯酒精蒸餾廢液循環回用工藝的探討[J].食品與發酵工業,2012,38(4):34-38.
[2]Searchinger T,Heimlich R,Houghton R A,et al.Use of US croplands for biofuelsincreasesgreenhouse gases through emissions from land-use change [J].Science,2008,319(5867):1 238-1 240.
[3]Fargione J,Hill J,Tilman D,et al.Land clearing and the biofuel carbon debt[J].Science,2008,319(5 867):1 235-1 238.
[4]Wang M,Wu M,Huo H.Life-cycle energy and greenhouse gas emission impacts of different corn ethanol plant types[J].Environmental Research Letters,2007,2(2):024001.
[5]Kang H W,Kim Y,Kim S W,et al.Cellulosic ethanol production on temperature-shift simultaneous saccharification and fermentation using the thermostable yeast Kluyveromyces marxianus CHY1612 [J].Bioprocess and Biosystems Engineering,2012,35(1/2):1-8.
[6]Park I,Kim I,Kang K,et al.Cellulose ethanol production from waste newsprint by simultaneous saccharification and fermentation using Saccharomycescerevisiae KNU5377[J].Process Biochemistry,2010,45(4):487-492.
[7]Tomás-Pejó E,Oliva J M,González A,et al.Bioethanol production from wheat straw by the thermotolerant yeast Kluyveromyces marxianus CECT 10875 in a simultaneous saccharification and fermentation fed-batch process [J].Fuel,2009,88(11):2 142-2 147.
[8]Pessani N K,Atiyeh H K,Wilkins M R,et al.Simultaneous saccharification and fermentation of Kanlow switchgrass by thermotolerant Kluyveromyces marxianus IMB3:The effect of enzyme loading,temperature and higher solid loadings[J].Bioresource Technology,2011,102(22):10 618-10 624.
[9]Sluiter A,Hames B,Ruiz R,et al.Determination of structural carbohydrates and lignin in biomass[R].USA:NREL Laboratory Analytical Procedure,2008:1-14.
[10]Ghose T.Measurement of cellulase activities[J].Pure &Applied Chemistry,1987,59(2):257-268.
[11]Jeya M,Zhang Y-W,Kim I-W,et al.Enhanced saccharification of alkali-treated rice straw by cellulase from Trametes hirsuta and statistical optimization of hydrolysis conditions by RSM[J].Bioresource Technology,2009,100(21):5 155-5 161.
[12]Cuevas M,Sánchez S,Bravo V,et al.Determination of optimal pre-treatment conditions for ethanol production from olive-pruning debris by simultaneous saccharification and fermentation[J].Fuel,2010,89(10):2 891-2 896.
[13]岳昌海,朱許慧,侯文貴,等.甘薯渣酒精發酵條件優化[J].化學工業與工程,2011,28(002):49-54.
[14]Chu D,Zhang J,Bao J.Simultaneous Saccharification and Ethanol Fermentation of corn stover at high temperature and high solids loading by a thermotolerant strain Saccharomyces cerevisiae DQ1[J].Bio Energy Research,2012,5(4):1 020-1 026.
[15]Laluce C,Tognolli J O,Oliveira K F,et al.Optimization of temperature,sugar concentration,and inoculum size to maximize ethanol production without significant decrease in yeast cell viability[J].Applied Microbiology and Biotechnology,2009,83(4):627-637.
[16]Zhang J,Chu D,Huang J,et al.Simultaneous saccharification and ethanol fermentation at high corn stover solids loading in a helical stirring bioreactor[J].Biotechnology and Bioengineering,2010,105(4):718-728.
[17]Tania I,Georgieva X H,Troels Hilstr?m,et al.Enzymatic hydrolysis and ethanol fermentation of high dry matter wet-exploded wheat straw at low enzyme loading [J].Biotechnology for Fuels and Chemicals,2008,148(1-3):35-44.
[18]E Tomás-Pejó J M O,A González,I Ballesteros,et al.Bioethanol production from wheat straw by the thermotolerant yeast Kluyveromyces marxianus CECT 10875 in a simultaneous saccharification and fermentation fed-batch process[J].Fuel,2009,88(11):2 142-2 147.
[19]Liu Q,Cheng K-k,Zhang J-a,et al.Statistical optimization of recycled-paper enzymatic hydrolysis for simultaneous saccharification and fermentation via central composite design [J].Applied Biochemistry and Biotechnology,2009,160(2):604-612.
[20]Zhao J,Xia L.Simultaneous saccharification and fermentation of alkaline-pretreated corn stover to ethanol using a recombinant yeast strain [J].Fuel Processing Technology,2009,90(10):1 193-1 197.

