糖基化青蒿素衍生物的合成
任彥榮
(重慶第二師范學院 生物與化學工程系,重慶 400067)
青蒿素(Ⅰ)及其衍生物雖然在臨床上應用多年,但仍存在油溶性和水溶性不佳、對熱不穩定、易受濕、熱和還原性物質的影響而分解、臨床復發率高等缺點,使其應用受到限制[1~4]。糖類物質具有優良的性質,具有毒性小、結構新穎多樣、靶向性好等特點。一些不溶于水的物質與糖結合轉變成糖苷后,水溶解性增高,毒性降低。
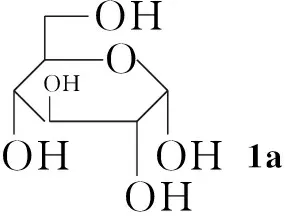
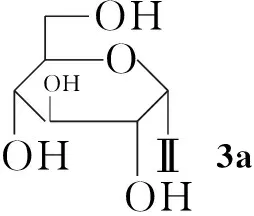
本文通過化學方法將糖基引入Ⅰ分子中對其進行修飾,以期利用糖基的優良特性提高Ⅰ的水溶性,并降低毒性。以糖[D-葡萄糖(1a), D-木糖(1b), D-甘露糖(1c), 乳糖(1d)和D-半乳糖(1e)]為原料,經溴化、乙酰化一鍋法使糖基乙酰化制得相應的溴代乙酰化糖(2a~2e); 2分別與二氫青蒿素(Ⅱ-H, Scheme 1)在相轉移催化劑四丁基硫酸氫銨催化下經醚化反應合成了五個糖基化青蒿素衍生物(3a~3e, Scheme 2),其結構進行1H NMR,13C NMR, IR和LC-MS 表征。
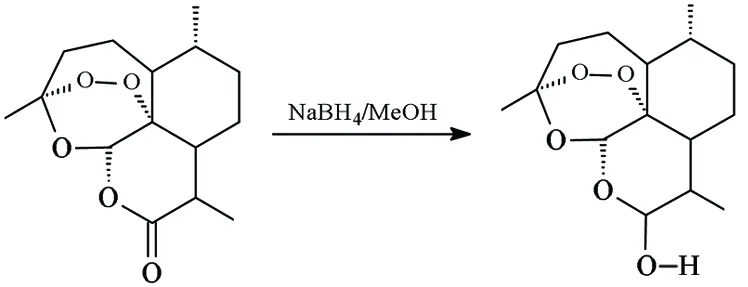
Ⅰ Ⅱ-H

Scheme2
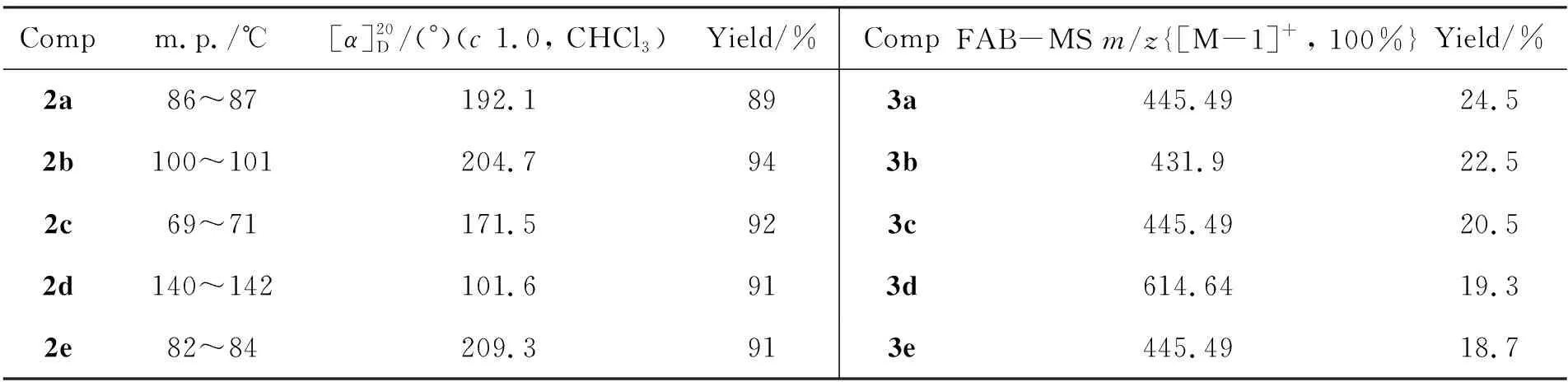
表1 合成2和3的實驗結果Table 1 Experimental results of synthesizing 2 and 3
1 實驗部分
1.1 儀器與試劑
Varian INOVA-400型核磁共振儀(CDCl3為溶劑,TMS為內標);Varon型傅立葉紅外光譜儀(KBr壓片);Finnigan-MAT 4510型質譜儀(EI)。
所用試劑均為分析純,成都福瑞斯特科技發展有限公司。
1.2 合成
(1) Ⅱ-H的合成
在反應瓶中加入Ⅰ.2.81 g(10 mmol), NaBH40.454 g(12 mmol)及無水甲醇10 mL,攪拌下于室溫反應24 h[TLC跟蹤,展開劑:A=V(石油醚) ∶V(丙酮)=1 ∶1]。過濾,濾液減壓蒸餾回收甲醇,殘余物用250 mL水溶解,乙酸乙酯(3×50 mL)萃取,合并有機層,用少量水洗滌;合并水層與水洗液,再用乙酸乙酯萃取;合并有機層[5],蒸去溶劑,干燥得白色固體(±)-Ⅱ-H; IRν: 3 315, 2 935, 2 924, 1 134, 1 037, 1 047 cm-1。
(2) 2a~2e的合成通法[6]
在反應瓶中加入1a~1e2.00 g,醋酸酐懸浮液10 mL及碘90 mg,攪拌下于室溫反應至反應液呈棕色透明(全乙酰化完成,5 min~30 min)。用二氯甲烷(50 mL)稀釋,冰浴冷卻下加入38%HBr/AcOH 14 mL,于室溫反應至終點(TLC跟蹤,展開劑A)。用二氯甲烷(150 mL)稀釋后依次用冰水(2×60 mL),飽和碳酸氫鈉溶液(2×50 mL)及0.4 mol·L-1硫代硫酸鈉溶液(2×50 mL)洗滌;分液,有機層用無水硫酸鈉干燥,減壓濃縮得白色固體;經乙醚溶解后,用石油醚重結晶得白色針狀晶體2a~2e(α-構型)。實驗結果見表1,表征數據與文獻[6]值一致。
(3) 3a~3e的合成通法
在反應瓶中加入二氯甲烷20 mL, 水15 mL及四丁基硫酸氫銨1.13 g,攪拌下于45 ℃(浴溫)反應30 min;于1 h內同時滴加Ⅱ-H 180 g(4 mmol)的2.5%KOH(40 mL)溶液和2 4.8 mmol的二氯甲烷(20 mL)溶液。控制pH 9~10,繼續反應16 h。用1 mol·L-1硫酸中和至中性,加入乙酸乙酯40 mL,減壓抽濾,濾液分液,水相用乙酸乙酯(3×10 mL)萃取,合并有機相,用飽和氯化鈉溶液(3×30 mL)洗滌,無水硫酸鈉干燥12 h;抽濾,濾液減壓濃縮得棕紅色膏狀物。將其溶于0.1 mol·L-1MeONa/MeOH(300 mL)中,于40 ℃反應24 h;過濾,濾餅用水50 mL溶解,蒸餾濃縮得固體,經柱色譜[洗脫劑:V(石油醚) ∶V(丙酮)=1 ∶1]純化得白色固體3a~3e。實驗結果和FAB-MS數據見表1。
3a:1H NMRδ: 5.43(s, 1H, CH), 4.90(d,J=6.2 Hz, 1H, CH), 4.76(d,J=3.2 Hz, 1H, CH), 3.32~3.58(m, 6H, CH, CH2,糖環-H), 1.28(s, 3H, CH3), 0.92(d,J=6.1 Hz, 3H, CH3), 0.83(d,J=6.0 Hz, 3H, CH3);13C NMRδ: 8.6, 13.9, 17.4, 18.2, 19.3, 23.7, 27.4, 27.7, 29.3, 30.5, 30.7, 62.5, 67.8, 69.0, 71.1, 72.1, 84.0, 92.4, 92.5, 95.1, 98.6; IRν: 3 379, 2 946, 2 924, 1 134, 1 027, 1 092 cm-1。
3b:1H NMRδ: 5.43(s, 1H, CH), 4.69(d,J=6.5 Hz, 1H, CH), 4.83(d,J=3.1 Hz, 1H, CH), 3.32~3.48(m, 5H, CH, CH2,糖環-H), 1.28(s, 3H, CH3), 0.91(d,J=6.2 Hz, 3H, CH3), 0.84(d,J=6.1 Hz, 3H, CH3);13C NMRδ: 8.6, 13.9, 18.5,21.8, 22.7, 23.6, 24.3, 25.0, 27.4, 27.5, 36.1, 65.3, 68.7, 71.2, 71.8, 86.8, 92.3, 92.4, 93.3, 94.7; IRν: 3 379, 2 946, 2 924, 1 134, 1 027, 1 041 cm-1。
3c:1H NMRδ: 5.44(s, 1H, CH), 5.01(d,J=1.5 Hz, 1H, CH), 4.72(d,J=3.7 Hz, 1H, CH), 3.24~3.68(m, 6H, CH, CH2,糖環-H), 1.28(s, 3H, CH3), 0.90(d,J=6.3 Hz, 3H, CH3), 0.83(d,J=7.2 Hz, 3H, CH3);13C NMRδ: 8.8, 14.5, 17.3, 18.7, 19.5, 24.0, 27.2, 29.9, 30.8, 30.5, 30.7, 62.5, 68.1, 69.0, 72.1, 84.3, 92.4, 92.8, 96.1, 98.6; IRν: 3 379, 2 946, 2 924, 1 092, 1 026, 1 014 cm-1。
3d:1H NMRδ: 5.44(s, 1H, CH), 5.09(d,J=3.6 Hz, 1H, CH), 4.66(d,J=8.8 Hz, 1H, CH), 4.52(d,J=5.6 Hz, 1H, CH), 3.32~3.63(m, 12H, CH, CH2,糖環-H), 1.27(s, 3H, CH3), 0.90(d,J=6.6 Hz, 3H, CH3), 0.83(d,J=6.3 Hz, 3H, CH3);13C NMRδ: 8.8, 14.5, 18.6, 21.8, 22.7, 23.6, 24.0, 25.0, 27.2, 28.2, 36.8, 62.5, 62.8, 65.0, 67.1, 67.5, 68.1, 69.0, 71.1, 72.1, 72.4, 76.5, 84.3, 92.4, 92.8, 96.1, 98.6; IRν: 3 379, 2 946, 2 924, 1 134, 1 027, 1 061 cm-1。
3e:1H NMRδ: 5.44(s, 1H, CH), 4.98(d,J=6.7 Hz, 1H, CH), 4.91(d,J=3.4 Hz, 1H, CH), 3.49~3.78(m, 6H, CH, CH2,糖環-H), 1.28(s, 3H, CH3), 0.90(d,J=6.5 Hz, 3H, CH3), 0.83(d,J=6.2 Hz, 3H, CH3);13C NMRδ: 8.5, 14.5, 16.6, 18.7, 19.5, 24.8, 27.2, 30.1, 30.8, 30.5, 31.7, 62.5, 68.1, 69.0, 73.1, 72.1, 84.3, 92.4, 92.8, 96.1, 97.9; IRν: 3 380, 2 946, 2 935, 1 135, 1 027, 1 014 cm-1。
2 結果與討論
2.1 表征
以3a的1H NMR分析為例,δ為5.43, 4.76, 1.28, 0.92和0.83的吸收峰為Ⅱ-H的特征吸收峰;4.90為與Ⅱ-H連接的1a分子端基C1上的H,其J值為6.2 Hz,提示1a端基碳為β-構型。在13C NMR譜中,除溶劑峰外,共有21個信號。青蒿素葡萄糖苷(3a)共有21個C原子,其中Ⅰ母體15個C原子,1a有6個C原子,可確定3a為青蒿素葡萄糖苷。
3c在5.01處的吸收峰為與Ⅱ-H連接的1c分子端基C1上的H,由于其J值非常小,無法以此判斷苷鍵構型,但與3a的糖端基C1上的H相比,化學位移明顯向低場移動,推測受鄰位羥基的影響,因此1c端基碳亦為β-構型。同理分析1d和1e均為β-構型。
表征結果表明,以α-D-溴代乙酰吡喃糖為糖基給體,采用堿和相轉移催化法將Ⅱ引入到糖的C1位差向異構中心合成糖苷時,由于保護基乙酰基的鄰位效應使糖的異頭碳發生Walden翻轉。糖基化反應主要按SN2親核取代歷程進行,因此生成的糖苷中異頭碳為β-構型。
2.2 合成及可能的反應機理
由于糖類含有多個羥基,反應活性位點多,通過化學合成方法利用糖定位修飾青蒿素,必須從糖基的保護開始,這也是本合成過程的關鍵和難點所在。
首先要選擇合適的糖基保護方法。最為有效的糖基保護方法主要有乙酰基保護法和異丙叉縮酮保護法。我們比較這兩種方法對1a的保護效應,結果發現1a與丙酮在濃硫酸催化劑作用下可得到異丙叉縮酮,但反應條件苛刻,要求在無水環境下進行,目標產物需經柱色譜純化,操作不便,且目標產物為糖漿狀油狀物,造成后續反應操作不便。因此本文采用乙酰基保護法,并通過IR譜初步檢測發現,保護基團可基本水解掉,不需要額外的脫保護步驟,操作簡便。
在糖基保護之后,將糖引入到Ⅱ-H分子中是合成的另一關鍵步驟。2與Ⅱ-H反應是在堿催化下的水-有機兩相反應,其中最為重要是相轉移催化劑的選擇。本文以2a為例,考察了不同的相轉移催化劑[十二烷基三甲基氯化銨(A),十二烷基三甲基溴化銨(B),十二烷基芐基二甲基氯化銨(C),四丁基氯化銨(D),四丁基硫酸氫銨(E)和三乙基芐基氯化銨(F)]對合成3a的影響。結果發現,不同的相轉移催化劑對合成3a有較大差異,其中以A, B和C為相轉移催化劑時,無3a生成;而以D, E和F為相轉移催化劑時,有3a生成,其中以E,即四丁基硫酸氫銨為相轉移催化劑時,3a生成量最多,為最理想的相轉移催化劑。
[1] Lai C S, Nair N K, Mansor S M,etal. An analytical method with a single extraction procedure and two separate high performance liquid chromatographic systems for the determination of artesunate,dihydroartemisinin and mefloquine in human plasma for application in clinical pharmacological studies of the drug combination[J].Journal of Chromatography B,2007,857(2):308-314.
[2] Zhang D. Determination of artemisinin,artemisinin B and artemisinic acid in herba srtemisiae snnuae by HPLC-UV-ELSD[J].藥學學報,2006,42(9):978-981.
[3] Wu H, Moeller K D. Anodic coupling reactions:A sequential cyclization route to the artemisinin ring skeleton[J].Org Lett,2007,9(22):4599-4602.
[4] Efferth T, Volm M. Glutathione-related enzymes contribute to resistance of tumor cells and low toxicity in normal organs to artesunate[J].In Vivo,2005,19(1):225-232.
[5] Liang J, L i Y. Synthesis of the arylether derivatives of artemisinin[J].Chin J Med Chem,1996,6:22-25.
[6] 李玉文,李英霞,張偉,等. 一鍋法制備全乙酰吡喃溴代糖[J].有機化學,2004,20(4):438-439.

