新型含苯并噻唑基雙酰胺衍生物的合成及其抗菌活性
薛 偉, 熊 壯, 鄭玉國(guó),2, 何 勇, 魏 學(xué), 祁慧雪, 盧 平
(1. 貴州大學(xué) 精細(xì)化工研究開(kāi)發(fā)中心 教育部綠色農(nóng)藥與農(nóng)業(yè)生物工程重點(diǎn)實(shí)驗(yàn)室,貴州 貴陽(yáng) 550025;2. 興義民族師范學(xué)院 化學(xué)生物系,貴州 興義 562400)
近年來(lái),為了發(fā)現(xiàn)新的具有更高生物活性的化合物,進(jìn)而創(chuàng)制高效、廣譜、低毒、對(duì)環(huán)境友好的綠色新農(nóng)藥,人們將研究重點(diǎn)放在雜環(huán)化合物方面。雜環(huán)化合物在植物體內(nèi)具有良好的內(nèi)吸傳導(dǎo)性能以及結(jié)構(gòu)多樣易于修飾,已經(jīng)成為當(dāng)今新農(nóng)藥研究的重要對(duì)象。在繁多的雜環(huán)化合物中,苯并噻唑類雜環(huán)化合物因具有廣譜的生物活性,在農(nóng)藥和醫(yī)藥研究領(lǐng)域中受到廣泛關(guān)注。自從1962年Merck公司成功開(kāi)發(fā)噻菌靈以來(lái),已成功開(kāi)發(fā)了很多噻唑類農(nóng)藥品種,如噻蟲(chóng)胺、噻蟲(chóng)嗪等[1~9]。本課題組對(duì)噻唑基進(jìn)行結(jié)構(gòu)修飾,引入雜環(huán)后合成了系列具有高活性的化合物[10]。
自日本農(nóng)藥公司[11]、拜耳公司[12]和杜邦公司[13]分別發(fā)現(xiàn)了作用于魚(yú)尼丁受體的雙酰胺類殺蟲(chóng)劑后,雙酰胺類化合物已成為農(nóng)用化學(xué)品工業(yè)中合成的焦點(diǎn)。研究發(fā)現(xiàn),雙酰胺類衍生物具有廣泛的生物活性,如消炎、抗菌、抗腫瘤、除草、殺蟲(chóng)和抗病毒等[14~17],引起了人們的廣泛研究興趣[18~23]。
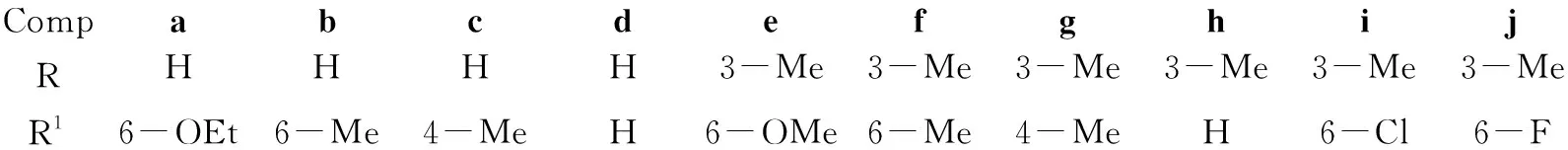
CompabcdefghijRHHHH3-Me3-Me3-Me3-Me3-Me3-MeR16-OEt6-Me4-MeH6-OMe6-Me4-MeH6-Cl6-F
Scheme1
為了尋找具有新型高效、低毒性、易生物降解和環(huán)境相容性好的先導(dǎo)化合物,本文采用活性因子疊加原理,將苯并噻唑基引入雙酰胺結(jié)構(gòu)中,設(shè)計(jì)并合成了10個(gè)未見(jiàn)文獻(xiàn)報(bào)道的含苯并噻唑基雙酰胺類衍生物(4a~4j, Scheme 1),其結(jié)構(gòu)經(jīng)1H NMR,13C NMR, IR及元素分析表征。并初步測(cè)試了4a~4j對(duì)黃瓜花葉病毒(CMV)的抑制作用。
1 實(shí)驗(yàn)部分
1.1 儀器與試劑
X-5型熔點(diǎn)儀(溫度計(jì)未校正);JEOL-ECX 500 NMR型核磁共振儀(DMSO-d6為溶劑,TMS為標(biāo));Prestige-21型紅外光譜儀(KBr壓片);Elementar Vario-Ⅲ型元素分析儀。
所用試劑均為分析純。
1.2 合成
(1) 2-(2-甲基苯甲酰胺)取代苯甲酸(2a,2e)的合成
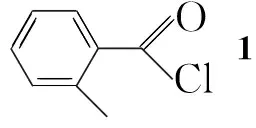
在單口圓底燒瓶中加入鄰甲基苯甲酸408 mg(3 mmol)和二氯亞砜6 mL,攪拌下回流反應(yīng)12 h。減壓蒸除過(guò)量的二氯亞砜得2-甲基苯甲酰氯(1)。
在三口圓底燒瓶中加入鄰氨基苯甲酸(Ⅰa)3 mmol和二氯甲烷40 mL,攪拌下滴加縛酸劑三乙胺2 mL。冰浴冷卻下緩慢滴加1 的二氯甲烷(15 mL)溶液,滴畢,于室溫反應(yīng)至終點(diǎn)(TCL檢測(cè))。加入飽和氯化鈉溶液40 mL,分液,水層用乙酸乙酯(2×40 mL)萃取,合并有機(jī)層,依次用稀鹽酸、飽和碳酸氫鈉溶液、飽和氯化鈉溶液洗滌,無(wú)水Na2SO4干燥。減壓脫溶得2-(2-甲基苯甲酰胺)苯甲酸(2a)粗品(直接用于下一步反應(yīng))。
用類似的方法合成2e。
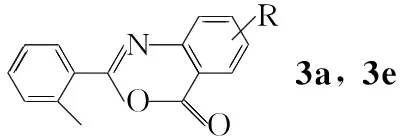
(2) 2-(2-甲基苯基)-4(3H)-3,1-取代苯并噁嗪酮(3a,3e)的合成
在裝有分餾器(200 mm)和蒸餾裝置(裝無(wú)水氯化鈣干燥管)的反應(yīng)瓶中加入2a25.5 g(100 mmol)和醋酐100 mL,攪拌下回流(餾出液速度1滴/10 s)反應(yīng)至終點(diǎn)(TCL檢測(cè))。冷卻至室溫,抽濾,濾餅干燥得白色晶體2-(2-甲基苯基)-4(3H)-3,1-苯并噁嗪酮(3a)。
用類似的方法合成3e。
(3)4a~4j的合成(以4a為例)
在反應(yīng)瓶中加入3a1.41 g(5 mmol),乙腈40 mL和碳酸鉀0.7 g(5 mmol),攪拌下回流反應(yīng)5 min。慢慢加入6- 乙基苯并噻唑胺(Ⅱa) 5 mmol的乙腈(15 mL)溶液,回流反應(yīng)至終點(diǎn)(TCL檢測(cè))。傾入冷水中,靜置析晶,抽濾,濾餅經(jīng)兩次硅膠柱層析[洗脫劑:V(石油醚) ∶V(乙酸乙酯)=2 ∶1]純化得4a。用類似的方法合成4b~4j。
1.3 抗CMV活性實(shí)驗(yàn)
以長(zhǎng)勢(shì)一致的莧色藜做枯斑寄主,用毛筆將病毒人工摩擦接種于撒有金剛砂的適齡葉片上,0.5 h后用清水將葉片清洗干凈,光照培養(yǎng)1.5 h。準(zhǔn)確稱取適量4于稱量瓶中,加入30 μL~50 μL DMF使其充分溶解,用含1%Tween 20的二次蒸餾水稀釋成500 mg·L-1溶液。另取125 μL 2%寧南霉素水劑,加入30 μL DMF,用含1% Tween 20的二次蒸餾水5 mL稀釋成500 mg·L-1的寧南霉素溶液做對(duì)照,將兩者分別涂施葉片的左右半葉。以溶媒為對(duì)照,每藥劑處理3株,每株6片葉,將其在(28±1) ℃, 10 000 Lux光照培養(yǎng)箱中保濕培養(yǎng)6 d~7 d,記錄產(chǎn)生枯斑的數(shù)目,按下公式計(jì)算枯斑相對(duì)抑制率(X/%)。
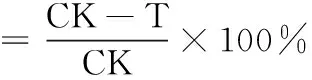
式中: CK為對(duì)照組(右半葉)枯斑數(shù)(個(gè));T為化合物處理組(左半葉)枯斑數(shù)(個(gè))
2 結(jié)果與討論
2.1 實(shí)驗(yàn)結(jié)果與表征
4的實(shí)驗(yàn)結(jié)果和元素分析數(shù)據(jù)見(jiàn)表1,表征數(shù)據(jù)見(jiàn)表2和表3。以4a為例,其IR分析表明,兩組酰胺鍵由于所處的化學(xué)環(huán)境不同,受外部基團(tuán)的影響也不同,因此N-H和C=O峰都出現(xiàn)兩組伸縮振動(dòng)峰(表3)。由于酰胺基氮原子的孤對(duì)電子垂直于芳環(huán)的兀軌道,使得氮原子不能與芳環(huán)有效共軛,進(jìn)而酰胺氮原子可能會(huì)與羰基形成有效的共軛,降低羰基中C=O的能量,引起羰基吸收波數(shù)降低(1 681 cm-1)。與噻唑環(huán)相鄰的酰胺鍵中的C=O受噻唑環(huán)及氨基的共同影響,伸縮振動(dòng)波數(shù)也較低(1 647 cm-1)。與噻唑環(huán)相鄰的N-H(3 263 cm-1)受噻唑共軛吸電子效應(yīng)的影響,伸縮振動(dòng)波數(shù)較低,而另一個(gè)N-H(3 165 cm-1)伸縮振動(dòng)波數(shù)則相對(duì)較高。其它化合物的IR譜圖也體現(xiàn)了類似規(guī)律。
1H NMR分析表明,對(duì)苯環(huán)來(lái)講,在7.03~8.07均出現(xiàn)苯環(huán)質(zhì)子的多重峰。當(dāng)兩個(gè)苯環(huán)分別受到多個(gè)不同取代基的影響時(shí),其質(zhì)子裂分比較復(fù)雜,并且化學(xué)位移有一定程度的重疊。12.78和10.87處的峰為NH的質(zhì)子峰。
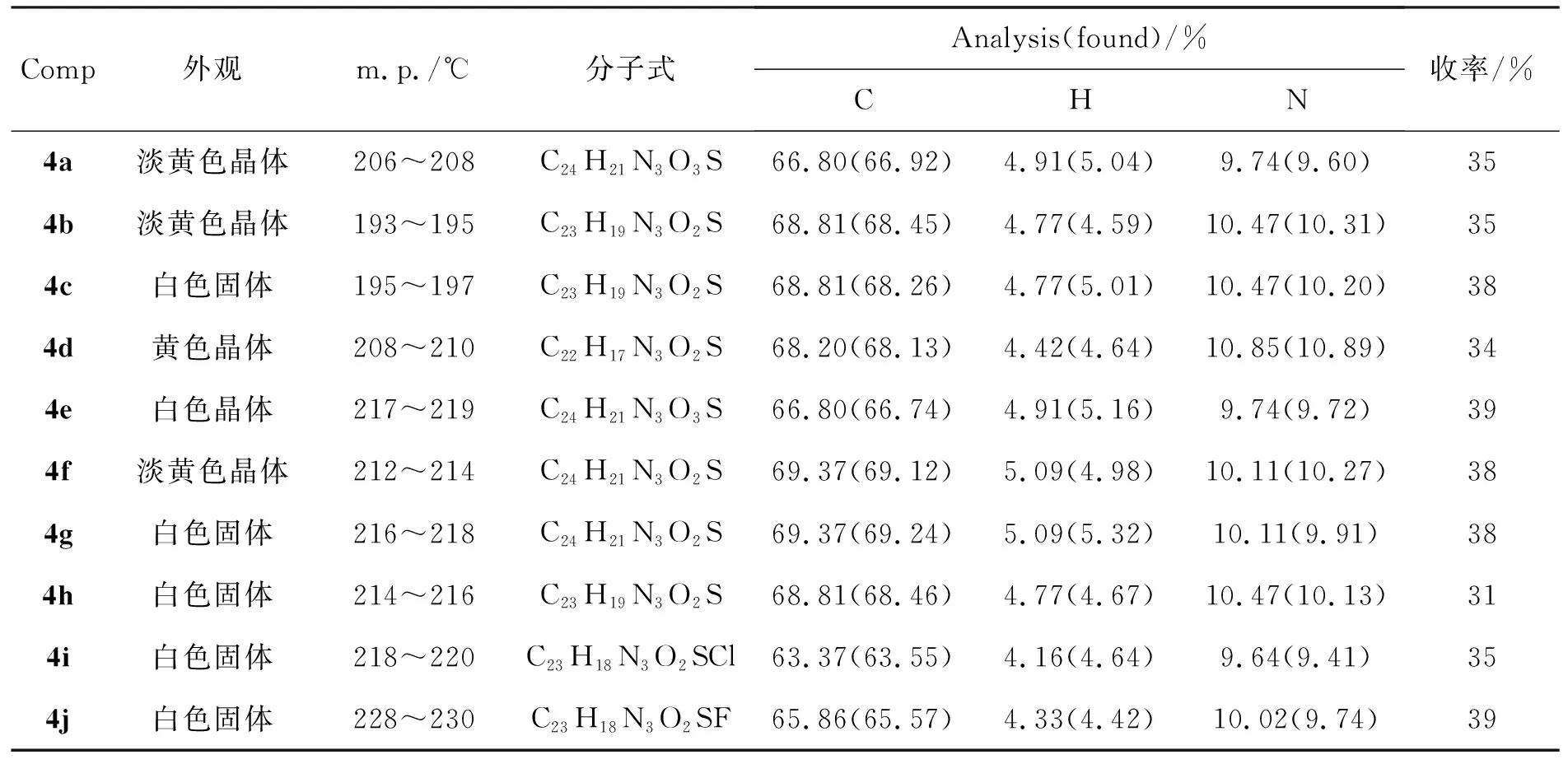
表 1 4的實(shí)驗(yàn)結(jié)果和元素分析數(shù)據(jù)Table 1 Experimental results and elemental analysis data of 4

表 2 4的1H NMR和13C NMR數(shù)據(jù)Table 2 1H NMR and 13C NMR data of 4
續(xù)表2

Comp1H NMR δ(J/Hz)13C NMR δ4b12.89(s, 1H, NH), 10.94(s, 1H, NH), 8.11(s, 1H, ArH), 7.95(s, 1H, ArH), 7.75(s, 1H, ArH), 7.62(m, 3H, ArH), 7.41(t, J=17.8, 1H, ArH), 7.35^7.30(m, 3H, ArH), 7.26(d, J=8.0, 1H, ArH), 2.42(s, 3H, CH3), 2.41(s, 3H, CH3)168.0, 136.4, 133.6, 133.0, 131.4, 130.6, 128.1, 127.7, 126.4, 124.4, 121.9, 31.2, 21.5, 20.04c12.91(s, 1H, NH), 10.73(s, 1H, NH), 8.00(s, 1H, ArH), 7.92(s, 1H, ArH), 7.79(d, J=7.5, 1H, ArH), 7.62(q, 2H, ArH), 7.40(t, J=17.8, 1H, ArH), 7.32(q, 3H, ArH), 7.27(d, J=6.9, 1H, ArH), 7.22^7.21(m, 1H, ArH), 2.61(s, 3H, CH3), 2.42(s, 3H, CH3)168.0, 137.0, 136.4, 133.0, 131.4, 130.6, 127.7, 126.3, 124.1, 119.6, 20.0, 18.64d12.97(s, 1H, NH), 10.95(s, 1H, NH), 8.08(s, 1H, ArH), 7.98(t, J=6.3, 2H, ArH), 7.76(d, J=8.1, 1H, ArH), 7.65^7.61(q, 2H, ArH), 7.46(t, J=17.8, 1H, ArH), 7.41(t, J=17.8, 1H, ArH), 7.34^7.30(m, 4H, ArH), 2.43(s, 3H, CH3)168.0, 162.8, 137.0, 136.4, 133.0, 131.4, 130.6, 127.7, 126.3, 124.2, 122.4, 20.04e12.60(s, 1H, NH), 9.94(s, 1H, NH), 7.66(d, J=8.6, 1H, ArH), 7.60(s, 1H, ArH), 7.54^7.50(m, 3H, ArH), 7.34(t, J=17.8, 2H, ArH), 7.25(q, J=7.5, 2H, ArH), 7.04(d, J=9.2, 1H, ArH), 3.82(s, 3H, OCH3), 2.37(s, 3H, CH3), 2.34(s, 3H, CH3)168.5, 167.1, 156.9, 156.6, 137.4, 136.3, 136.0, 133.5, 131.0, 130.0, 127.7, 126.9, 126.7, 126.0, 115.4, 105.2, 56.1, 19.8, 18.64f12.65(s, 1H, NH), 10.02(s, 1H, NH), 7.78(s, 1H, ArH), 7.65^7.50(m, 4H, ArH), 7.35^7.25(m, 5H, ArH), 2.42(s, 3H, CH3), 2.36(s, 3H, CH3), 2.34(s, 3H, CH3)168.5, 167.4, 158.4, 147.1, 130.0, 130.0, 127.9, 127.8, 127.0, 126.0, 121.8, 21.5, 19.84g12.74(s, 1H, NH), 9.96(s, 1H, NH), 7.79(s, 1H, ArH), 7.65(d, J=8.0, 1H, ArH), 7.54^7.50(m, 3H, ArH), 7.34^7.32(m, 2H, ArH), 7.28^7.23(m, 3H, ArH), 2.42(s, 3H, CH3), 2.37(s, 3H, CH3), 2.33(s, 3H, CH3)168.5, 167.2, 158.1, 147.2, 136.1, 130.9, 130.0, 127.7, 126.0, 121.8, 21.6, 19.8, 18.64h12.74(s, 1H, NH), 9.96(s, 1H, NH), 8.01(d, J=8.0, 1H, ArH), 7.77(d, J=8.0, 1H, ArH), 7.50^7.48(m, 3H, ArH), 7.45(t, J=17.8, 1H, ArH), 7.30^7.29(m, 3H, ArH), 7.28^7.23(m, 2H, ArH), 2.37(s, 3H, CH3), 2.34(s, 3H, CH3)168.5, 167.4, 159.0, 149.2, 130.9, 130.0, 127.8, 126.7, 126.0, 124.0, 122.2, 19.8, 18.64i12.85(s, 1H, NH), 9.97(s, 1H, NH), 8.16(s, 1H, ArH), 7.76(d, J=8.6, 1H, ArH), 7.50^7.44(m, 4H, ArH), 7.30^7.28(m, 2H, ArH), 7.20^7.18(m, 2H, ArH), 2.37(s, 3H, CH3), 2.34(s, 3H, CH3)168.5, 167.6, 160.0, 137.3, 136.0, 133.7, 130.9, 127.8, 127.0, 126.6, 122.2, 19.8, 18.64j12.78(s, 1H, NH), 9.97(s, 1H, NH), 7.93^7.87(m, 1H, ArH), 7.77^7.76(m, 1H, ArH), 7.53^7.52(m, 3H, ArH), 7.35^7.25(m, 5H, ArH), 2.37(s, 3H, CH3), 2.34(s, 3H, CH3)168.5, 167.5, 160.1, 159.0, 158.2, 145.9, 137.3, 136.1, 136.0, 134.6, 133.6, 130.9, 130.0, 127.7, 127.0, 126.6, 19.8, 18.6

表 3 4的IR數(shù)據(jù)Table 3 IR data of 4

表4 4對(duì)黃瓜花葉病毒的抑制活性Table 4 Antibacterial activities for CMV of 4
2.2 抗菌活性
4對(duì)CMV的抑制活性見(jiàn)表4。從表4可見(jiàn),4對(duì)CMV表現(xiàn)了一定抑制能力。當(dāng)R2為6-CH3時(shí),活性好于R2為H。這表明,R2取代基的電子效應(yīng)對(duì)化合物的活性有較大的影響,甲基等具有較強(qiáng)的推電子效應(yīng)的基團(tuán)對(duì)活性提高有利。其中4f和4h對(duì)CMV抑制率可達(dá)45.3%和47.3%,略低于對(duì)照藥劑寧南霉素對(duì)CMV的抑制率,有進(jìn)一步優(yōu)化的潛力。
3 結(jié)論
以鄰甲基苯甲酸和取代鄰氨基苯甲酸為起始原料,設(shè)計(jì)并合成了10個(gè)未見(jiàn)文獻(xiàn)報(bào)道的含苯并噻唑基雙酰胺類衍生物。初步的抗菌活性測(cè)試結(jié)果表明,在500 mg·L-1濃度下,4f和4h對(duì)黃瓜花葉病毒有一定抑制作用。
[1] Huang W, Zhao P L, Liu C L,etal. Design,synthesis,and fungicidal activities of new strobilusrin derivatives[J].J Agric Food Chem,2007,55(8):3004-3010.
[2] Koci J, Klimesova V, Waisser K,etal. Heterocyclic benzazole derivatives with antimycobacterial in vitro activity[J].Bioorg Med Chem Lett,2002,12(22):3275-3278.
[3] Kashiyama E, Huchinson I, Chua M S,etal. Synthesis,metabolic formation,and biological properties of theC- andN-oxidation products of antitumor 2-(4-aminophenyl)benzothiazoles[J].J Med Chem,1999,42(20):4172-4184.
[4] Hutchinson I, Chua M S, Browne H L,etal. Synthesis and in vitro biological properties of fluorinated 2-(4-aminophenyl)benzothiazoles[J].J Med Chem,2001,44(9):1446-1455.
[5] Bradshaw T D, Westwell A D. The development of the antitumor benzothiazole prodrug,phortress,as a clinical candidate[J].Curr Med Chem,2004,11(13):1009-1021.
[6] Fitzjohn S, Robinson M P. Bezoxazole and benzothiazole derivatives[P].WO 9 406 783,1994.
[7] Naka I P, Matsuno H, Inami S,etal. Preparation of epalrestat[P].JP 08 291 155,1997.
[8] Rathod A, Beread B N, Doshi A G. Synthesis of schiff base from 2-amino-4-phenylthiazole and substituted 2-minobenzo-thiazolamines and their antimicrobial activity[J].Orient J Chem,2000,16(3):549-552.
[9] Chen C P, Chen Y J. Liquid-phase synthesis of 2-substituted benzimidazoles,benzoxazoles and benzothiazoles[J].Tetrahedron Lett,2004,45:113-115.
[10] 宋寶安,洪艷平,金林紅,等.α-取代氨基氟代苯基膦酸酯衍生物的合成、晶體結(jié)構(gòu)與抗癌活性[J].有機(jī)化學(xué),2005,25(8):1001-1006.
[11] Tohnishi M, Nakao H, Kohno E,etal. Preparation of phthalic acid diamides as agricultural and horticultural insecticides[P].EP 9l9 542,1999.
[12] Konze J, Andersch W, Stabler D,etal. Synergistic insecticidal and acaricidal compositions[P].WO 2 004 034 786,2004.
[13] Lahm G P, Myers B J, Selby T P,etal. Preparation of insecticidal anthranilamides[P].WO 2 001 070 671,2001.
[14] Ralf N. Insecticide mode of action:Return of the ryanodine receptor[J].Pest Manag Sci,2006,62:690-692.
[15] Lahm G P, Selby T P, Freudenber J H,etal. Insecticidal anthranilic diamides:A new class of potent ryanodine receptor activators[J].Bioorg Med Chem Lett,2005,15(22):4898-4906.
[16] Kuhnt T D, Haug M, Jelich K,etal. Preparation of 4-trifluormethylbenzamides as pesticides for plant and material protection[P].DE4 428 380,1996.
[17] Theissen R J. Herbicidal1-{5-[2-chloro-4(trifluoromethy1)phenoxy]-2-nitrobenzoyl}-3-isopropyl-2,1,3-benzothiadiazin-4-one-2,2-dioxide[P].US 4 340 417,1982.
[18] Joycharat N, Greger H, Hofer O,etal. Flavaglines and triterpenoids from the leaves of aglaia forbesii[J].Phytochemistry,2008,69:206-211.
[19] 董衛(wèi)莉,徐俊英,劉幸海,等. 含1,2,3-噻二唑的鄰甲酰胺基苯甲酰胺類化合物的合成、晶體結(jié)構(gòu)與生物活性[J].高等學(xué)校化學(xué)學(xué)報(bào),2008,29(10):1990-1994.
[20] 李斌,楊輝斌. 1-取代吡啶基-吡唑酰胺類化合物及其應(yīng)用[P].CN 101 333 213,2008.
[21] David C A, Lahm G P, Smith B K,etal. Synthesis of insecticidal fluorinated anthranilic diamides[J].Bioorganic & Medicinal Chemistry,2008,16(6):3163-3170.
[22] Scott D A, Aquila B M, Bebernitz G A,etal. Pyridyl and thiazolyl bisamide CSF-1R inhibitors for the treatment of cancer[J].Bioorganic & Medicinal Chemistry Letters,2008,18(17):4794-4797.
[23] Kranz M, Wall M, Evans B,etal. Identification of PDE4B over 4D subtype-selective inhibitors revealing an unprecedented binding mode[J].Bioorganic & Medicinal Chemistry,2009,17(14):5336-5341.

