高碘酸鈉氧化法固定化脂肪酶的研究
劉 晶 王 雪 張佳寧 李 越 王校紅 于殿宇
(東北農業大學食品學院1,哈爾濱 150030)
(黑龍江省糧食科研所2,哈爾濱 150030)
高碘酸鈉氧化法固定化脂肪酶的研究
劉 晶1王 雪1張佳寧1李 越1王校紅2于殿宇1
(東北農業大學食品學院1,哈爾濱 150030)
(黑龍江省糧食科研所2,哈爾濱 150030)
研究了以醋酸纖維素/聚丙烯復合膜為載體的高碘酸鈉氧化法固定化脂肪酶的固定化條件,采用響應面分析法對固定化條件進一步優化,并對固定化酶膜的酶學性質進行了討論。結果表明,以固定化酶活力為指標,當高碘酸鈉濃度為0.15 mol/L,活化為60 min時,濃度為0.013 g/mL的酶液與pH 8.0的磷酸鹽緩沖溶液于戊二醛質量分數0.24%,溫度4℃下,進行交聯反應,反應3.1 h后,獲得的固定化酶活最高,為0.52 U/cm2。固定化酶膜的酶學性質為:固定化酶最適溫度35℃,最適pH為9.0。
高碘酸鈉 醋酸纖維素/聚丙烯復合膜 脂肪酶 固定化
脂肪酶是一種廣泛分布于動物、植物和微生物中的酶,能夠進行可逆的甘油酯鍵水解或合成。在一定的條件下,脂肪酶可以主要催化合成反應,即可以用來合成生物柴油。無論在小規模的實驗還是工業規模的酯合成中,作為催化劑,脂肪酶已經得到成功應用[1-4]。固定化酶技術,就是將酶結合在載體上,或將其限制在有限空間內的一類技術,酶仍能進行相應催化活性,并方便回收利用[5]。一般將酶的固定化技術分為酶與載體的結合和包埋兩大類。其中結合法包括物理吸附、離子吸附、共價鍵結合及交聯法等[6-9]。
固定化方法是否成功很大方面取決于選擇合適的載體。固定化載體的選擇主要考慮是否擁有固定化所需的最佳性能,如機械強度、穩定性、親水疏水性、孔隙度、反應性、再生性及經濟性等方面[10]。常用的載體主要有微晶纖維素、硅藻土、硅膠等。而以膜為載體,不僅結合了膜的分離功能,還結合了載體功能和分隔功能,具有其他載體不可比擬的優點[11]。醋酸纖維素/聚丙烯復合膜具有一定的吸附性、化學穩定性好、疏水性、機械性能優異等優點,根據復合膜的吸附特性固定化脂肪酶,提高了酶在反應體系中的活性和穩定性,調節和控制酶的活性與選擇性,從而有利于酶的回收和產品的生產。傳統的固定化方法都有自己的優缺點,因此不能絕對說哪種方法優于其他的方法,要針對固定化對象本身的特點和所要應用的環境來選擇最適合的方法[12]。
本試驗以醋酸纖維素/聚丙烯復合膜為載體,由于纖維素表面有大量的羥基,因此用高碘酸鈉氧化法來氧化活化載體膜,進而更好的固定化脂肪酶,再以交聯的固定化方式,采用響應面分析法確定了最佳的固定化條件。
1 材料與方法
1.1 試驗材料
脂肪酶:Sigma公司;聚丙烯,上海碩光電子科技有限公司;高碘酸鈉,氫硼化鈉:分析純,廣東東莞市大嶺山公司;磷酸二氫鉀,磷酸氫二鈉:天津市光復精細化工研究所;聚乙烯醇:國藥集團化學試劑有限公司;橄欖油:中國醫藥上海化學試劑;其余試劑均為分析純。
1.2 試驗儀器
磁力攪拌器85-2型:江蘇中大儀器廠;LG10-2.4A型高速離心機:北京市醫用離心機廠;電子天平:梅特勒-托利多儀器(上海)有限公司。
1.3 試驗方法
1.3.1 醋酸纖維素/聚丙烯復合膜的制備
將5 g醋酸纖維素溶于100 mL丙酮中,待溶解完全成均一的膜液后,取試驗前制備好的聚丙烯膜浸于溶有醋酸纖維素的丙酮溶液中,自然成膜,以去離子水沖洗醋酸纖維素/聚丙烯復合膜數次干燥備用[12]。
1.3.2 高碘酸鈉氧化法
取一張醋酸纖維素/聚丙烯復合膜懸浮于10 mL不同濃度的高碘酸鈉溶液中,室溫下置于搖床中搖動一定時間,取出立即用去離子水洗至中性,吸干水分,與酶的磷酸鹽緩沖溶液于28℃進行交聯反應。交聯反應后取出,懸浮于10 mL 1%氫硼化鈉溶液中于4℃反應30 min,然后用0.1 mol的HAI溶液、2 mol的KCl溶液和水分別洗滌3次,取出測定酶活[13-14]。
1.3.3 脂肪酶活力測定(橄欖油乳化法)
將一定量的聚乙烯醇溶液和橄欖油按照一定的體積比(3∶1)混合,再用超聲波乳化成乳狀液。取4 mL乳化液和5 mL一定pH的緩沖液加入一定量的酶,預熱5 min后,同時在另一三角瓶中加入乳化液作空白樣,反應15 min后,向兩瓶中加入15 mL 95%乙醇,終止反應,用0.05 mol/L的標準氫氧化鈉溶液滴定,計算可得脂肪酶的分解活力。測定固定化酶酶活時將已固定化酶的濾紙剪碎,平均分成兩份,其中一份做空白[15-16]。
水解橄欖油每min產生1 μmol游離的脂肪酸定義為一個酶活力(U)。
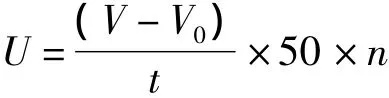
式中:V為樣品所消耗堿的體積/mL;V0為空白樣品所消耗堿的體積/mL;t為反應時間;n為稀釋倍數;50為1 mL 0.05 mol/L氫氧化鈉的微摩爾數。
固定化酶活定義為:每平方厘米固定化酶膜在37℃,pH 9.0的條件下,水解脂肪每分鐘產生1 μmol的脂肪酸所消耗的酶量,用U/cm2表示。
2 結果與分析
2.1 固定化條件對固定化酶活的影響
2.1.1 不同高碘酸鈉濃度及活化時間對固定化酶活的影響
分別選取不同高碘酸鈉濃度和不同活化時間對固定化酶活進行考察,結果如圖1所示。
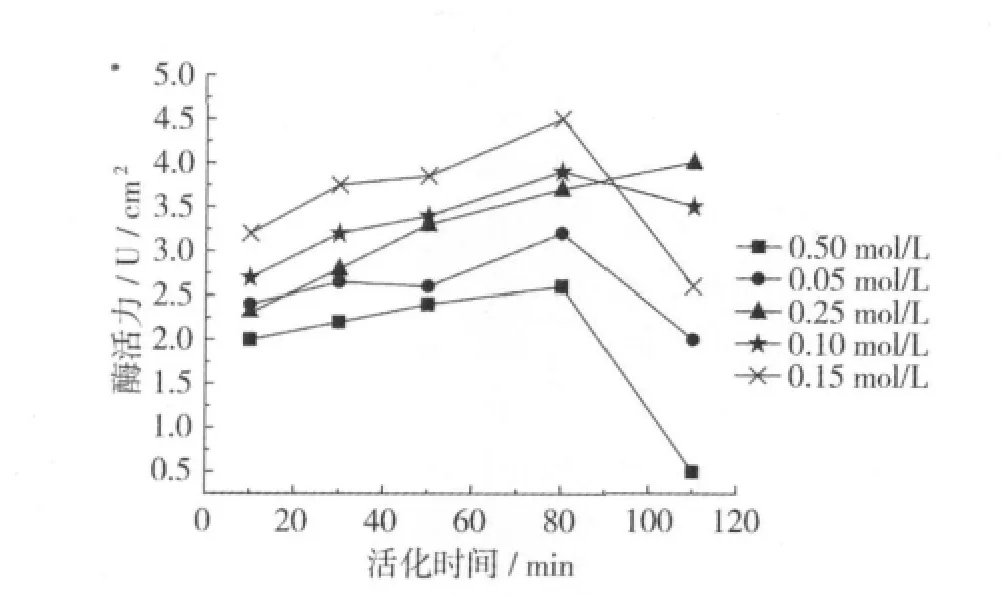
圖1 不同高碘酸鈉濃度下活化時間對固定化酶活的影響
由圖1可知,當NaIO4(高碘酸鈉)濃度為0.15 mol/L時,氧化時間為60 min時,所獲得的固定化酶的酶活最高,而隨著氧化的時間延長,固定化酶的活力減弱。氧化程度通常由膜表面上的羥基被氧化成醛基的量來表示。由于醋酸纖維素/聚丙烯復合膜表面有大量的羥基,易于高碘酸鈉氧化羥基成醛基,利于下一步的交聯反應。
2.1.2 交聯劑濃度對固定化酶活的影響
分別選取0.15% ~0.4%不同濃度的交聯劑(戊二醛)對固定化酶活進行考察,結果如圖2所示。
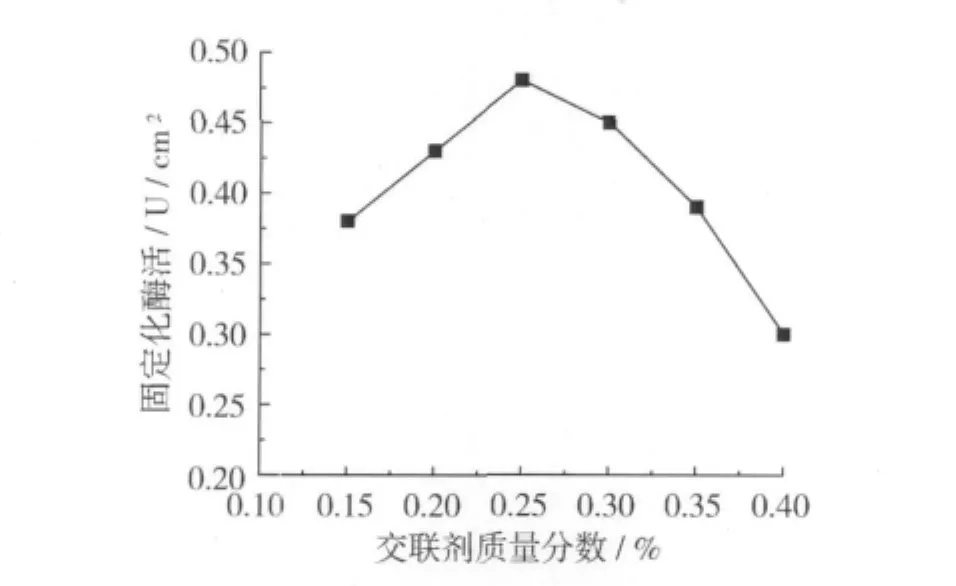
圖2 戊二醛濃度對固定化酶活的影響
由圖2可知,當交聯劑質量分數為0.25%時固定化酶活力最大,當交聯劑質量分數低于0.25%時,固定化酶活隨交聯劑濃度的增大而增加,而高于此值后固定化酶活力逐漸下降。
2.1.3 交聯時間對固定化酶活的影響
交聯時間是一個需要嚴格控制的操作條件,試驗選取1~6 h對交聯時間進行考察,結果如圖3所示。
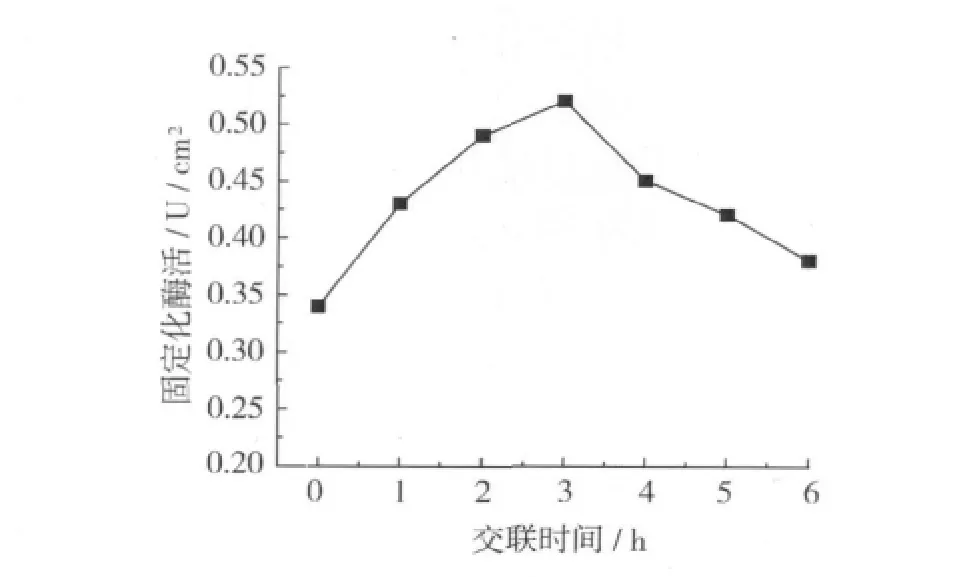
圖3 交聯時間對固定化酶活的影響
由圖 3 可知,在交聯時間為 1、2、3、4、5、6 h 時,對酶的固定化效果分別進行測定。在1 h時,酶活力還很低,只有0.42 U/cm2,說明大部分的酶還沒有被交聯上,繼續延長交聯時間,2 h時活力上升為0.48 U/cm2,到3 h 時,酶活力最大,為 0.54 U/cm2,再繼續延長交聯時間,酶活力開始下降,到5 h后,酶活力變化趨于穩定,不再繼續下降。說明3 h為最佳交聯時間。
2.1.4 酶液濃度對固定化酶活的影響
在高碘酸鈉濃度為0.15 mol/L,氧化時間為60 min的條件下,氧化活化后的醋酸纖維素/聚丙烯復合膜懸浮于不同酶濃度的pH 8.0磷酸鹽緩沖溶液中交聯3 h,試驗選取0.02~0.2 g/10 mL酶液濃度進行考察,結果如圖4所示。
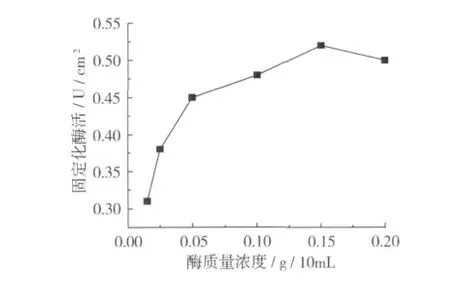
圖4 酶濃度對固定化酶活的影響
由圖4可知,當酶的質量濃度為0.015 g/mL時固定化效果最好。當酶的質量濃度低于0.015 g/mL時,固定化酶的酶活隨酶濃度的增大而增加,而高于此值固定化酶酶活不再增加。因此,確定酶液質量濃度為 0.015 g/mL。
2.2 回歸方程的建立與分析
由單因素試驗可以看出在脂肪酶的固定化過程中,交聯時間、交聯劑濃度、酶液濃度對固定化酶活力影響較大,而高碘酸鈉的濃度及活化時間主要是對酶膜上的羥基進行氧化,對固定化的整個過程有影響,而要確定固定化條件主要是對交聯時間、交聯劑濃度及酶液濃度進行優化即可。因此,在交聯時間3 h,交聯劑濃度0.25%,酶液濃度0.15 g/10 mL基礎上采用中心組合設計(Box - Benhnken)[17],以交聯時間(A)、交聯劑濃度(B)和酶液濃度(C)為自變量,固定化酶活力(Y)為響應值設計響應面試驗。自變量水平編碼見表1,試驗設計方案及結果見表2。
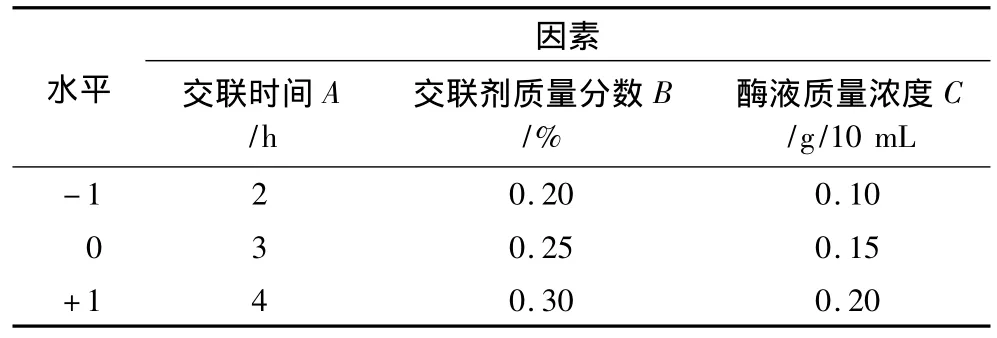
表1 因素水平編碼表
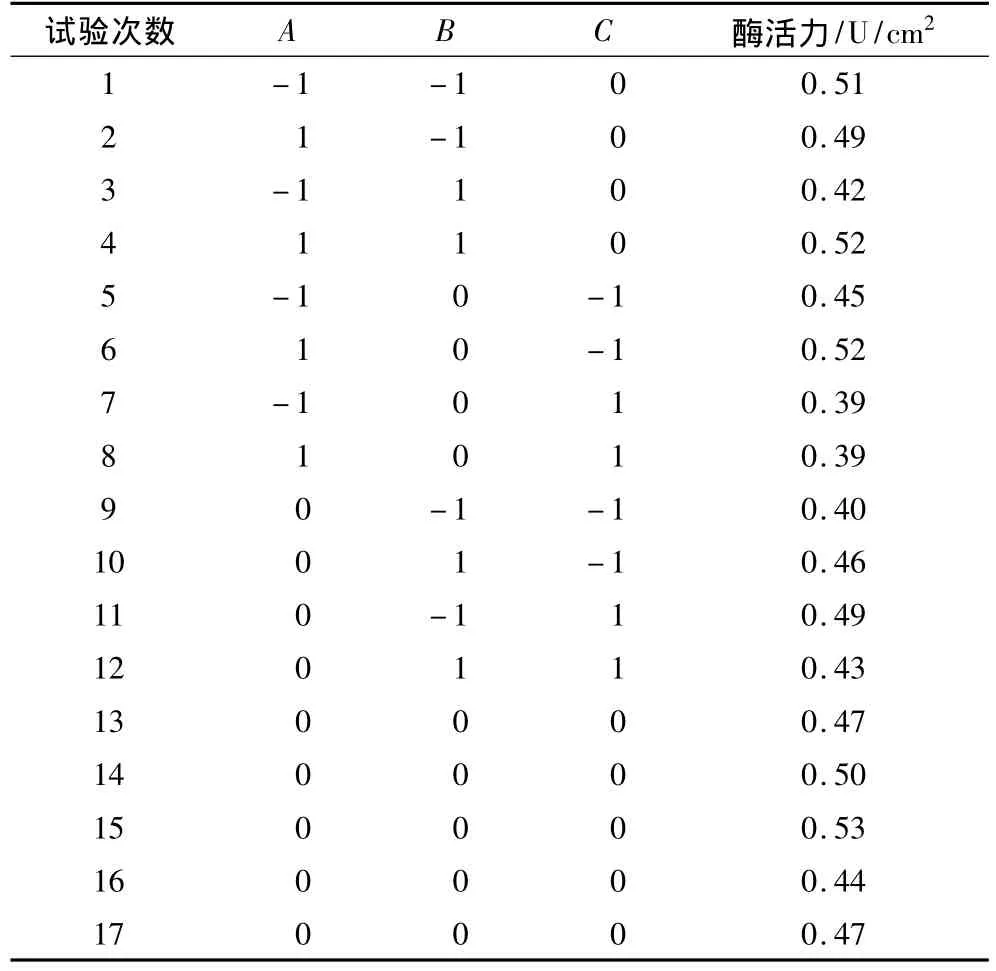
表2 響應面設計方案及試驗結果
利用Design Expert 7.0.0軟件對試驗結果進行方差分析,結果見表3(P<0.05為顯著項)。
通過對試驗數據進行多元回歸擬合,得到酶活力(Y)對自變量交聯時間(A)、交聯劑濃度(B)和酶液質量濃度(C)的回歸方程為:
Y=0.52+8.750E -003A -8.750E -003B -0.040C+2.500E - 003AC+2.500E - 003BC -0.033A2-0.038B2-0.041C2
由表3可知,方程因變量與自變量之間的線性關系明顯,該模型回歸顯著(P<0.000 1)失擬項不顯著(P >0.05),并且該模型 R2=97.98%,=95.38%說明該模型與試驗擬合良好。由表3還可以看出,脂肪酶的固定化過程中的 A、B、C、A2、B2和 C2為顯著影響因素。圖5為交聯時間與交聯劑濃度、交聯時間與酶液質量濃度和交聯劑濃度與酶液質量濃度的交互作用對酶活力的響應曲面圖。
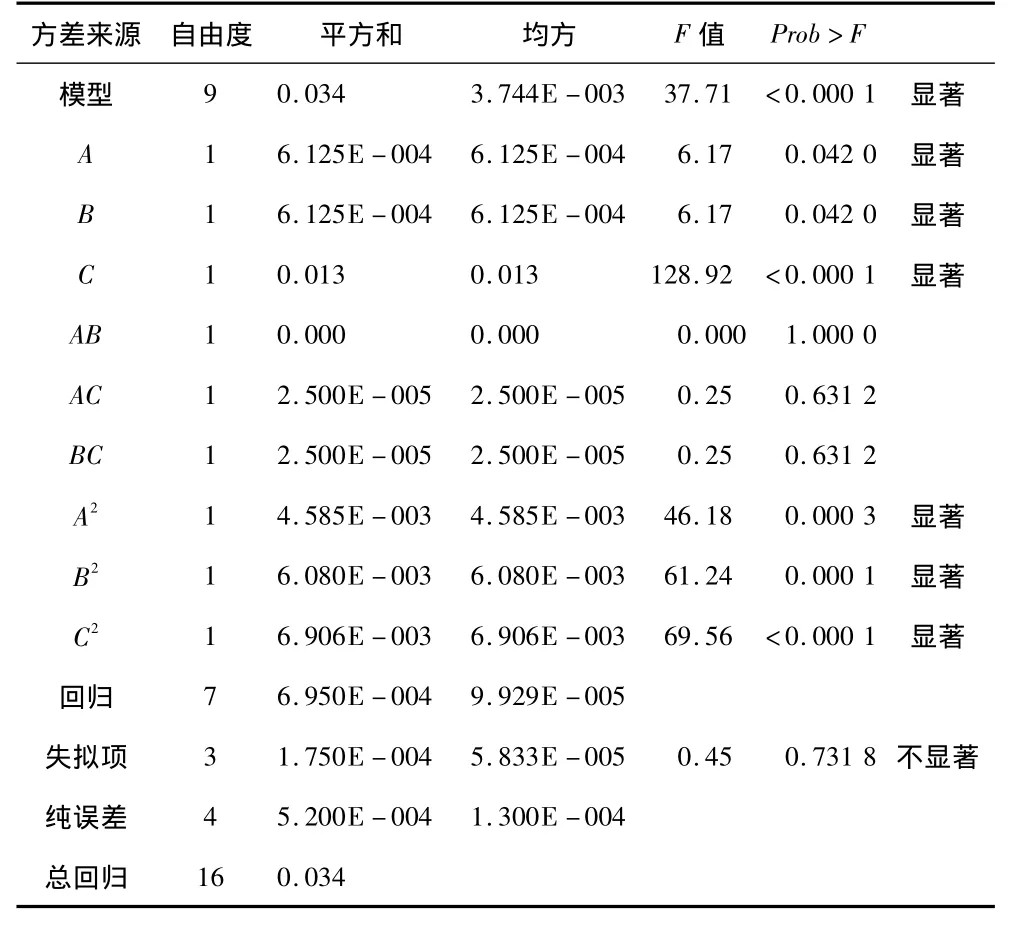
表3 方差分析結果
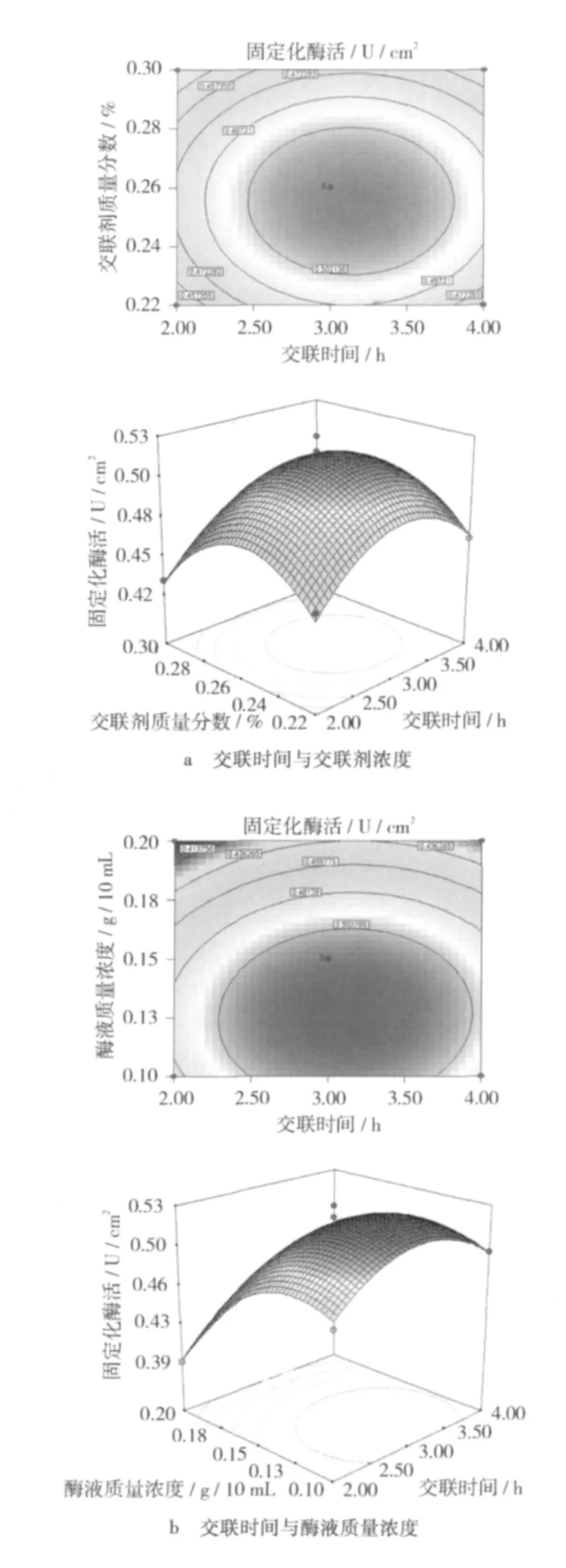
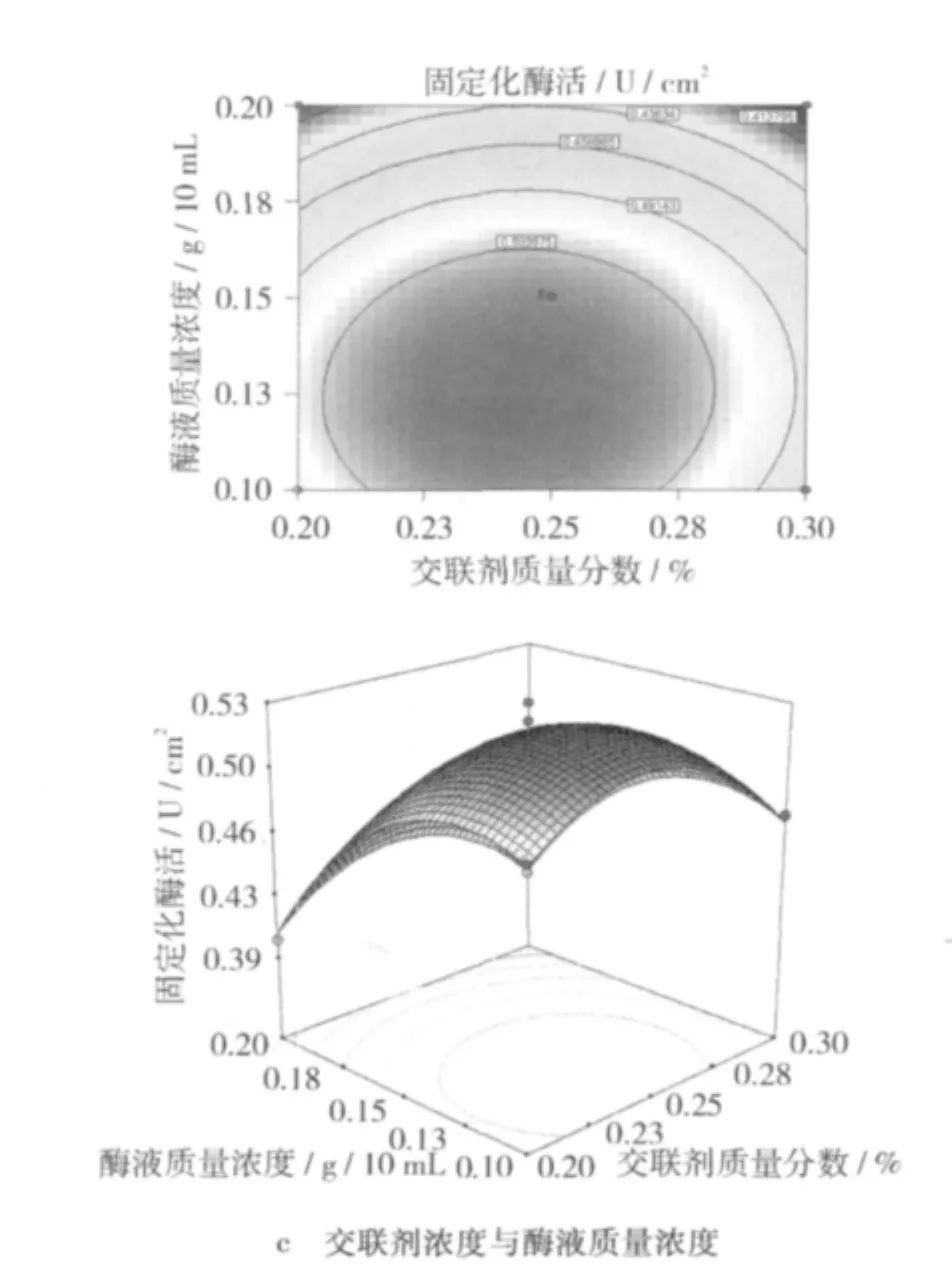
圖5 不同因素交互影響酶活力的等高線和響應面圖
由圖5a可知,酶活力的極值出現在試驗范圍內,在交聯時間為2.5~3.5 h,交聯劑質量分數約為0.25%時,酶活力在0.5 U/cm2以上。
由圖5b可知,酶活力的極值出現在試驗范圍內,在酶液質量濃度為0.13~0.18 g/10 mL,交聯時間約為3 h時,酶活力在0.5 U/cm2以上。
由圖5c可知,酶活力的極值出現在試驗范圍內,在交聯劑質量分數為0.23% ~0.28%,酶液質量濃度為0.15 g/10 mL時,酶活力在0.5 U/cm2以上。
應用響應面優化分析方法對回歸模型進行分析,尋找最優響應結果見表4。
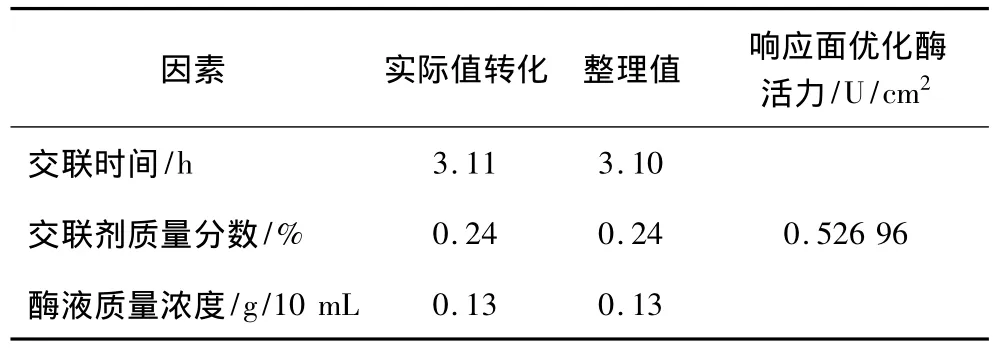
表4 響應面尋優結果
為檢驗響應面方法所得結果的可靠性,按照上述整理值進行試驗,得到的酶活力為0.52 U/cm2。預測值與試驗值之間的良好擬合性證實了模型的有效性。表明所得出的回歸方程可以很好的反映交聯時間、交聯劑濃度和酶液濃度與酶活力的關系。因此響應面分析法所得到的固定化條件參數準確可靠,在實踐中具有可行性。
2.3 固定化酶最適溫度和pH穩定性
2.3.1 固定化酶的最適溫度
在高碘酸鈉濃度為0.15 mol/L,氧化時間為60 min的條件下,氧化活化后的醋酸纖維素/聚丙烯復合膜懸浮于濃度為0.013 g/mL的酶液,在pH 8.0磷酸鹽緩沖溶液中交聯3.1 h,進行固定化脂肪酶。將在上述條件下固定化的脂肪酶,分別在不同溫度條件下測定酶活并與游離酶作比較,結果如圖6所示。
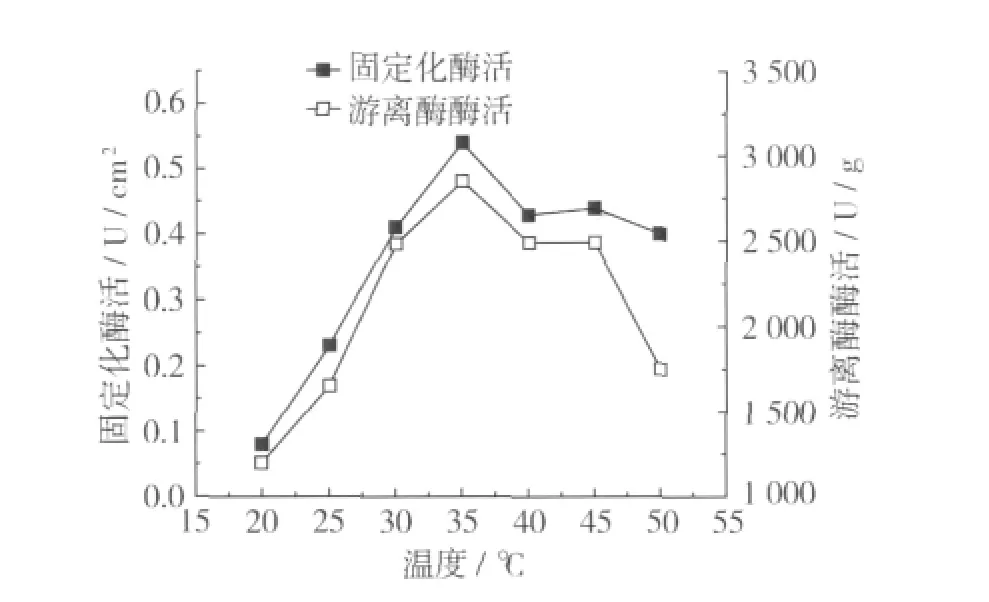
圖6 溫度對固定化酶活及游離酶的影響
由圖6可知,固定化酶的最適溫度與游離酶接近,但是固定化酶活隨溫度變動的幅度比游離酶小。以上結果說明,該固定化酶對溫度的敏感性更穩定,不易失活。
2.3.2 固定化酶的最適pH
選擇不同的反應pH,按上述測定固定化酶最適酶學性質的步驟進行試驗,結果如圖7所示。
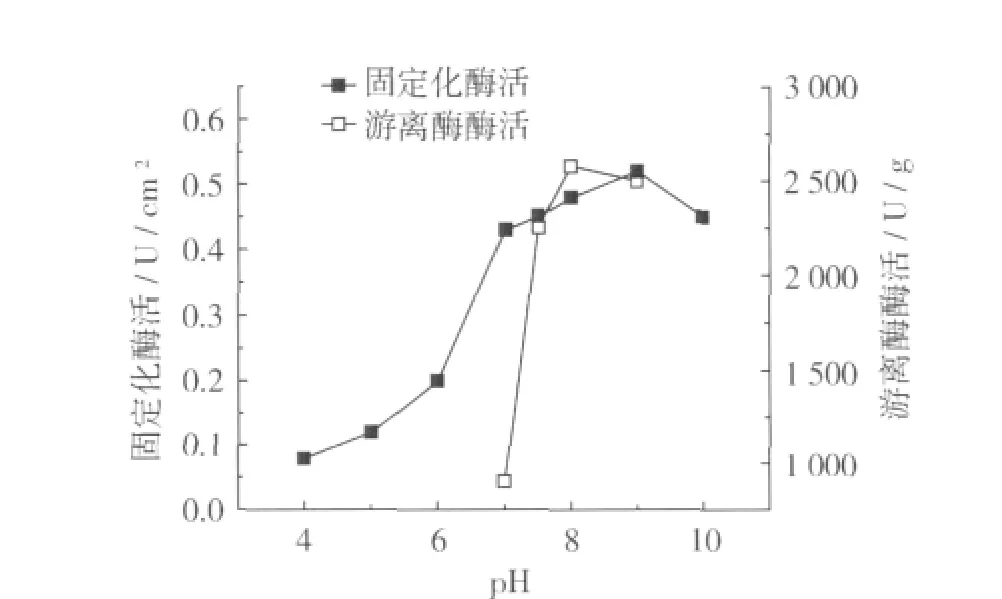
圖7 PH值對固定化酶活及游離酶的影響
由圖7可知,通過比較固定化酶和游離酶對pH的敏感性發現,固定化酶的最適pH為9.0,說明固定化酶受微環境的影響比游離酶小,且固定化后的脂肪酶的pH變化范圍不大。
3 結論
本試驗研究了以醋酸纖維素/聚丙烯復合膜為載體的高碘酸鈉氧化法固定化脂肪酶的固定化條件,基于高碘酸鈉的氧化活化作用下,酶分子能夠更好地與載體相交聯,并采用響應面分析法優化固定化條件,通過試驗確定了:當高碘酸鈉濃度為0.15 mol/L,活化60 min,交聯劑質量分數為0.24%,與質量濃度為0.013 g/mL的酶和pH 8.0的磷酸鹽緩沖溶液交聯3.1 h后,獲得的固定化酶酶活最高,為0.52 U/cm2。采用響應面優化的結果進行進一步試驗討論了固定化后的脂肪酶的pH及溫度穩定性,結果是pH變化范圍不大,且對溫度的敏感性更穩定,最適pH為9.0,最適溫度為35℃。
[1]Ayhn D.Biodiesel Fuels from Vegetable Oils Via Catalytic and Non-catalytic Supercritic Alcohol Transes-terification and ThermethodsA Survey[J].Energy Conversion and Management,2003,44(13):2093 -2109
[2]Kaieda M,Samukawa T,Matsumoto T,et al.Biodiesel Fuel Production from Plant Oil Atalyzed by Rhizopus oryzae Lipase inaWater-containing System Without an Organic Solvent[J].Journal of Bioscience and Bioengineering,1999,88:627-631
[3]Mohamed M,Soumanou UWE T,Bornscheuer.Improvement in Lipase-catalyzed Synthesis of Fatty Acid Methyl Estersfrom Sunflower Oil[J].Enzyme and Microbial Technology,2003,33:97 -103
[4]Shimada Y,Watanabe Y,Sugihara A,et al.Enzymatic Alcoholysis for Biodiesel Fuel Production and Application of the Reaction to Oil Processing[J].Journal of Molecular Catalysis B:Enzymatic,2002,17(3 -5):133 -142
[5]周曉云.酶學原理與酶工程[M].北京:中國輕工業出版社,2005:181-182
[6]劉秀偉,司芳.酶固定化研究進展[J].化工技術經濟,2003,21(4):12 -16
[7]孫君社,江正強,劉萍.酶與酶工程及其應用[M].北京:化學工業出版社,2006,89-93
[8]羅貴民,曹淑桂,張今.酶工程[M].北京:化學工業出版社,2002,37 -52
[9]崔娟,吳堅平,楊立榮,等.脂肪酶固定化研究和應用[J].化學反應工程與工藝,2005,21(1):43
[10]RogerA.Sheldon.EnZymeImmobilization:TheQuestforOpti mumPerformanee[J].Reviews,2007,10(1002):1289 -1307[11]徐堅,王玉軍,駱廣生,等.利用醋酸纖維素/聚四氟乙復合膜中的微結構固定化脂肪酶[J].化工學報,2006,57(10):2372-2377
[12]林繁華,張慶慶,湯斌,等.醋酸纖維素/聚丙烯復合膜固定化脂肪酶的研究[J].安徽工程科技學院學報,2007,22(3):16-19
[13]Sanderson C J,Wilson D V.A simple methed for coupling pro - teins to insoluble polysaccharides[J].Immunology,1971,20:1061 -1065
[14]Bustos N,Stella A M,Wider D X.Srudies on erythrocyte amino-laevulinate dehydratase.I Its purification and possible therapeu - tic applications[J].Int.J.Biochem.,1980,12:745-749
[15]Watanabe N,Yasuhide OTA,Yasuji M.Isolation and identification of alkaline lipase producingmicroorganisms,cultural conditions and some properties of crude enzymes[J].Agric.Biol.Chem,1997,41(8):1353 -1358
[16]彭立鳳,譚天偉.脂肪酶膜固定化方法的研究[J].中國油脂,2000,25(01):58 -61
[17]吳有煒.試驗設計與數據處理[M].蘇州:蘇州大學出版社,2002,115 -154.
Study on the Lipase Immobilization by Means of Sodium Periodate Oxidation
Liu Jing1Wang Xue1Zhang Jianing1Li Yue1Wang Xiaohong2Yu Dianyu1
(College of Food Science,Northeast Agricultural University1,Harbin 150030)
(Hei Long Jiang Food Scientific Institute2,Harbin 150030)
(School of Food Science and Technology,Northeast Agricultural University3,Harbin 150030)
The lipase was immobilized on the acetylcellulose/polypropylene composite membrane by Sodium periodate oxidation and the response surface analysis was used to further optimize immobilized conditions,and then discussed the properties of immobilized enzyme membrane.The results indicated that the optimal conditions of the immobilized lipase are:with immobilized enzyme activities for index,the sodium periodate concentration was 0.15 mol/L,activated 60 min,which the lipase concentration was 0.013 g/mL with cross-linking agent concentration was 0.24%under the phosphate buffered solution of pH was 8.0,then after the time of adsorption - crosslinking for 3.1 h of temperature at 4 ℃,separately.The lipase activities were 0.52 U/cm2,and the optimal pH of the immobilized lipase was 9.0,the optimal operating temperature of the immobilized lipase was 35 ℃.
sodium periodate,acetylcellulose/polypropylene,lipase,lmmobilization
TS229
A
1003-0174(2012)04-0068-06
國家科技支撐計劃(2011BAD02B01)
2011-08-24
劉晶,女,1986出生,碩士,糧食油脂及植物蛋白工程
于殿宇,男,1964年出生,教授,大豆油脂加工技術

