重組人腸三葉因子減輕燒傷后腸源性高代謝的實驗研究*
吳修文,王 煥,吳 煒,張 勇,萬千雪,金 星,徐淑秀△,彭 曦▲
(1.蚌埠醫學院護理系,安徽蚌埠233030;2.第三軍醫大學西南醫院全軍燒傷研究所/創傷、燒傷與復合傷國家重點實驗室,重慶400038)
腸道不僅是消化器官,還是體內最大的內分泌和免疫器官,腸道神經系統也是僅次于中樞神經系統的復雜體系。因此,“腸道是外科創傷應激的中心器官”這一概念已逐漸為人們接受[1]。但多年來,腸道在嚴重創傷后機體高代謝反應中的地位仍不夠明確。通過多年研究發現嚴重燒傷后高代謝源不僅來源于創面,腸道也是重要的高代謝源,形成了“腸源性高代謝”的概念[2]。如能有效維護腸黏膜屏障,減少細菌和毒素移位,降低機體過度炎癥反應,就有可能預防腸源性高代謝的發生,從而適度降低燒傷后高代謝,改善患者預后。
腸三葉因子(intestinal trefoil factor,ITF)是腸道杯狀細胞特異分泌的生長因子類多肽,具有很強的腸道保護功能[3]。本課題組前期研究證實,燒傷后腸道ITF分泌減少,提供外源性ITF能有效減輕燒傷后胃腸道損傷[4],但是否能進一步降低燒傷后腸源性高代謝還不清楚。因此,本研究將著重觀察ITF對燒傷后腸源性高代謝的影響,并探討其機制,以期為ITF在燒傷臨床的應用奠定基礎。
1 材料與方法
1.1 動物模型
1.1.1 燒傷模型制作及分組 健康成年BALB/c小鼠72只,體質量(22±3.0)g,雌雄不限(第三軍醫大學附屬大坪醫院實驗動物中心提供)。隨機分成3組,正常對照(control,C)組、燒傷對照(burned,B)組和ITF治療(ITF)組,實驗分燒傷后1、3、5、7 d 4個時相點。C組8只小鼠,B組和ITF組各32只小鼠(每個時相點8只)。C組不予燒傷,其他2組小鼠燒傷前禁食12 h,1%戊巴比妥鈉(40 mg/kg)腹腔麻醉,背部電推剃毛,稱質量后置剃毛區于80℃,水浴20 s,造成30%體表面Ⅲ度燒傷。傷后按40 mL/kg腹腔注入復方乳酸鈉液抗休克。創面涂2%碘酊抗感染,每天2次,傷后給予標準動物顆粒飼料喂養,自由飲水。
表1 C組及小鼠燒傷后不同時相點REE的變化(±s,kj×103/m2)

表1 C組及小鼠燒傷后不同時相點REE的變化(±s,kj×103/m2)
*:P<0.05,與C組0d時比較;△:P<0.05,與B組同時相點比較;-:表示無數據。
組別0d 1 d 3 d 5 d 7 d B組-11.24±1.23 18.82±1.42*22.45±1.96*28.35±3.12*ITF組-12.15±1.22 15.88±1.25*△16.47±1.33*△19.45±1.78*△C組12.24±1.15----
表2 C組及小鼠燒傷后不同時相點血漿LPS含量的變化(±s,U/mL)
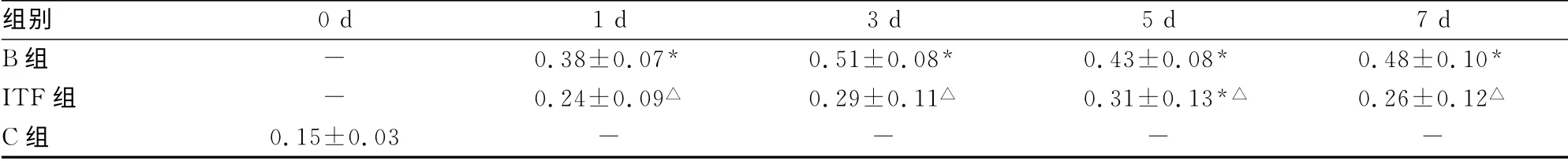
表2 C組及小鼠燒傷后不同時相點血漿LPS含量的變化(±s,U/mL)
*:P<0.05,與C組0d時比較;△:P<0.05,與B組同時相點比較;-:表示無數據。
組別0d 1 d 3 d 5 d 7 d B組-0.38±0.07*0.51±0.08*0.43±0.08*0.48±0.10*ITF組-0.24±0.09△0.29±0.11△0.31±0.13*△0.26±0.12△C組0.15±0.03----
表3 C組及小鼠燒傷后不同時相點血漿TNFα含量的變化(±s,μg/mL)

表3 C組及小鼠燒傷后不同時相點血漿TNFα含量的變化(±s,μg/mL)
*:P<0.05,與C組0d時比較;△:P<0.05,與B組同時相點比較;-:表示無數據。
組別0d 1 d 3 d 5 d 7 d B組-1.63±0.29 4.26±0.52*3.56±0.48*4.06±0.30*ITF組-1.72±0.33 2.50±0.35*△2.12±0.30*△2.55±0.25*△C組1.39±0.21----
表4 C組及小鼠燒傷后不同時相點血漿IL-1含量的變化(±s,ng/mL)

表4 C組及小鼠燒傷后不同時相點血漿IL-1含量的變化(±s,ng/mL)
*:P<0.05,與C組0d時比較;△:P<0.05,與B組同時相點比較;-:表示無數據。
組別0d 1 d 3 d 5 d 7 d B組-0.21±0.06 0.38±0.09*0.41±0.10*0.36±0.07*ITF組-0.23±0.05 0.25±0.06△0.28±0.05*△0.23±0.04△C組0.19±0.05----
表5 C組及小鼠燒傷后不同時相點血漿IL-1含量的變化(±s,ng/mL)
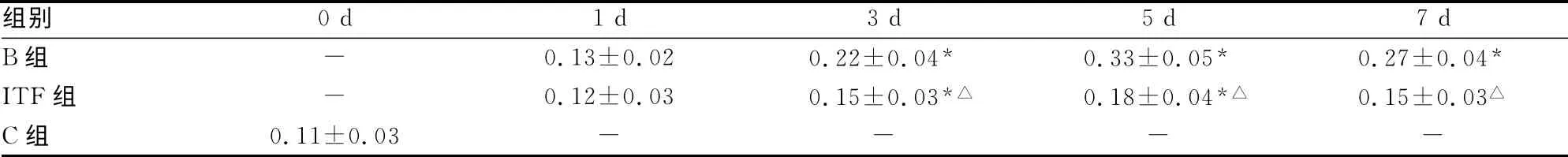
表5 C組及小鼠燒傷后不同時相點血漿IL-1含量的變化(±s,ng/mL)
*:P<0.05,與C組0d比較;△:P<0.05,與B組同時相點比較;-:表示無數據。
組別0d 1 d 3 d 5 d 7 d B組-0.13±0.02 0.22±0.04*0.33±0.05*0.27±0.04*ITF組-0.12±0.03 0.15±0.03*△0.18±0.04*△0.15±0.03△C組0.11±0.03----
1.1.2 藥物來源及給藥方式 重組人ITF(recombinant human ITF,rhITF)來源于本課題組的前期制備,采用畢赤酵母重組表達發酵獲得的rhITF經驗證與理論值完全相符,毒理學實驗已證實該重組蛋白毒副作用非常輕微。燒傷后2 h后采用rhITF灌胃,劑量為1.0 mg/kg,每次給藥容量為0.5 mL,每天分2次給藥。
1.2 檢測指標
1.2.1 靜息能量消耗(resting energy expenditure,REE)測定在清醒、空腹和安靜狀態下,將小鼠放入一密閉容器中,15 min后收集氣體,用血氣分析儀測定氣體中O2和CO2的變化,再以Weir公式計算:REE(kJ/d)=[3.9×吸入O2(L/min)+1.1×呼出CO2(L/min)]×1 440×4.184。小鼠體表面積計算公式:S(cm2)=KW2/3,K=0.091 3;W=動物體質量(g)。
1.2.2 血漿腫瘤壞死因子(tumor necrosis factor-alpha,TNFα)、白細胞介素-1(interleukin-1,IL-1)和IL-6的檢測 采用放射免疫法,試劑盒由北京普爾偉業生物科技有限公司提供,具體操作參見說明書。
1.2.3 血漿內毒素(ipoply saccharide,LPS)測定 采用基質偶氮顯色鱟試劑測定其內毒素含量,試劑盒由上海市醫研所提供,按說明書操作,單位以U/mL表示。
1.3 統計學處理 應用SPSS13.0統計軟件進行數據分析,計量資料以±s表示,組間比較采用多因素方差分析,以P<0.05為差異有統計學意義。
2 結 果
3組小鼠REE、血漿LPS、血漿TNFα、血漿IL-1和血漿IL-6含量變化情況見表1~5。
3 討 論
生理狀況下,腸黏膜屏障能阻止腸腔中絕大部分細菌和毒素的移位,即便偶有移位發生,腸道和肝臟的免疫系統有能力清除移位的細菌和毒素,以維持機體內環境穩定[5]。嚴重燒傷導致應激反應,組織缺血、缺氧和免疫紊亂,引起腸道組織結構受損,破壞腸黏膜屏障的完整性,導致大量細菌和毒素移位,進而引發全身感染和高代謝反應。實驗結果顯示,小鼠燒傷后血漿內毒素含量大幅增加,且發生時間早,在傷后第1天即顯著高于傷前,燒傷后3 d達到峰值,隨后雖有所下降,但仍遠高于傷前。給予燒傷小鼠rhITF后能明顯降低血漿內毒素含量,提示rhITF能減輕燒傷后腸道損傷,減少腸腔細菌和毒素移位。燒傷后炎癥介質TNFα、IL-1和IL-6的變化趨勢與內毒素的變化類似,但變化時相晚于內毒素,一般在燒傷后3 d才大幅增加,提示燒傷后腸道內毒素入血是引起其他炎癥介質釋放的重要因素。燒傷后穿越腸黏膜屏障的內毒素具有很強的免疫刺激活性,能激活多種免疫細胞,產生大量炎癥介質,加重組織損傷和參與高代謝反應[6]。實驗結果顯示,給予rhITF能有效維護腸黏膜屏障,阻止內毒素入血,減輕了對免疫細胞的刺激,避免了炎癥反應的級聯放大效應,實驗結果說明,使用外源性rhITF后能降低腸源性高代謝,使機體代謝率保持在一個較為合理的水平,防止代謝率過高加重機體損傷。
腸源性高代謝是本課題組經過多年研究提出的一個新概念,其定義為:在各種病理狀態下,由于腸道本身受損以及腸腔內細菌、毒素移位造成的機體高代謝反應,它是炎癥介質、神經遞質、激素等多種因素共同作用的結果[2]。腸道損害是引發腸源性高代謝的結構基礎,維護腸黏膜屏障功能是降低腸源性高代謝的主要途徑。盡管腸源性高代謝的理論已提出,但防治措施還不完善。生長因子,尤其是腸道特異分泌的ITF在保護腸黏膜屏障中的作用值得重視,前期體外研究已經證實,ITF能減輕燒傷血清對腸上皮細胞的損傷,在維護腸黏膜屏障中起重要作用[7]。本實驗結果提示,使用外源性ITF能通過減輕燒傷后腸道損傷,維護腸黏膜屏障功能,減少腸腔細菌和毒素移位,減輕炎癥介質對免疫系統的刺激,以間接方式降低全身高代謝反應。但ITF是否能直接作用于免疫細胞,調控免疫細胞活性,減輕燒傷后免疫應激,下調機體炎癥反應,直接干預機體代謝反應,目前尚不甚清楚,值得深入研究。
[1]Turner JR.Intestinal mucosal barrier function in health and disease[J].Nat Rev Immunol,2009,45(9):799-809.
[2]汪仕良,鄧詩琳.燒傷代謝營養學[M].石家莊:河北科技出版社,2009.
[3]Kjellev S.The trefoil factor family-small peptides with multiple functionalities[J].Cell and Mol Life Sci,2009,66(7):1350-1369.
[4]Sun Y,Wu W,Zhang Y,et al.ITF produced in escherichia coli promotes the healing of rat burn-induced acute gastric mucosal lesions[J].J Trauma,2008,65(1):163-169.
[5]Todd WC,Carrie Y,Peterson L,et al.Role of p38 mapk in burn-induced intestinal barrier breakdown[J].J Surgical Res,2009,156(1):64-69.
[6]Mashkoor AC,Shadab NR,Michael JK,et al.Impaired intestinal immunity and barrier function:a cause for enhanced bacterial translocation in alcohol intoxication and burn injury[J].Alcohol,2004,33(3):199-208.
[7]吳修文,王煥,萬千雪,等.腸三葉因子和黏蛋白對燒傷血清所致腸上皮細胞免疫功能變化的影響[J].中華燒傷雜志,2011,27(5):341-346.

