膜生物反應器封閉循環發酵系統對野生酵母的馴化
胡 亮,丁文武,張 麗,王 偉,肖澤儀
(四川大學化學工程學院,四川成都 610065)
膜生物反應器封閉循環發酵系統對野生酵母的馴化
胡 亮,丁文武,張 麗,王 偉,肖澤儀*
(四川大學化學工程學院,四川成都 610065)
自然界中選育的野生酵母菌S3在PDMS膜生物反應器長期封閉循環系統中進行馴化,在經過3輪連續的封閉循環發酵適應性馴化實驗后,對第四輪實驗和第一輪實驗的酵母發酵性能進行比較,分析野生酵母的適應性進化行為,乙醇-細胞平均比產率、葡萄糖轉化率分別提高42.6%、2.1%,細胞平均死亡率減少11.04%;與商用的安琪酵母(ADY)相比,發酵性能也更優秀。結果表明在膜生物反應器封閉循環發酵系統中可以使野生酵母菌得到馴化。
PDMS膜生物反應器,野生酵母,長期封閉循環發酵,馴化
PDMS膜生物反應器封閉循環發酵工藝具有運行時間長、副產物積累量大的特殊性,要獲得優化的發酵操作工藝性能,酵母微生物是關鍵。而適應這種工藝的酵母菌種將不同于傳統發酵工藝所用酵母菌種[1]。通過適應性馴化選育優良酵母微生物是普遍采用的方法[2-6]。為了選育、馴化得到更適應PDMS膜生物反應器封閉循環發酵工藝的酵母菌,我們曾經在前期的工作中對商用工業酵母菌(湖北安琪酵母公司的耐高溫釀酒活性干酵母TH-AADY)進行培養馴化實驗[7]。基于遺傳基因相對純潔容易產生突變的原理,本文以自然界中分離得到的野生酵母菌S3為起始菌種,在PDMS膜生物反應器中進行4輪發酵周期為500h的長期封閉循環發酵,培養、馴化和選育適應性的優良菌種,并與起始菌種為TH-AADY的馴化菌株進行對比。
1 材料與方法
1.1 材料與儀器
耐高溫釀酒干酵母(TH-AADY) 湖北安琪酵母公司;野生酵母菌S3 本實驗室篩選獲得;純凈水
實驗室自制;葡萄糖 內蒙古阜豐生物科技有限公司;酵母膏 北京奧博星生物技術有限責任公司; (NH4)2SO4、KH2PO4、MgSO4·7H2O、CaCl2分析純,成都市科龍化工試劑廠。
Anke-TDL-5-A離心機 上海安亭科學儀器廠;DMA4500密度儀 Anton Paar Austria;202AB-1恒溫干燥箱 北京中興偉業儀器有限公司;AR2130/ C電子天平 OHAUS USA;AV400全自動生化分析儀 Olympus。
1.2 實驗方法
1.2.1 實驗菌種 自然界篩選獲得的野生酵母菌S3,詳細菌種篩選過程見參考文獻[1]。
耐高溫釀酒干酵母,在35~40℃的自來水或2%糖水中溶解,復活15~20m in直接投入發酵罐中發酵,無需培養。
1.2.2 培養基 基礎發酵培養基的組成(g/L蒸餾水):葡萄糖 100;酵母膏 1.6;(NH4)2SO410.0; KH2PO43.0;MgSO4·7H2O 1.1;CaCl20.3;其中除葡萄糖為工業級外,其他成分均為試劑級。
將培養基組分溶解后,高溫滅菌,冷卻到常溫后混合備用。
1.2.3 膜及膜組件 本實驗采用的膜以及膜組件都是由實驗室自行設計、制備和安裝,詳細見參考文獻[7-9]。
1.2.4 酵母菌的馴化
1.2.4.1 裝置和流程 實驗采用的PDMS膜生物反應器封閉循環系統詳細見參考文獻[7-9]。系統主要由三部分構成:發酵罐、膜組件、冷凝收集裝置。
1.2.4.2 實驗程序 將自然界篩選的野生酵母菌S3作為起始菌株,進行第一輪500h(21d)的封閉循環發酵,從發酵殘液里分離篩選出優勢菌種,轉移培養制成新的種子液,接種到PDMS膜生物反應器系統進行第二輪的500h發酵,如此重復執行發酵-篩菌-轉移培養的實驗操作程序,共4個輪次。封閉循環發酵實驗時,每天(8:30am~7:30pm)啟動滲透汽化膜分離,及時提取產物乙醇,并根據乙醇生產量和基質糖的消耗量添加原料葡萄糖;晚上(7:30pm~8:30am)則既不啟動膜分離,也不及時添加葡萄糖,但在白天膜分離操作結束時會適當加糖來維持發酵液中的殘糖濃度(90~110g/L),以維持晚上的發酵活動。
1.2.5 分析方法 每天白天早上8:30開膜以后,定時取出上游發酵液和下游滲透液進行分析。對發酵液,先用離心機離心兩次,再取出上清液進行蒸餾,用密度儀分別測定乙醇和葡萄糖液的濃度,用全自動生化分析儀精確定量葡萄糖濃度,再將離心后的菌泥洗入培養皿中,放入100℃的烘箱中烘干至恒重,用精度為0.001的電子天平稱量干重,對滲透液直接用密度儀進行測量。
2 結果與討論
2.1 菌種的馴化過程
本文公開的數據,是對自然界中選育的野生酵母菌S3經過3輪的發酵-篩菌-轉移培養馴化后,再進行第四輪的500h封閉循環發酵,把第四輪的發酵性能與第一輪的和商用安琪酵母(ADY)的發酵性能進行比較,以研究對S3的馴化效果。
2.1.1 每天的發酵環境變化 在白天(8:30am~7:30pm),滲透汽化膜分離連續取走發酵生成乙醇,并適時加入葡萄糖基質和氨水,操作模式使發酵液中糖濃度、pH和乙醇濃度維持基本恒定。在晚上(7:30pm~8:30am),既無基質加入也無產物取出,純發酵的過程連續消耗發酵液中的殘糖,使糖濃度單調下降,而產物乙醇濃度則單調增加,且發酵液pH也單調下降。這種發酵操作模式使得酵母的生長、繁殖和代謝等活動在一天之中就要經歷不同的環境條件變化,通過對發酵性能參數的分析,可以發現酵母細胞的一些適應性馴化行為和特征。
2.1.2 全過程中的發酵環境變化 由于整個500h循環發酵過程中取出的產物只有乙醇,對于酵母菌發酵生成的副產物沒有進行任何處理,副產物不斷累積使得酵母菌的生存條件不斷惡化,通過對全過程的平均發酵性能參數分析,可以發現酵母細胞的一些適應性馴化行為和特征。
2.2 每天適應性的馴化分析
2.2.1 晚上(7:30pm~8:30am)乙醇-細胞比產率比較 圖1為野生酵母菌第一輪、第四輪和ADY每天晚上發酵過程中的乙醇-細胞比產率,從圖1中的曲線發現,野生酵母在經過3輪發酵馴化后,第四輪在發酵過程中乙醇-細胞比產率與第一輪相比得到顯著提高,特別是在5~15d這段時間里,乙醇-細胞比產率提高一倍左右,說明經過本實驗系統三輪馴化以后,酵母菌出現適應性進化,發酵能力得到提高。
而與ADY的比較中,我們選用的野生酵母菌在馴化過程中第一輪前期乙醇-細胞比產率就要明顯優于ADY,13d以后相互之間差異不再明顯,但是第四輪野生酵母菌乙醇-細胞比產率明顯高于ADY。但同時可以看出,已經工業化的ADY乙醇-細胞比產率波動明顯比我們選育的野生酵母菌小,其菌種的穩定性比較高。說明選育的野生酵母有較高的適應性和進化能力,而ADY菌種經過工業化培養,自身穩定性高,對本系統的適應性差。
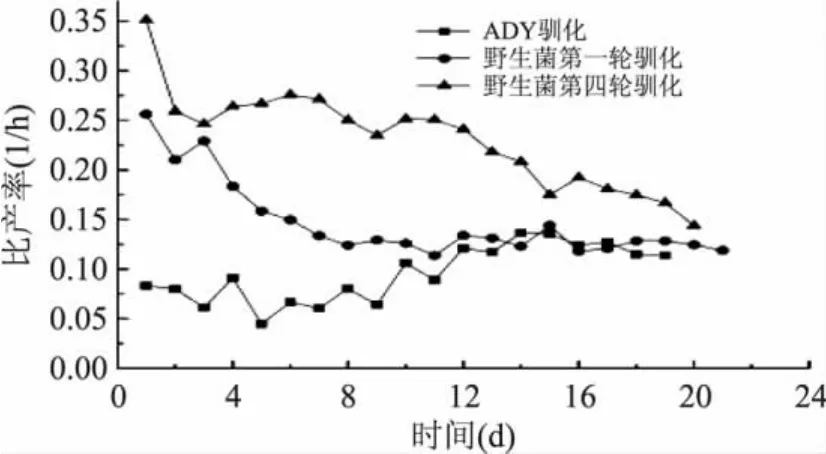
圖1 晚上(7:30pm~8:30am)乙醇-細胞比產率的時間曲線Fig.1 The time course of ethanol-cells yield from 7:30pm to 8:30am
2.2.2 白天(8:30am~7:30pm)乙醇-細胞比產率和細胞死亡率比較 圖2為野生酵母菌第一輪、第四輪和ADY每天白天發酵過程中的乙醇-細胞比產率,圖3是發酵過程中的細胞死亡率。從圖2中我們可以看出,第1d發酵性能與后面相比出現較大差異,這是由于第1d主要是讓酵母菌種在發酵罐中生長。將后面曲線中第四輪白天乙醇-細胞比產率與第一輪相比:第一輪乙醇-細胞比產率表現較平穩,第四輪卻出現了明顯的波動,特別表現在第4d、第8d和第12d,酵母菌的發酵能力進一步增強,可以看出經過幾輪馴化后,酵母菌進化能力得到提高;整體上第四輪比產率明顯高于第一輪,可以得出經過3輪馴化后酵母菌出現了適應性進化,發酵能力得到顯著提高。ADY和第一輪乙醇-細胞比產率差異整體比較小,與第四輪比較差異較大,乙醇-細胞比產率第四輪明顯高于ADY。說明野生酵母對該系統具有更快和更強的適應性。
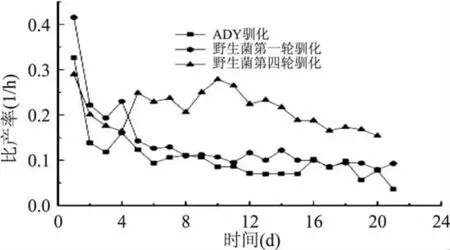
圖2 白天(8:30am~7:30pm)乙醇-細胞比產率的時間曲線Fig.2 The time course of ethanol-cells yield from 8:30am to 7:30pm
在表1中列出了第8d、第9d和第10d的乙醇-細胞比產率、細胞死亡率和乙醇體積產率,單調上升的比產率和體積產率意味著酵母發酵能力的增強,顯示了適應性進化的趨勢。
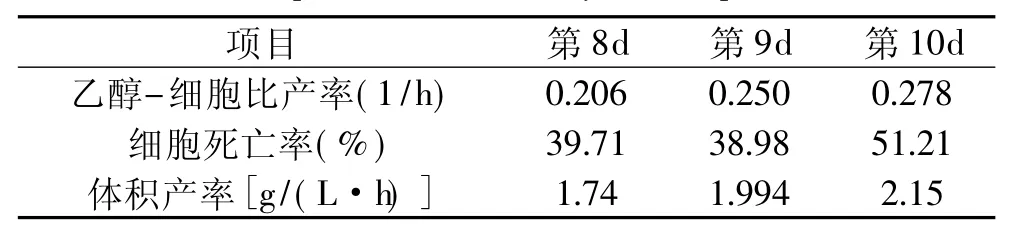
表1 菌種適應性行為的比較Table 1 Comparison of the wild yeast adaptive evolution
從圖3中可以看出,經過3輪馴化后的野生酵母菌的死亡率與第一輪比較有了減少的趨勢,但是與ADY死亡率比較,在前期ADY的死亡率低于我們選育的野生酵母菌,說明我們選育的野生酵母在一定條件下的生存能力還要進一步馴化使其加強,可是在14d以后,ADY的死亡率持續的增加,而野生酵母菌的死亡率達到了一定的穩定狀態,這就可以得出選育的野生酵母菌在我們這個發酵系統中,在經過馴化后乙醇-細胞比產率得到提高的同時,其在后期惡劣條件下的生存能力也得到提高,對于長時間的發酵比ADY酵母菌的適應性要好。
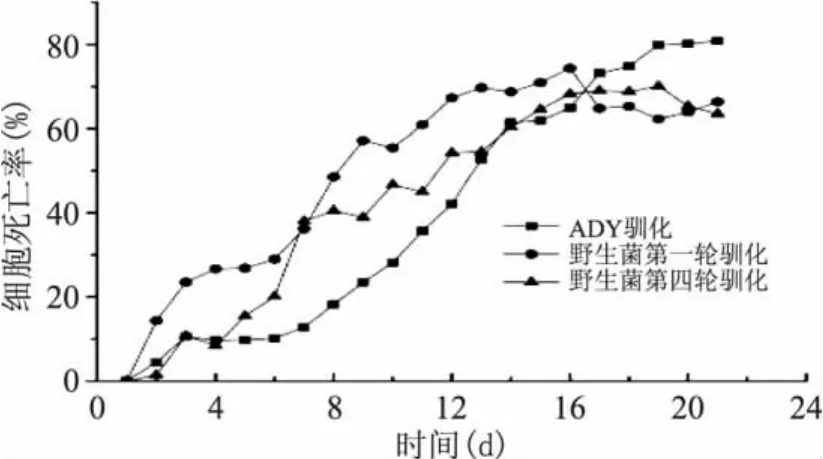
圖3 細胞死亡率的時間曲線圖Fig.3 The time course of cellmortality rate
2.2.3 白天(8:30am~7:30pm)和晚上(7:30pm~8:30am)乙醇-細胞比產率差比較 在對白天和晚上發酵性能的比較中,發現白天的曲線整體比晚上的要平整很多,晚上的波動很大。晚上階段,系統中沒有基質加入,發酵液糖濃度單調下降,膜分離不運行,使發酵液中產物乙醇濃度單調累積增加,且發酵液中的pH未有調整,這些因素使晚上的發酵條件與白天明顯不同,酵母菌需要適應不同的環境條件,因此也表現變化的發酵性能﹔而白天階段,發酵液中的糖濃度、乙醇濃度和pH都由于糖的不斷補加、乙醇被膜分離連續提取和酸的加堿中和而保持基本恒定,使得酵母在一個較為穩定的環境中生存,發酵性能表現比較平穩。
2.3 全過程中的馴化分析
在整個循環發酵馴化過程中雖然發酵條件不斷惡化,但細胞卻能不斷保持活性,不斷生長。從表2中的數據對比可以看出,第四輪發酵性能與ADY以及第一輪相比較:乙醇-細胞平均比產率、葡萄糖轉換率有顯著的提高;細胞平均死亡率相比第一輪明顯減少,與ADY差異不大;發酵液平均乙醇濃度也不斷增高。說明酵母逐漸適應了PDMS膜生物反應器系統的長期封閉循環發酵環境,發酵能力得到改善,或者說產生了一定程度的適應性進化特征;也說明該系統對野生酵母進行馴化的有效性。

表2 乙醇-細胞平均比產率、葡萄糖轉化率、細胞平均死亡率、發酵液平均乙醇濃度Table 2 The ethanol-cells yield,glucose conversion ratio,cellmortality ratio,average concentration of ethanol fermentation
3 結論
在PDMS膜生物反應器封閉循環發酵系統中對野生菌種進行馴化,馴化效果很明顯。與成熟的工業酵母菌(ADY)相比,在該系統中馴化后的野生酵母菌的發酵能力有很大提高;在發酵過程中,發酵液環境條件變得更加惡劣后,馴化菌株也表現出更好的生長能力和活性,顯示出很強的環境適應性。實驗證明,用膜生物反應器封閉循環發酵系統來進行菌種的馴化是一種可行的方法。
[1]丁文武,湯曉玉,傅晟偉,等.適合硅橡膠膜生物反應器乙醇發酵的酵母選育[J].四川大學學報,2011(2):161-165.
[2]Bruce S.Development of new ethanolgenic Echerichia coli strains for fermentation oflignocellulosic biomass[J].Humana Press Inc,2000,331:181-196.
[3]宋德貴,康浩,楊生玉.高酒精耐受力酵母菌菌種的選育[J].廣西師范大學學報,2008(4):124-127.
[4]馬立安.耐高溫酒精酵母菌馴化與篩選[J].湖北農業大學學報,2000(1):72-73.
[5]王昌魁,張利莉,賀江舟,等.耐高溫耐高糖酵母的篩選與馴化[J].江西農業學報,2008(5):100-101.
[6]宋安東,康懷彬,李艷梅,等.蘋果酒酵母菌的馴化實驗[J].釀酒,2003(2):44-45.
[7]傅晟偉,湯曉玉,周一慧,等.膜生物反應器用于乙醇連續發酵菌株的適應性培養[J].中國釀造,2010(3):102-105.
[8]鐘月華,肖澤儀,黃衛星,等.硅橡膠膜生物反應器乙醇連續發酵傳質動力學實驗研究[J].四川大學學報,2003(3): 49-53.
[9]石爾,肖澤儀,黃衛星,等.硅橡膠膜生物反應器封閉循環連續發酵制造乙醇放大實驗[J].高校化學工程學報,2007 (2):280-285.
Acclimatization of w ild yeast through the close-circulating fermentation system w ith a PDMS membrane bioreactor
HU Liang,DING W en-wu,ZHANG Li,WANG Wei,XIAO Ze-yi*
(College of Chemical Engineering,Sichuan University,Chengdu 610065,China)
A w ild yeast strain S3 selec ted from nature was acc lim atized in a PDMS m em b rane b ioreac tor system. After continuous three rounds of c lose-circulating fermentation and acc limatizing cultivation,a fourth round of experim entwas conducted.By com paring ferm ent performances during the first and fourth rounds of experiments,adap tive evolution and acc lim atization of the w ild yeastwere analyzed.The results ind icated that the ethanol yield and g lucose conversion ratio inc reased by 42.9%and 2.1%respectively,and the cellmortality ratio dec reased by 11.04%.Comparing with commercial ADY,the evolved strain of the wild yeast also behaved better fermentation performance.Itwas shown that in the c lose-circulating fermentation system with themembrane bioreactor,the wild yeast could be acc limatized.
PDMSmembrane bioreactor;wild yeast;long-term close-circulating fermentation;acc limatization
TS201.3
A
1002-0306(2012)06-0230-04
2011-06-21 *通訊聯系人
胡亮(1986-),男,碩士研究生,主要從事發酵方面的研究。
國家自然科學基金(20776088)。

