乙型肝炎卡介苗聯合疫苗免疫豚鼠及小鼠的病理學研究
蔡 巖,趙曉青,李繼宏,周 捷,周長軍,趙亞力,惠 琦*
(1.長春生物制品研究所有限責任公司,吉林 長春 130062;2.吉林亞泰生物藥業股份有限責任公司,吉林 長春 130033)
據衛生部公布的我國法定傳染病疫情概況顯示,近十年乙型肝炎和肺結核的發病數一直位居乙類傳染病之首,是長期以來嚴重影響國民公共健康的傳染病。因此,預防乙型肝炎和結核病,仍是我國一項長期而艱巨的任務。卡介苗優化乙型肝炎疫苗的免疫應答作用已見報道[1-2]。為檢查乙型肝炎卡介苗聯合疫苗(簡稱HBV-BCG聯合疫苗)中乙肝表面抗原(簡稱HBsAg)是否存在促使卡介苗(簡稱BCG)毒力增強的潛在因素,即HBsAg能否使BCG引起的良性免疫病理反應,演變為惡性化的結核性病變,本文系統觀察了皮內注射用HBV-BCG聯合疫苗皮下免疫豚鼠的毒性病理損傷,并比較了HBV-BCG聯合疫苗與單價BCG接種小鼠局部皮膚的毒性反應及可逆性變化,為HBV-BCG聯合疫苗臨床前安全性評價提供病理資料。
1 材料與方法
1.1 材料
1.1.1 疫苗 BCG:批號 20021225,規格 10人份/支;HBV-BCG聯合疫苗:批號20021208,規格HBsAg 10 μg 和 BCG 0.05 mg/人份;凍干保護劑0.2 mL/支。保存條件4℃,均為長春生物制品研究所試制。
1.1.2 豚鼠 18只,體重350~400 g,雌雄各半。長春生物制品研究所實驗動物室提供,試驗前每只豚鼠的PPD試驗結果均為陰性。
1.1.3 BALB/c小鼠 60 只,體重 14 ~15 g,雌雄各半,長春生物制品研究所實驗動物室提供,試驗前所有小鼠的PPD試驗結果均為陰性。
1.2 方法
1.2.1 動物分組與處理 18只豚鼠分為3組,每組6只。設空白對照組、BCG免疫組和HBV-BCG聯合疫苗組,空白對照組未接種任何材料;BCG組于腹部左側腹股溝皮下接種BCG 50人份/只(1 mL),HBV-BCG聯合疫苗組于腹部左側腹股溝皮下接種 HBV-BCG聯合疫苗 50人份/只(1.25 mL),上述3組動物觀察至42天全部活殺。60只小鼠分為3組。設對照組6只、BCG組和HBVBCG聯合疫苗組各27只。對照組于腹部皮內接種凍干保護劑0.2 mL/只,1次;BCG免疫組于腹部皮內接種BCG 0.1 mL/只,1次;HBV-BCG聯合疫苗組于腹部皮內接種HBV-BCG聯合疫苗0.1 mL/只,1次。上述3組小鼠分別于接種后觀察至第 3、5、7、9、11、15、20、25、30 天各活殺 3 只。
1.2.2 大體剖檢及病理組織學觀察 各組動物按計劃系統解剖,經肉眼檢查胸腔、胸膜、雙肺各葉、心包膜、心、腹腔、腹膜、大網膜、肝、脾、胰、腎、腎上腺、頸淋巴結、肺門淋巴結、腸系膜淋巴結、接種局部皮膚及左右側鼠蹊部淋巴結、生殖器、胃、腸和腦等。豚鼠從肺、肺門淋巴結、肝、脾、接種局部皮膚、左右側蹊部淋巴結、腸系膜淋巴結等部位取材。小鼠從接種局部皮膚取材。將上述選取的組織塊固定于4%中性甲醛液中,常規病理制片,HE染色,病理組織學觀察和顯微照相。
2 結果與分析
2.1 豚鼠大體剖檢
空白對照組豚鼠體表和各臟器組織均未見異常。BCG組有4只豚鼠(4/6)接種局部皮膚可見膿瘍,HBV-BCG聯合疫苗組有3只豚鼠(3/6)接種局部皮膚可見膿瘍,BCG組和HBV-BCG聯合疫苗組大體剖檢各臟器組織經肉眼檢查均未見明顯異常及差異,也未見結核性病灶。
2.2 豚鼠病理組織學觀察
2.2.1 空白對照組 肺、肺門淋巴結、肝、脾、左右側鼠蹊部皮膚、左右側鼠蹊部淋巴結及腸系膜淋巴結等臟器組織結構均未見異常。
2.2.2 BCG組與HBV-BCG聯合疫苗組 其接種疫苗局部及各臟器的病理改變相似,未見明顯差異,故合并描述。
①接種局部皮膚:主要表現以增生為主的炎癥改變,形成以巨噬細胞和類上皮細胞增生為主的肉芽腫。在接種局部的真皮層、皮下組織乃至肌層,可見大量密集的巨噬細胞及多少不等的類上皮細胞增生,形成特征性肉芽腫,在肉芽腫內可散在多少不等的嗜中性粒細胞、單核細胞及淋巴細胞浸潤。肉芽腫的周邊部也見上述相同的炎性細胞浸潤及大量纖維組織增生包繞。在上述巨噬細胞、類上皮細胞肉芽腫內可見由嗜中性粒細胞形成的小膿腫;或者由郎罕氏巨細胞、巨噬細胞及類上皮細胞構成的小肉芽腫(圖1)。上述肉芽腫內未見干酪樣壞死,或者轉向惡性化的結核性病變。在上述肉芽腫表面的表皮可呈現局灶性增生,或者壞死脫落形成局灶性小潰瘍,潰瘍邊緣表皮增生明顯。
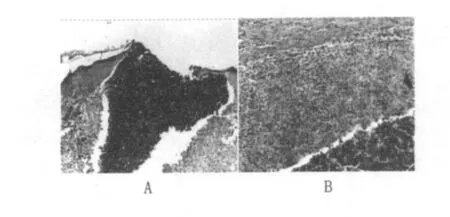
圖1 豚鼠皮膚肉芽腫(HE×50)Fig.1 Guinea pig skin granuloma
②左、右側蹊部淋巴結:淋巴結皮質內可見多少不等巨噬細胞增生,有的形成以巨噬細胞為主的肉芽腫,肉芽腫內可見郎罕氏巨細胞(圖2)。有的巨噬細胞肉芽腫可互相融合形成大片肉芽腫。除上述之外,皮質內的淋巴濾泡有不同程度增生,生發中心活躍、擴大,尤其副皮質區T淋巴細胞增生明顯,使副皮質區增寬。

圖2 豚鼠蹊部淋巴結皮質肉芽腫(HE×50)Fig.2 Guinea pig lymph node granuloma
③肺門淋巴結和腸系膜淋巴結:皮質內的淋巴濾泡及副皮質區也見與蹊部淋巴結相似的改變,但改變程度輕于后者。皮質內巨噬細胞輕度增生(圖3)。
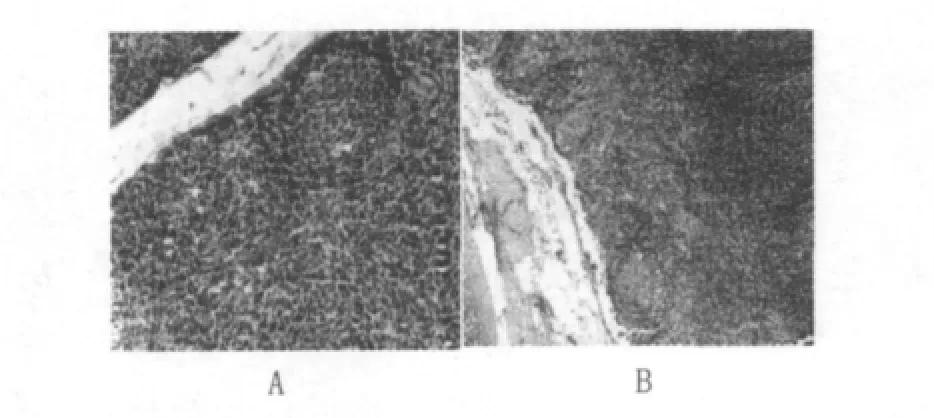
圖3 豚鼠肺門淋巴結皮質內巨噬細胞輕度增生(HE×50)Fig.3 Guinea pig pulmonary hilar lymph node cortex in mild hyperplasia macrophage
④其他臟器改變:肺內可見非特異性局限性慢性炎癥細胞浸潤,這種改變也見于對照組豚鼠,故它與疫苗的相關性尚不清楚;肝、脾及其余各臟器均未見與疫苗相關的病理改變。
2.3 小鼠大體剖檢
對照組小鼠體表和各臟器組織均未見異常。BCG組有1只小鼠(1/27)接種局部皮膚可見膿瘍,其余小鼠體表均未見異常;HBV-BCG聯合疫苗組有6只小鼠(6/27)接種局部皮膚可見膿瘍,其余小鼠體表均未見異常;BCG免疫組和HBVBCG聯合疫苗組小鼠各臟器組織未見明顯異常及差異,均未見結核性病灶。
2.4 小鼠病理組織學觀察
2.4.1 對照組 6只小鼠接種局部皮膚組織均未見異常。
2.4.2 BCG組及 HBV-BCG聯合疫苗組 該2組在接種局部皮膚的病變相似,故合并描述。
①早期局部皮膚病變(接種BCG、HBV-BCG聯合疫苗3~9 d):真皮層、皮下組織及肌層均呈現明顯非特異性炎癥反應,表現以嗜中性粒細胞和單核細胞為主炎性細胞浸潤,其間尚見嗜中性粒細胞性小膿腫形成,此種非特異性炎癥反應在7 d以后逐漸吸收,趨向減弱。此期有部分小鼠表皮、真皮層乃至皮下組織可見局灶性壞死,壞死的表皮或真皮淺層脫失形成潰瘍,潰瘍面可見膿性滲出物;潰瘍邊緣的表皮增生(圖4)。
②中期局部皮膚病變(接種BCG、HBV-BCG聯合疫苗11~25 d):真皮層、皮下組織及肌層的非特異性炎癥逐漸被吸收減輕,病灶趨于局限化。此期在接種局部皮膚表現以增生為主的病變,形成特異性巨噬細胞及類上皮細胞肉芽腫。在真皮層、皮下組織及肌層可見成片的巨噬細胞及類上皮細胞增生,形成類上皮細胞肉芽腫,在類上皮細胞肉芽腫中散在較多中性粒細胞及多少不等的單核細胞和淋巴細胞浸潤(圖5)。
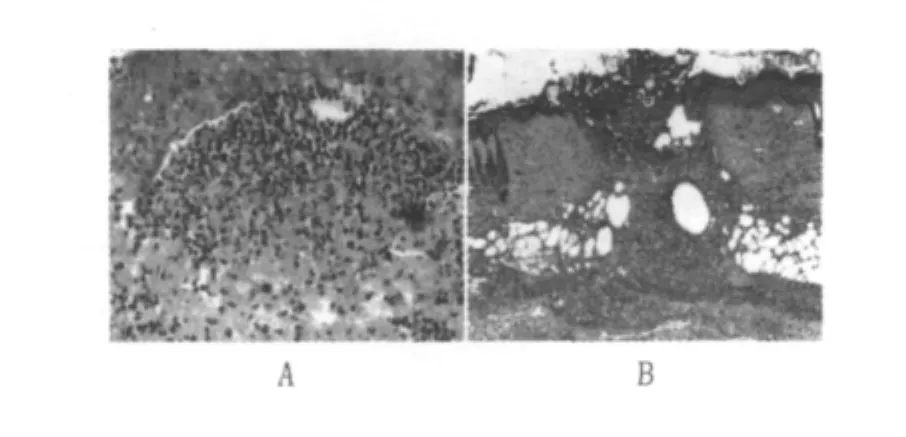
圖4 小鼠皮膚非特異性炎癥(5 d)(HE×50)Fig.4 Non-specific inflammation of mouse skin
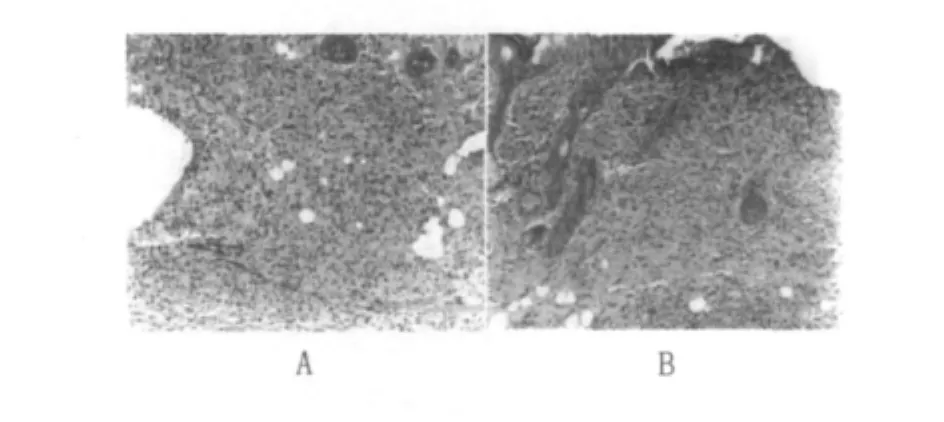
圖5 小鼠皮膚特異性類上皮細胞肉芽腫(20 d)(HE×50)Fig.5 Specific epithelioid cell granuloma of mouse
③中期末局部皮膚病變(接種BCG、HBVBCG聯合疫苗30 d):類上皮細胞肉芽腫內炎性細胞浸潤明顯消退,肉芽腫的范圍也明顯縮小(圖6)。

圖6 小鼠皮膚肉芽腫內炎性細胞浸潤明顯消退(30 d)(HE×50)Fig.6 Mouse skin within the granulomatous inflammatory cell infiltration obviously extinction
3 討論
由試驗結果證實,空白對照組豚鼠及小鼠局部皮膚組織皆未見異常。豚鼠全身各臟器也未見異常。與空白對照組相比,BCG組和HBV-BCG聯合疫苗組豚鼠及小鼠,在接種局部皮膚均發生非特異性炎癥反應,以及由BCG引起的特異性巨噬細胞類上皮細胞肉芽腫。并且豚鼠局部淋巴結也見上述改變。
BCG組和HBV-BCG聯合疫苗組,該2組在接種局部皮膚及局部淋巴結的病變完全相似,未見明顯差異。在接種局部皮膚真皮層、皮下組織及更深層部位可見以巨噬細胞、類上皮細胞或者朗罕氏巨噬細胞增生形成肉芽腫。在該肉芽腫內可見多少不等的嗜中性粒細胞、單核細胞及淋巴細胞浸潤,以及由嗜中性粒細胞形成的小膿腫。在上述肉芽腫內均未見干酪樣壞死或者轉向惡性化的結核性病變。在肉芽腫表面可見表皮呈現局灶性增生或壞死形成局灶性潰瘍;肺門和腸系膜淋巴結皮質內的淋巴濾泡及副皮質區也見與接種局部淋巴結相似的改變,但改變程度輕于后者;肺內可見非特異性局限性慢性炎癥細胞浸潤(這種改變也見于對照組豚鼠);肝、脾及其余各臟器均未見與疫苗相關的病理改變。
BCG組和HBV-BCG聯合疫苗組小鼠,該2組接種局部皮膚的病理改變相似,未見明顯差異。即在接種疫苗的早期(3~9 d),接種局部皮膚產生非特異性炎癥,在真皮深層、皮下組織及肌層表現嗜中性粒細胞和單核細胞浸潤,部分小鼠可見嗜中性粒細胞性小膿腫形成及局灶性表皮壞死潰瘍等改變;中期(11~25 d)接種局部皮膚表現以增生為主的特異性類上皮細胞肉芽腫形成;中期末(30 d)類上皮細胞肉芽腫內炎性細胞浸潤明顯消退,肉芽腫的范圍也明顯縮小。肉芽腫中心均未見干酪樣壞死,或轉向惡性化的結核性病變。這與Wilson Mayrink等[3]以卡介苗為佐劑給狗接種利什曼蟲疫苗的結果類似。
BCG接種人體也會產生接種局部化膿性反應,此為卡介苗正常的接種反應,當皮內接種時形成的潰瘍較淺,膿液容易排除體外,不會形成深部膿瘍,當接種誤入皮下或深處,膿液受皮膚阻攔,不易排出,會形成深部膿瘍。人體接種卡介苗后2周左右局部出現紅腫浸潤,可隨后化膿形成小潰瘍,一般8 ~12周結痂[4]。
BCG或HBV-BCG聯合疫苗免疫豚鼠及小鼠,在局部皮膚,以及豚鼠蹊部、肺門和腸系膜淋巴結所產生的病理改變,符合BCG引起的病變特點,具有BCG原發性病變特征。與結核性病變有本質區別。均未見干酪樣壞死或轉向惡性化的結核性病變[5-7]。
病理結果證實,HBsAg沒有使BCG引起的良性免疫病理反應,演變為惡性化的結核性病變。說明HBsAg不具有促使BCG毒力增強的潛在危險,證實HBV-BCG聯合疫苗與對照單價BCG相同具有可靠的安全性。
[1]崔玉梅,白新卿,裴曉春,等.卡介苗優化乙型肝炎疫苗、白百破三聯疫苗的免疫應答作用[J].中國生物制品雜志,1994,7(2):80-81.
[2]金立杰,趙小琳,方艷秋,等.乙型肝炎疫苗-卡介苗聯合疫苗細胞免疫的研究[J].中國生物制品雜志,2006,19(2):171-173.
[3]Mayrink W,Genaro O,Silva JC,et al.Phase I and II Open Clinical Trials of a Vaccine Against Leishmania chagasi Infection in Dogs[J].Mem Inst Oswaldo Cruz,1996,91(6):695-697.
[4]盧錦漢,章以浩,趙鎧,等.醫學生物制品學[M].北京:人民衛生出版社,1995:386-405.
[5]王志,于愛東,王春鵬,等.致敏豚鼠接種卡介苗后的臨床反應及病理變化[J].中國生物制品學雜志,2000,13(3):183-184.
[6]Murray EH,John MK,Alan JH.Mycobacterial infections of animals:pathology and pathogenesis[J].Laboratory Animal Science,1995,45(4):334-351.
[7]國家藥典委員會.中華人民共和國藥典二部(2005版)[S].北京:化學工業出版社,2005:49-50.

