碳熱還原法制備納米碳化鉻粉末及其特性表征
趙志偉,彭泳丙,袁海英,郝春艷,馬建強,劉亞培,張靜文
(河南工業大學 材料科學與工程學院,鄭州 450001)
碳熱還原法制備納米碳化鉻粉末及其特性表征
趙志偉,彭泳丙,袁海英,郝春艷,馬建強,劉亞培,張靜文
(河南工業大學 材料科學與工程學院,鄭州 450001)
以納米Cr2O3和納米碳黑為原料,采用碳熱還原法制備納米碳化鉻(Cr3C2)粉末。采用XRD、SEM和TEM等測試手段對反應產物進行表征。結果表明:當碳含量為28%(質量分數)、反應溫度為1 100 ℃及保溫時間為1 h時,反應產物為單一的Cr3C2,平均晶粒尺寸為25.6 nm;反應產物分散較好且顆粒呈球形或類球形,無明顯團聚現象,顆粒尺寸在30 nm左右;試樣表面主要由Cr、C和O這3種元素組成,O 1s譜主要包括3個峰(Oa, Oh和Od),分別對應于O?、OH?和Cr2O3;C 1s譜主要包含4個峰(Cf, Cc, Cd和Ce),分別對應污染碳、碳化鉻(Cr3C2)及其他類型的碳化鉻Cr3C2?x(0≤x≤0.5)。
碳化鉻;納米粉末;碳熱還原;相組成;微觀結構
Preparation and characterization of chromium carbide nanopowders produced by carbon thermal reduction
ZHAO Zhi-wei, PENG Yong-bing, YUAN Hai-ying, HAO Chun-yan,MA Jian-qiang, LIU Ya-pei, ZHANG Jing-wen
(College of Materials Science and Engineering, Henan University of Technology, Zhengzhou 450001, China)
Abstract:The carbon thermal reduction method was used to synthesize chromium carbide (Cr3C2) nanopowders using nanometer Cr2O3and nanometer carbon black as raw materials. The products were characterized by XRD, SEM and TEM.The results show that the powders with the single phase of Cr3C2can be synthesized under the conditions of 28% C (mass fraction), 1 100℃, 1 h, and the average crystallite size is 25.6 nm. The powders show good dispersion and are mainly composed of spherical or near-spherical particles with a mean diameter of about 30 nm, and they have no obvious agglomerating phenomenon. The surface of the specimen mainly consists of Cr, C and O three species elements. The XPS spectrum of O 1s mainly consists of three peaks (Oa, Oh and Od), which are considered to be due to O?, OH?and Cr2O3,separately. The spectrum of C1s mainly contains four peaks (Cf, Cc, Cd and Ce), which are ascribed to the contaminated carbon, Cr3C2and other chromium carbides (Cr3C2?x, 0≤x≤0.5), separately.
Key words:chromium carbide; nanopowder; carbon thermal reduction; phase composition; microstructure
過渡金屬碳化物具有較高的熔點[1]、硬度和高溫強度[2?3],同時具有良好的導電和導熱性能[4]。這些優異的性能確保了它們在冶金、電子、催化劑和高溫涂層材料等方面的廣泛應用[5?7],尤其是碳化鉻具有較高的強度、硬度和優異耐腐蝕等特性。因此,碳化鉻被廣泛應用于生產軸承、密封材料、高溫窯爐、噴嘴和金屬加工模具等[8]。
碳化鉻粉末的制備通常采用微米級Cr2O3與固體碳混合碳化而成,由于原料粉末粒度較粗,因此,碳化溫度較高(≥1 400 ℃)、碳化時間較長(≥4 h),合成的碳化鉻粉末一般為微米級,難以滿足現代工業需求,現代工業迫切需求超細納米級碳化鉻粉末。
目前,已有各種各樣合成碳化物粉末的方法,包括直接元素反應法[9]、機械合金化法[10?11]、程序升溫反應法[12]和氣相還原碳化法[13]。但是,這些方法在工業應用中受到了限制,主要由于團聚問題[10?11]、粒徑分布較寬[9]、產量低[10?11]、監控復雜[12]和成本高[13]。
目前,尚未見采用納米Cr2O3和納米碳黑為原料合成納米碳化鉻(Cr3C2)的相關報道。為此,本文作者從改善材料的反應動力學入手,以納米 Cr2O3和納米碳黑為原料,采用碳熱還原法制備納米碳化鉻粉末。并對用碳熱還原法合成的納米碳化鉻(Cr3C2)粉末的物相組成和微觀結構進行研究。
1 實驗
1.1 材料制備
以納米Cr2O3(平均粒度<60 nm)和納米碳黑(平均粒度<50 nm)為原料,按一定配比(納米碳黑的質量分數為28%)置于球磨罐中,加入無水乙醇及一定比例的硬質合金球,球磨時間為2~12 h。球磨結束后,將混合料在干燥箱中干燥 0.5~6 h,干燥溫度為90~150℃。將干燥物料置于高溫反應爐中,在真空條件及一定溫度下碳化得到納米碳化鉻粉末。為探索最佳合成工藝,以反應溫度(900、1 000和1 100 ℃)、反應時間(0.5、1和1.5 h)和配碳量(26%、28%和30%,質量分數)為因素和水平,進行正交實驗。
1.2 分析方法
采用Philiphs公司生產的X′PERT型X射線衍射儀對納米碳化鉻進行物相分析,Cu靶,Kα為輻射源,λ=0.1540 6 nm,管電流40 mA,管電壓40 kV,掃描速度0.017 (o)/s,2θ=15°~85°。
粉體的平均晶粒尺寸采用Scherrer公式進行計算[14]:

式中:D為晶粒尺寸;λ是入射線 Kα的波長,取0.154 06 nm;θ為布拉格衍射角;k為常數,取0.9;β為XRD衍射線的半高寬。
采用日本 JSM?6700F型掃描電鏡(SEM)和JEM?1000CX型透射電鏡(TEM)對產物的微觀形貌進行觀察;采用XSAM 800 (Kratos, England)型X射線光電子能譜儀測試樣品的表面元素組成及其化學狀態。X射線源采用Mg靶,Kα(hν=1 253.6 eV),靶功率144 kV;成分分析采用固定通過能模式,通過能為167.90 eV;價態分析中的通過能為 29.35 eV,采用污染C1s(Eb=284.62 eV)作荷電校正標準。
2 結果與討論
2.1 物相分析
圖1所示為 1 100 ℃、1 h條件下反應產物的XRD譜。由圖1可見,在該條件下,反應產物為單一的Cr3C2。這說明,該反應條件下,納米Cr2O3與納米碳黑反應較充分,且碳化還原為 Cr3C2。相對其他制備方法[9,12],本反應具有較低的合成溫度和較短的反應時間,這主要是由于原料粉末粒度對化學固?固和固?氣反應的反應速率和反應產物粒度都有較大影響,在利用碳熱還原法制備碳化鉻粉末的過程中,原料鉻源和碳源的顆粒越小,比表面積越大,它們之間的接觸面積就越大,這樣可以加速碳熱反應的進行,因此,可以降低反應溫度、縮短反應時間。
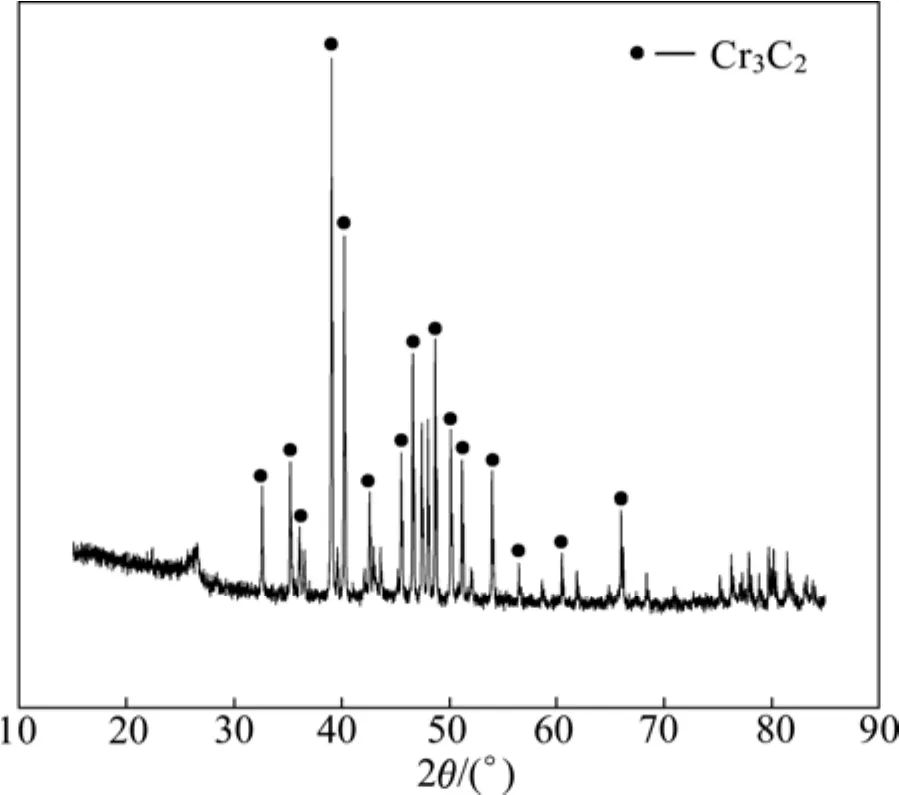
圖1 1 100 ℃、1 h條件下反應產物的XRD譜Fig.1 XRD pattern of powders heat-treated at 1 100 ℃ for 1 h
Cr2O3(JCPDS 38?1479)為密排六方結構,晶格常數為a=0. 495 9 nm,b=0. 495 9 nm,c=1. 359 4 nm。隨著反應溫度的升高,Cr2O3和碳黑發生氧化還原反應,生成Cr3C2。
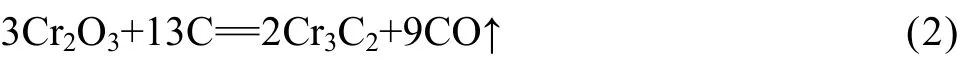
與 V8C7一樣,Cr3C2也屬于非化學計量比碳化物[15?16]。Cr3C2(JCPDS 35?0804)為正交晶系結構,具有規則的碳缺位,晶格常數為 a=0.552 7 nm,b=1.148 8 nm,c=10.282 9 nm。當Cr2O3轉變成Cr3C2時,其晶體結構由密排六方轉變為正交晶系。但是,在轉變過程中,Cr2O3可能先轉變為亞穩相 Cr3C2?x(0≤x≤0.5),再進一步轉變為 Cr3C2,相轉變順序為
根據謝樂公式計算得到1 100 ℃、1 h條件下反應產物的晶粒平均尺寸為25.6 nm。
2.2 微觀形貌分析
圖2所示為 1 100 ℃、1 h條件下反應產物的SEM像。由圖2可見,在該條件下,顆粒基本呈球形或類球形,顆粒尺寸在50 nm左右,無明顯團聚現象。這主要是由于反應產物中大部分顆粒為單一的Cr3C2,Cr2O3及Cr2O3向Cr3C2轉化的中間產物的含量較低,因此,顆粒形貌的均勻性較高,且顆粒尺寸較小。

圖2 1100 ℃、1 h條件下反應產物的SEM像Fig.2 SEM image of powders heat-treated at 1 100 ℃ for 1 h
為了更加直觀地確定反應產物的微觀形貌及顆粒尺寸,對1 100 ℃、1 h條件下的反應產物進行TEM觀察,結果如圖3所示。由圖3可見,粉末分散性良好,且主要由尺寸為30 nm左右的球形顆粒組成。該結果與 XRD的測試結果一致。且相對于直接元素反應法[9]和機械合金化法[10?11]制備的納米碳化鉻粉末,本方法合成的反應產物具有顆粒尺寸更加均勻、形貌更加規則及分散性更好等特點。

圖3 1100 ℃、1 h條件下反應產物的TEM像Fig.3 TEM image of powders heat-treated at 1 100 ℃ for 1 h
2.3 光電子能譜分析
為了確定元素組成和結合狀態,采用XPS測試手段對1 100 ℃、1 h條件下的產物進行測試,結果如圖4~7所示。由圖4可見,試樣的表面主要由Cr、C和O 3種元素組成。O 1s的峰值介于528.0 和540.0 eV之間,范圍較寬,且O 1s峰不對稱。這說明氧不僅包含晶格氧(531.5 eV),而且至少包含羥基氧(OH?,532.2 eV),也有可能包含吸附氧(O?,533.0 eV)[17]。圖5所示為1 100 ℃、1 h條件下試樣的O 1s 能量區域XPS譜。由圖5可見,O 1s譜主要包括3個峰(Oa, Oh和Od)。其中,Oa(533.6 eV)和Oh(532.3 eV)分別對應于O?和OH?,這兩種氧主要來源于空氣,可以通過在一定溫度下干燥去除。Od(530.8 eV)對應于Cr2O3,說明沒有足夠的碳原子去除碳化鉻表面的氧原子或者保溫時間不充分。但是,由于這種鉻的氧化物含量很低,所以,在XRD譜沒有明顯體現(見圖1)。

圖4 1100 ℃、1 h條件下試樣的XPS譜Fig.4 XPS spectrum of sample obtained at 1 100 ℃ for 1 h
圖6所示為1 100 ℃、1 h條件下試樣的Cr 2p能量區域XPS譜。由圖6可見,Cr 2p譜主要由Cr 2p3/2和Cr 2p1/2兩個峰組成。Cr 2p3/2(576.8 eV)既不對應于Cr2O3的 Cr 2p3/2(577.5 eV),又不對應于 Cr3C2的Cr 2p3/2(575.3 eV),其結合能(576.8 eV)介于577.5 eV和 575.3 eV之間,這可能是由于 Cr2O3和 Cr3C2的Cr 2p3/2峰位較接近,發生了疊加,所以,XPS譜中只存在一個Cr 2p3/2峰。為此,對Cr 2p3/2和Cr 2p1/2能譜峰進行對應于Cr2O3和Cr3C2的分峰擬合,結果如圖7所示。其中,峰A(575.6 eV)和B(577.6 eV)分別對應于Cr3C2和Cr2O3的Cr 2p3/2。
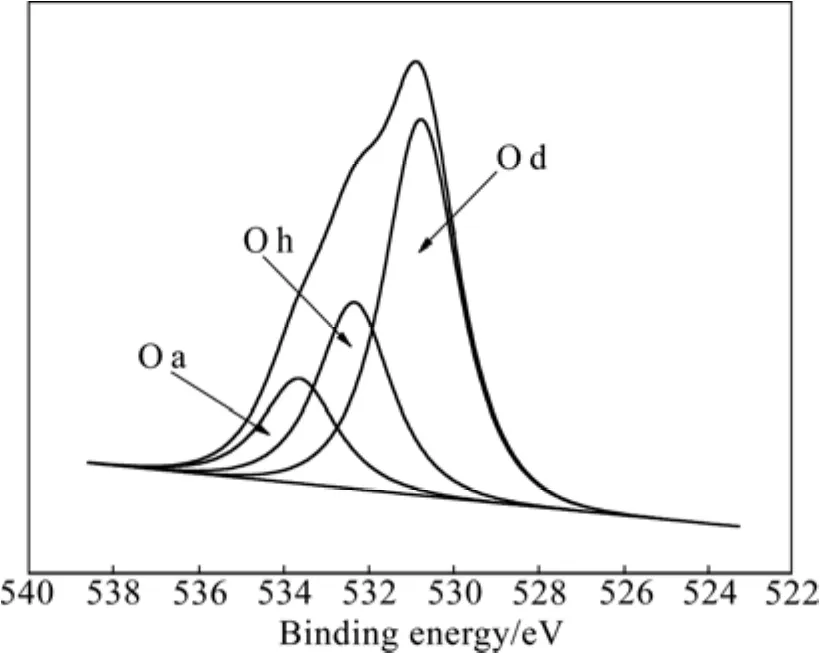
圖5 1100 ℃、1 h條件下試樣的O 1s能量區域XPS譜Fig.5 XPS spectrum of O 1s energy region for sample obtained at 1 100 ℃ for 1 h
圖6 1100 ℃、1 h條件下試樣的Cr 2p能量區域XPS譜Fig.6 XPS spectrum of Cr 2p energy region for sample obtained at 1 100 ℃ for 1 h
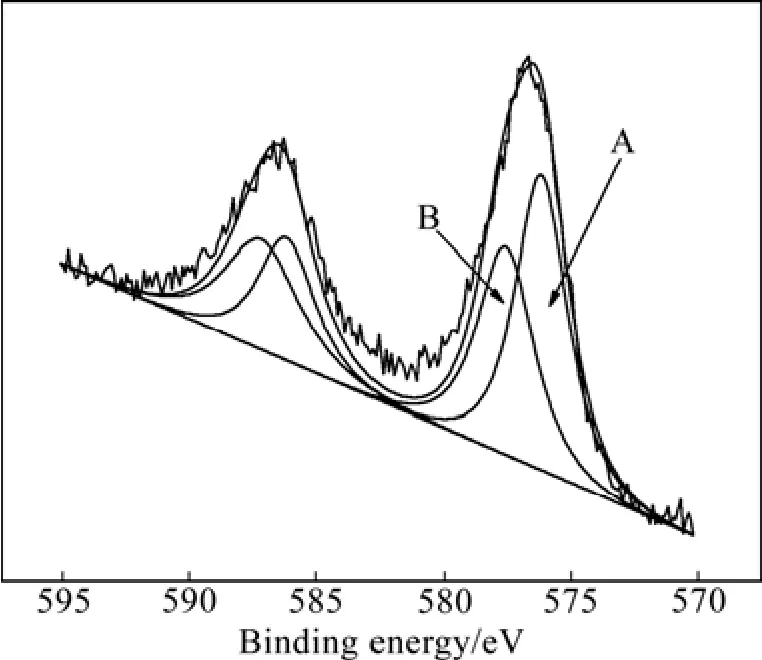
圖7 1100 ℃、1 h條件下試樣的Cr 2p能量區域XPS分峰擬合譜Fig.7 XPS fitting spectrum of Cr 2p energy region for sample obtained at 1 100 ℃ for 1 h
圖8所示為1 100 ℃、1 h條件下試樣的C 1s能量區域XPS譜。由圖8可見,C 1s譜主要由4個峰(Cf, Cc, Cd和 Ce)組成。其中,Cf(284.8 eV)對應于Cr3C2表面的污染碳;Cc(286.1 eV)對應于 Cr3C2,Cd(287.8 eV)和 Ce(289.5 eV)對應于其他類型的碳化鉻Cr3C2?x(0≤x≤0.5)。但這些其他類型的碳化鉻并未在XRD 中出現(見圖1),主要由于其含量較低,且其衍射峰峰位與Cr3C2的較接近。
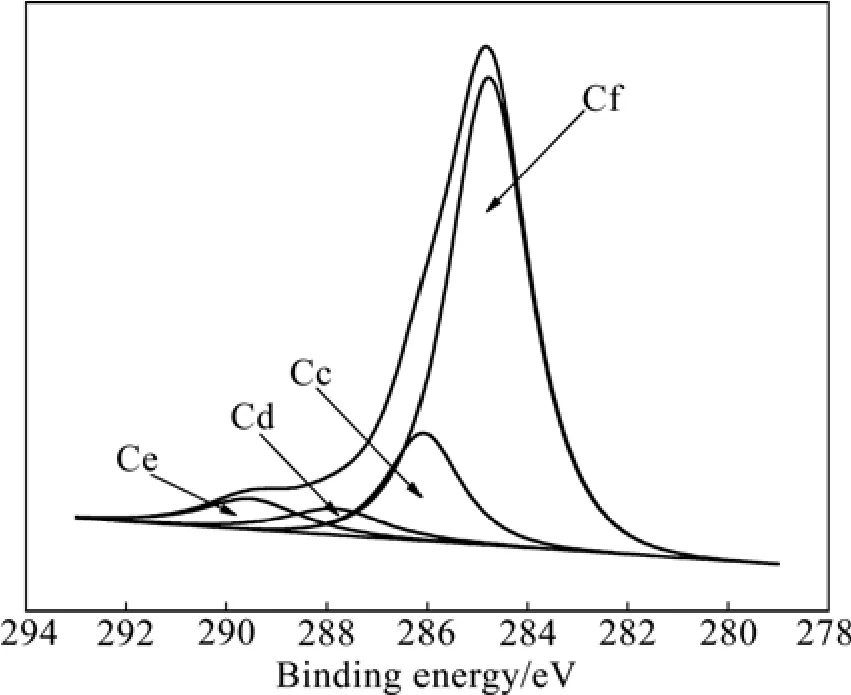
圖8 1100 ℃、1 h條件下試樣的C 1s能量區域XPS譜Fig.8 XPS spectrum of C 1s energy region for sample obtained at 1 100 ℃ for 1 h
3 結 論
1) 原料粒度對反應過程及反應產物的形貌具有重要影響,采用納米級原料,可以在較低的反應溫度和較短反應時間下合成碳化鉻納米材料。
2) 以納米Cr2O3和納米碳黑為原料,可在1 100℃、1 h條件下制備相組成單一的碳化鉻(Cr3C2),其平均晶粒尺寸為25.6 nm。反應產物的顆粒呈球形或類球形,無明顯團聚現象,顆粒尺寸在30 nm左右。
3) 試樣表面主要由Cr、C和O這3種元素組成。O主要來源于吸附氧、水和 Cr2O3,其中吸附氧和水可通過特定條件下的熱處理去除,少量Cr2O3可通過優化相關工藝進行調整。
REFERENCES
[1] SUN L, YANG T E, JIA C C, XIONG J. VC, Cr3C2doped ultrafine WC-Co cemented carbides prepared by spark plasma sintering [J]. International Journal of Refractory Metals and Hard Materials, 2011, 29(2): 147?152.
[2] 顏練武, 吳恩熙. 超細V8C7和Cr3C2粉末的制備方法[J]. 硬質合金, 2004, 21(4): 244?248.YAN Lian-wu, WU En-xi. The ways of preparing ultrafine V8C7and Cr3C2powder[J]. Cemented Carbide, 2004, 21(4): 244?248.
[3] KIM B I, LEE S, GUENARD R, FERNANDEZ TORRES L C,PERRY S S. Chemical modification of the interfacial frictional properties of vanadium carbide through ethanol adsorption[J].Surface Science, 2001, 481(1/3): 185?197.
[4] 吳恩熙, 顏練武, 錢崇梁. 納米V8C7粉末的制備[J]. 中南大學學報: 自然科學版, 2005, 36(5): 771?775.WU En-xi, YAN Lian-wu, QIAN Chong-liang. Preparation of nanometer V8C7powder [J]. Journal of Central South University:Science and Technology, 2005, 36(5): 771?775.
[5] REICHL W, HAYEK K. The vanadium subsurface alloy on polycrystalline rhodium: Formation and catalytic properties [J].Journal of Catalysis, 2004, 222(1): 53?64.
[6] OU X Q, SONG M, SHEN T T, XIAO D H, HE Y H.Fabrication and mechanical properties of ultrafine grained WC-10Co-0.45Cr3C2-0.25VC alloys [J]. International Journal of Refractory Metals and Hard Materials, 2011, 29(2): 260?267.
[7] 趙海鋒, 朱麗慧, 黃清偉. 放電等離子技術快速燒結納米WC-10%Co-0.8%VC硬質合金[J]. 稀有金屬材料與工程, 2005,34(1): 82?85.ZHAO Hai-feng, ZHU Li-hui, HUANG Qing-wei. Nanocrystalline WC-10%Co-0.8%VC cemented carbides prepared by spark plasma sintering [J]. Rare Metal Materials and Engineering,2005, 34(1): 82?85.
[8] FU C T, LI A K, LAI C P, DUANN J R. High performance ceramic composites containing tungsten carbide reinforced chromium carbide matrix: US Patent, 5580833 [P]. 1994?12?03.
[9] SCHWARZKOPF P, KIEFFER P. Refractory hard metals [M].New York: MacMillan, 1953: 60?67.
[10] GOMARI S, SHARAFI S. Microstructural characterization of nanocrystalline chromium carbides synthesized by high energy ball milling [J]. Journal of Alloys and Compounds, 2010,490(1/2): 26?30.
[11] ZHANG B, LI Z Q. Synthesis of vanadium carbide by mechanical alloying [J]. Journal of Alloys and Compounds, 2005, 392(1/2):183?186.
[12] KAPOOR R, OYAMA S T. Synthesis of vanadium carbide by temperature programmed reaction [J]. Journal of Solid State Chemistry, 1995, 120(2): 320?326.
[13] REZA E K, HOSSEIN M Z, VAHID N. Synthesis of chromium carbide by reduction of chromium oxide with methane [J].International Journal of Refractory Metals and Hard Materials,2010, 28(3): 412?415.
[14] MATYI R J, SCHWARTZ L H, BUTT J B. Particle size, particle size distribution and related measurements of supported metal catalysts [J]. Catalysis Reviews—Science and Engineering, 1987,29(1): 41?99.
[15] NOWOTNY H, KIEFFER R. Roentgenographic examination of carbide systems [J]. Metallforschung, 1947, 9(2): 257?265.
[16] HENFREY A W, FENDER B E F. A neutron diffraction investigation of V8C7[J]. Acta Crystallographica, 1970, B26:1882?1883.
[17] LIAO S J, HUANG D G, YU D H. Preparation and characterization of ZnO/TiO2, SO42?/ZnO/TiO2photocatalyst and their photocatalysis[J]. Journal of Photochemistry and Photobiology A: Chemistry,2004, 168(1/2): 7?13.
(編輯 陳衛萍)
TF123
A
1004-0609(2012)07-2005-05
河南省教育廳自然科學研究計劃項目(2010B430009);鄭州市科技發展計劃項目(20110305);河南工業大學博士科研啟動基金(2009BS014)
2011-09-18;
2012-05-20
趙志偉,副教授,博士;電話:0371-67758734;E-mail:zzw3217@163.com

