CA125、CA199、CEA聯合檢測在卵巢癌診斷中的應用*
易 琳,黃學梅,劉 預,李雨聰,林一民,周 琦△
(重慶市腫瘤研究所:1.腫瘤學實驗室;2.臨檢中心;3.婦瘤科 400030)
卵巢癌是一種常見的女性生殖系統惡性腫瘤,發病率僅次于子宮頸癌和子宮體癌,而其病死率在婦科惡性腫瘤中位居首位[1-2]。由于卵巢癌初期癥狀不明顯,并缺乏成熟的早期診斷方法,70%的患者確診時病情已發展到中晚期,5年生存率僅為30%[3]。因此,提高卵巢癌早期診斷水平,探索良好的早期診斷指標具有重要意義。血清CA125是目前臨床上應用最廣泛的卵巢癌診斷和病情監測指標[4-6]。但鑒于單項標志物檢測的局限性,近年來,理論上和實踐上都提倡針對不同腫瘤,選擇相關的標志物進行聯合檢測。目前,卵巢癌的最佳腫瘤標志物組合臨床尚無定論。本文通過聯合檢測卵巢癌患者血清中CA125、CA199和CEA的水平,探討該聯合檢測模式在卵巢癌篩查和早期診斷中的臨床價值,現報道如下。
1 資料與方法
1.1 一般資料 卵巢癌組72例,為2007年1月至2011年6月本院經手術或病理檢查確診的患者,年齡16~75歲,平均年齡50歲。按FIGO臨床分期標準,其中Ⅰ期患者11例,Ⅱ期患者15例,Ⅲ期患者34例,Ⅳ期患者12例。婦科良性疾病組51例,年齡21~81歲,平均年齡44.9歲。其中卵巢良性腫瘤34例,子宮肌瘤12例,子宮內膜異位癥2例,附件囊腫2例,成熟性畸胎瘤1例。正常對照組60例,均系健康女性體檢者。
1.2 儀器和試劑 Architect i2000全自動化學發光免疫分析儀和專用配套試劑,美國雅培公司。
1.3 檢測方法 采集靜脈血2mL,化學發光微粒子免疫分析技術,檢測過程嚴格按儀器操作規程進行。
1.4 檢測指標和結果判斷 參考區間:CA125<35U/mL,CA199<37U/mL,CEA<5ng/mL。檢測指標超過參考區間為陽性,聯合檢測以其中任何一項指標高于參考區間為陽性。
1.5 統計學處理 采用SPSS17.0統計軟件進行統計學處理。計量資料的實驗數據經正態性檢驗,數據呈非正態分布,用中位數(四分位數間距)表示,各組之間比較用 Mann-Whitney U檢驗(非參數檢驗)。組間計數資料的比較采用χ2檢驗,以P<0.05為差異有統計學意義。診斷效能評價指標以敏感性、特異性、陽性預測值、陰性預測值表示。
2 結 果
2.1 CA125、CA199、CEA檢測結果比較 卵巢癌組、婦科良性疾病組和正常對照組CA125、CA199、CEA檢測結果見表1。卵巢癌組的CA125、CA199和CEA的含量明顯高于正常對照組,二者比較差異有統計學意義(P<0.05);卵巢癌組的CA125、CA199的含量明顯高于婦科良性病組,兩者比較差異有統計學意義(P<0.05),但卵巢癌組的CEA含量與婦科良性病組比較差異無統計學意義(P>0.05);婦科良性疾病組的CA125含量顯著高于正常對照組,二者比較差異有統計學意義(P<0.05),但婦科良性疾病組的CA199、CEA含量與正常對照組比較差異無統計學意義(P>0.05)。
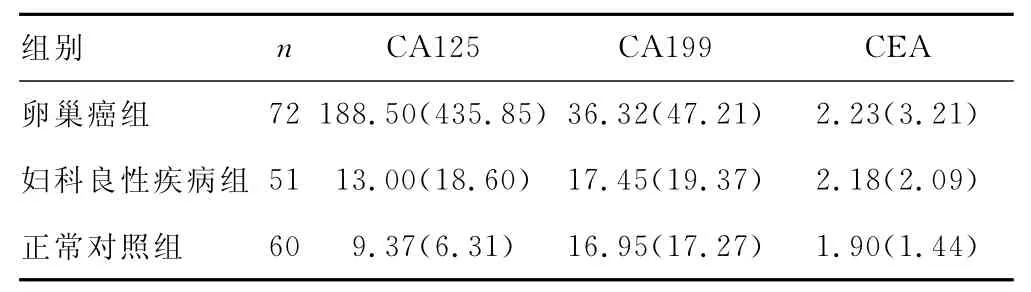
表1 卵巢癌組、婦科良性疾病組和正常對照組CA125、CA199、CEA檢測結果[n(%)]
2.2 CA125、CA199、CEA單項檢測及聯合檢測的陽性率比較 卵巢癌組、婦科良性疾病組和正常對照組CA125、CA199、CEA單項檢測及聯合檢測的陽性率比較見表2。卵巢癌組CA125、CA199、CEA單項檢測的陽性率均明顯高于正常對照組和婦科良性疾病組,其差異有統計學意義(χ2分別為83.25、39.79、23.69,P<0.05);卵巢癌組中,單項檢測的陽性率從高到低 依 次 為:CA125(75.00%)、CA199(45.83%)、CEA(22.22%),CA125、CA199、CEA 聯 合 檢 測 的 陽 性 率 為88.89%,顯著高于單項檢測(χ2分別為4.69、30.35、64.80,P<0.05)。

表2 卵巢癌組、婦科良性疾病組和正常對照組CA125、CA199、CEA單項檢測及聯合檢測的陽性率[n(%)]
2.3 CA125、CA199、CEA單項檢測及聯合檢測對卵巢癌的診斷性能評價 由表3可見,單項腫瘤標志物中,CA125的敏感性最高,CEA的特異性最好。綜合評價各性能指標,CA125的敏感性75.00%,特異性90.09%,陽性預測值83.08%,陰性預測值84.75%,是最佳的卵巢癌單項診斷指標。與CA125單項指標相比較,CA125、CA199和CEA 3項聯合檢測的敏感性由75.00%提高到88.89%,陽性預測值由83.08%提高到83.12%,陰性預測值由84.75%提高到92.45%,特異性略有下降,由90.09%降至88.29%,各項性能指標更趨于平衡。

表3 CA125、CA199、CEA單項檢測及聯合檢測對卵巢癌的診斷性能評價(%)
2.4 卵巢癌不同臨床分期CA125、CA199、CEA單項檢測及聯合檢測的陽性率比較 由表4可見,從橫向看,單項腫瘤標志物中,除Ⅰ期外,其余臨床各期卵巢癌患者CA125檢測的陽性率均高于CA199和CEA,而CA125、CA199、CEA聯合檢測各期卵巢癌患者的陽性率又高于任一單項腫瘤標志物檢測,聯合檢測明顯提高了Ⅰ、Ⅱ期卵巢癌患者診斷的陽性率。從縱向看,Ⅰ、Ⅱ期卵巢癌患者CA125單項檢測和CA125、CA199、CEA聯合檢測的陽性率均低于Ⅲ、Ⅳ期患者,CA125單項檢測卵巢癌的陽性率由Ⅰ、Ⅱ期的27.27%、46.67%上升到Ⅲ、Ⅳ期的94.12%、100%,差異有統計學意義(P<0.05);而 CA125、CA199、CEA聯合檢測卵巢癌的陽性率由Ⅰ、Ⅱ期的63.64%、80.00%上升到Ⅲ、Ⅳ期的97.06%、100%,差異有統計學意義(P<0.05)。
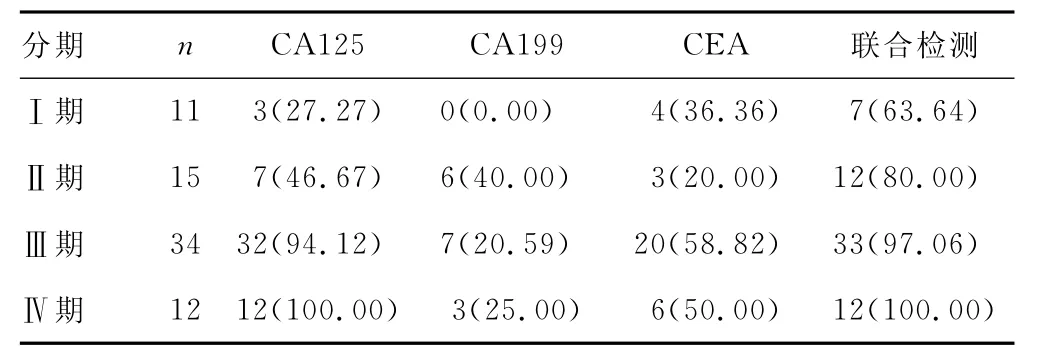
表4 卵巢癌不同臨床分期CA125、CA199、CEA單項檢測及聯合檢測的陽性率[n(%)]
3 討 論
腫瘤標志物在腫瘤的輔助診斷、病情監測和判斷預后等方面有著重要意義。但由于腫瘤細胞生物學特性的復雜性和多樣性,同一種腫瘤可產生一種或多種腫瘤標志物,而不同腫瘤或同一腫瘤的不同組織類型既可以產生相同的腫瘤標志物,也可以產生不同的腫瘤標志物,所以大部分單一腫瘤標志物檢測敏感性或特異性偏低,不能滿足臨床需要。因此,針對不同類型的腫瘤,組合不同的標志物進行多指標聯合檢測,對腫瘤的早診早治極為重要。因此,本研究選用CA125、CA199、CEA 3項標志組成標志群,探討該聯合檢測模式在卵巢癌篩查和早期診斷中的臨床價值。
血清CA125是目前研究和應用最為廣泛的卵巢癌腫瘤標志物,也是臨床上卵巢癌診斷和病情監測最常用的一種檢測指標[7-8]。但血清CA125在卵巢癌診斷中的應用一直存有爭議,這是由于CA125主要表達于漿液性卵巢癌,并且其水平高低與卵巢癌的臨床分期密切相關,中、晚期卵巢癌患者血清中CA125檢測的水平和陽性率較高,而早期患者CA125水平和陽性率不高[9]。此外,CA125在妊娠、非卵巢癌的一些惡性腫瘤(如子宮內膜癌、胰腺癌、肺癌、乳腺癌等)和一些婦科良性疾病(如良性卵巢腫瘤、子宮內膜異位癥、盆腔炎等)中也會出現不同程度的升高[10]。因此,單項CA125檢測在卵巢癌診斷中具有一定的局限性,必須聯合其他指標,以提高對卵巢癌的診斷效能。血清CA199最初來源于人結腸癌細胞株,臨床上多用作胰腺癌和肝膽管癌的腫瘤標志物[11]。有研究報道,CA199是診斷粘液性卵巢癌較為理想的指標[12-15]。血清CEA是一種廣譜的腫瘤標志物,由于該指標的非特異性,臨床上常與其他腫瘤標志物聯合應用。
本研究結果顯示:卵巢癌組CA125、CA199、CEA的陽性率明顯高于正常對照組和婦科良性疾病組,其差異有統計學意義(P<0.05),說明CA125、CA199、CEA 3項指標對卵巢癌的診斷具有較高的價值。單項指標中,CA125檢測卵巢癌的陽性率明顯高于其余指標,反映了CA125是卵巢癌診斷中極具價值的單項指標,與既往文獻報道基本相符[16-17]。與單項指標CA125相比較,CA125、CA199和CEA 3項聯合檢測卵巢癌的敏感性、陽性預測值、陰性預測值均較單項檢測明顯提高,并且各項性能指標更趨于平衡。這表明聯合檢測對卵巢癌的輔助診斷具有良好的臨床應用價值,CA125、CA199和CEA 3項組成的標志群是檢測卵巢癌較為理想的標志物組合。但值得注意的是,聯合檢測在提高診斷敏感性的同時,特異性略有下降,由90.09%降至88.29%。因此,應用CA125、CA199和CEA 3項聯合檢測卵巢癌時要注意假陽性問題,必要時要結合臨床癥狀和陰道彩超等其他檢查,做出正確診斷。
此外,本研究對72例卵巢癌患者的臨床分期情況也進行了統計。統計結果顯示:在診斷的敏感性方面,Ⅰ、Ⅱ期卵巢癌患者CA125單項檢測的陽性率明顯低于Ⅲ、Ⅳ期患者,差異有統計學意義(P<0.05)。這表明CA125檢測卵巢癌的陽性率與卵巢癌的臨床分期情況密切相關,CA125對早期卵巢癌診斷靈敏度欠佳,而對中晚期卵巢癌檢測的靈敏度相對較高。早期卵巢癌患者CEA、CA199的陽性率也明顯低于中晚期患者,特別是CEA在Ⅲ、Ⅳ期時陽性率較高。與單項指標CA125相比較,CA125、CA199、CEA 3項聯合后,測定Ⅰ、Ⅱ期卵巢癌的陽性率分別由27.27%上升為63.64%,由46.67%上升為80%,由此可見,聯合檢測可明顯提高Ⅰ、Ⅱ期卵巢癌患者診斷的陽性率,有利于卵巢癌的早期診斷。
綜上所述,CA125、CA199和CEA是檢測卵巢癌較為理想的標志物組合,3項聯合檢測可以互為補充,有效提高卵巢癌診斷的各項性能指標,對卵巢癌的早期診斷、早期治療具有重要價值,并且3項指標均為目前臨床常用的腫瘤標志物,檢測經濟、方便,該聯合檢測模式值得臨床實驗室推廣使用。
[1] Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[2] Gubbels J,Claussen N,Kapur AK,et al.The detection,treatment and biology of epithelial ovarian cancer[J].J O-varian Res,2010,3(8):1-11.
[3] 崔恒.卵巢癌的早期診斷[J].中國婦產科臨床雜志,2010,11(6):403-405.
[4] Ueda Y,Enomoto T,Kimura T,et al.Serum biomarkers for early detection of gynecologic cancers[J].Cancers,2010,2(2):1312-1327.
[5] Donach M,Yu Y,Artioli G,et al.Combined use of biomarkers for detection of ovarian cancer in high-risk women[J].Tumour Biol,2010,31(3):209-215.
[6] Yurkovetsky Z,Skates S,Lomakin A,et al.Development of a multimarker assay for early detection of ovarian cancer[J].J Clin Oncol,2010,28(13):2159-2166.
[7]Jacobs IJ,Menon U.Progress and challenges in screening for early detection of ovarian cancer[J].Mol Cell Proteomics,2004,3(4):355-366.
[8] Robertson DN,Pruysers E,Jobling T.Inhibin as a diagnostic marker for ovarian cancer[J].Cancer Letters,2007,249(1):14-17.
[9] Kolwijck E,Thomas CMG,Bulten J,et al.Preoperative CA-125levels in 123patients with borderline ovarian tumors:a retrospective analysis and review of the literature[J].Int J Gynecol Cancer,2009,19(8):1335-1338.
[10]Moore RG,MacLaughlan S,Bast Jr RC.Current state of biomarker development for clinical application in epithelial ovarian cancer[J].Gynecol Oncol,2010,116(2):240-245.
[11]Duffy M,Sturgeon C,Lamerz R,et al.Tumor markers in pancreatic cancer:a European Group on Tumor Markers(EGTM)status report[J].Ann Oncol,2010,21(3):441-447.
[12]朱明玥,陳帆.腫瘤相關糖類抗原 CA72-4、CA19-9和CA125聯合檢測對卵巢癌的診斷價值[J].新疆醫科大學學報,2011,34(1):66-69.
[13]Karaferic A,Jovanovic D,Jelic S.Expression of HER2/neu,estrogen and progesterone receptors,CA125and CA19-9on cancer cell membrane in patients with serous and mucinous carcinoma of the ovary[J].J Buon,2009,14(4):635-639.
[14]Kelly PJ,Archbold P,Price JH,et al.Serum CA19.9levels are commonly elevated in primary ovarian mucinous tumours but cannot be used to predict the histological subtype[J].J Clin Pathol,2010,63(2):169-173.
[15]商敏,郝增平,張潔文,等.卵巢腫瘤患者血清CA19-9水平升高的臨床意義[J].中國婦產科臨床雜志,2009,10(5):349-352.
[16]Yurkovetsky Z,Skates S,Lomakin A,et al.Development of a multimarker assay for early detection of ovarian cancer[J].J Clin Oncol,2010,28(13):2159-2166.
[17]Donach M,Yu Y,Artioli G,et al.Combined use of biomarkers for detection of ovarian cancer in high-risk women[J].Tumor Biol,2010,31(3):209-215.

