弓形蟲與瘧原蟲入侵引起宿主細胞骨架重組相關GTP酶不同定位的觀察*
陳艾媛,娜仁花,彭鴻娟,趙 亞
弓形蟲(Toxopl asma gondii)和瘧原蟲(Pl asmodiu m spp)的分類地位均屬于頂復門(Phyl u m Apico mplexa),孢子綱(Class Sporozoea),真球蟲目(Or der Eucoccidiida)[1]。頂復門原蟲都是通過與其質膜相連的肌動蛋白-肌球蛋白馬達,以主動入侵的方式侵入宿主細胞內,而不是被宿主細胞所攝取或吞噬[2]。兩種原蟲都以納蟲泡的形式在宿主細胞內寄生并增殖,但是弓形蟲、瘧原蟲與宿主細胞之間的相互作用大部分并不十分清楚,兩者入侵細胞及納蟲泡膜形成的過程也各有不同的特點。
細菌、病毒等病原入侵宿主細胞后都伴隨有宿主細胞骨架重組的過程[3]。頂復門的原蟲包括隱孢子蟲(Cr yptosporidiu m par vu m)、弓形蟲、瘧原蟲入侵宿主細胞后都有引發宿主細胞骨架重組的現象:隱孢子蟲感染宿主細胞時誘導宿主肌動蛋白網絡形成片狀結構,將蟲體與宿主細胞質分隔開來,從而形成一個細胞內胞質外的小室,并在小室中進行增殖[4];弓形蟲速殖子和伯氏瘧原蟲裂殖子入侵宿主細胞后在“運動連接(moving j unction)”處形成一個宿主細胞F-肌動蛋白環,因而推測弓形蟲與瘧原蟲的入侵過程需要宿主細胞肌動蛋白的極化[2];弓形蟲的入侵激活宿主細胞微管和微絲等細胞骨架元件的重組[5],而在感染的晚期,弓形蟲啟用宿主細胞的微管形成管道結構將宿主細胞器組分運輸到納蟲泡膜上[6];瘧原蟲感染紅細胞后,向紅細胞的胞質中分泌蟲體蛋白,調控紅細胞骨架的重組[7-9]。
Rho GTP酶屬于Ras超家族的成員,其分子量一般在20~30 k D。Ras家族成員眾多,在哺乳動物中至少由14個亞族組成,其中最具代表性的為Rho(Ras ho mologous member)、Rac (ras-related C3 bot ulinu m toxin sub-strate)和 Cdc42 (cell division cycle 42)3個亞族。Rho GTP酶廣泛地調節細胞功能,許多調節是通過控制肌動蛋白極性來實現的。Rho GTP酶家族調節肌動蛋白骨架,微管動力學,細胞極性和運動性,小泡運輸路徑以及細胞吸附、移動、增殖與生存[10-13]。在瘧原蟲入侵紅細胞時,Rac GTP酶是紅細胞骨架重組的動態調節因子[14]。肌動蛋白低聚體是紅細胞骨架重要的結構組成部分,Rac1和Rac2調節肌動蛋白結構,在造血細胞中有許多重疊的和獨特的功能[14]。Rho A被發現存在于紅細胞的胞質和膜上,而且高度親合性地結合于紅細胞膜的胞質面上[15]。而在弓形蟲入侵宿主細胞時,Rho GTP酶調控宿主細胞骨架的重組卻未見文獻報導。
為了解宿主細胞Rho GTP酶在弓形蟲與瘧原蟲這兩種原蟲入侵過程中對宿主細胞骨架重組所起的調控作用,本研究選取Rho GTP酶家族中的Rho A和Rac1作為靶標蛋白,利用細胞免疫熒光的方法來檢測弓形蟲和瘧原蟲入侵宿主細胞后,宿主細胞Rho GTP酶在細胞內的分布情況。
1 材料與方法
1.1 材料
1.1.1 細胞株、蟲株與實驗動物 人呼吸道上皮細胞16-HBE購自上海復祥生物技術有限公司。SPF級KM鼠(18~22 g雌性鼠)購于南方醫科大學實驗動物中心。弓形蟲RH株為本實驗室保存,接種于SPF級KM鼠腹腔中傳代。惡性瘧原蟲云南地理株由第四軍醫大學病原生物學教研室保存。
1.1.2 主要試劑 Trit on X-100、DAPI購于sigma公司;兔抗人Rac1和兔抗人Rho A單克隆抗體均購于 Cell Signaling公司;二抗 goat anti-rabbit Ig GFITC購于SANTA CRUZ公司。
1.2 實驗方法
1.2.1 細胞爬片及涂片的制備
1.2.1.1 16-HBE細胞爬片制備及弓形蟲感染放置4片蓋玻片于六孔板內其中四孔,將16-HBE細胞平均分到此四孔中,用DMEM+10%NBS培養基在37℃,5%CO2條件下培養至細胞覆蓋率達95%~100%,細胞長在蓋玻片上制備細胞爬片,方便下一步的免疫熒光實驗操作與觀察。從KM鼠腹腔中抽取弓形蟲RH株速殖子,3 000×g離心5 min后棄掉上清液,加入4 m L DMEM完全培養基重懸蟲體,混勻后均勻加入四孔16-HBE細胞爬片的培養孔中,37℃5%CO2培養箱中侵染2 h。吸掉細胞培養基上清,并用PBS洗滌細胞3次,洗去未侵染的弓形蟲速殖子。
1.2.1.2 惡性瘧原蟲體外同步化培養和血涂片制備 惡性瘧原蟲復蘇和傳代培養參照Trager等的方法[16]進行。簡述如下:以RPMI1640為基礎培養基,其中含有25 mmol/L HEPES,0.2%Na HCO和10%人血清,紅細胞壓積2%~5%,在5%CO2和37℃條件下培養。每天換液一次、每隔3天添加一次新鮮人紅細胞。選擇瘧原蟲環狀體較多的發育階段開始同步化培養,待瘧原蟲同步化至成熟裂殖體為主且出現部分早期環狀體階段時,吸取適量懸浮紅細胞,離心,留取適量上清,重懸紅細胞制作薄血片,同時制作正常紅細胞薄血片為陰性對照。血片自然晾干,4℃預冷無水乙醇固定10 min,冷風吹干,PAP筆劃分實驗區域待用。
1.2.2 細胞免疫熒光實驗 室溫條件下用多聚甲醛固定細胞爬片或紅細胞涂片10 min,PBS振蕩洗滌(5 min×3次),透化液(0.5%Tritonx-100,PBS稀釋)500μL覆蓋細胞后室溫靜置10 min。PBS振蕩洗滌(5 min×3次),封閉液(0.1%Triton X-100,用新生牛血清稀釋)500μL覆蓋細胞并在37℃下孵育1 h。棄去封閉液,加入500μL一抗(封閉液稀釋,稀釋度1∶500),37℃孵育3 h。棄一抗,PBS振蕩洗滌(5 min×3次)。加入500μL FITC標記的二抗 (封閉液稀釋,稀釋度1∶300)37℃條件下避光孵育1 h。在陰性對照實驗中,細胞不用一抗孵育,僅以FITC標記的二抗(封閉液稀釋,稀釋度1∶300)孵育。以下過程均在避光條件下進行,PBS振蕩洗滌(5 min×3次),10 n mol/L DAPI染色5 min,PBS振蕩洗滌(5 min×3次),用雙蒸水洗去玻片上的鹽分。將玻片避光置于濾紙上風干,封片并在熒光顯微鏡下觀察。
2 結 果
在熒光顯微鏡下用FITC濾光片觀察可見,經抗人Rac1和Rho A單抗及FITC標記的二抗孵育后的16-HBE細胞內,在弓形蟲納蟲泡膜上有熒光的豐度聚集(見圖1-A和圖1-C,黃色箭頭所示);陰性對照實驗中,只用FITC標記的二抗與16-HBE細胞內孵育,在弓形蟲納蟲泡膜上沒有熒光的豐度聚集(見圖1-E);而在未被侵染的16-HBE細胞中,只見Rho A和Rac1 GTP酶在細胞質中的均勻分布(見圖1-B和圖1-D)。該實驗結果表明在弓形蟲入侵宿主細胞后,出現了宿主細胞的Rho A和Rac1 GTP酶聚集在弓形蟲納蟲泡膜上的現象。然而,在用抗人Rac1和Rho A單抗孵育后的被惡性瘧原蟲侵染的紅細胞中,瘧原蟲納蟲泡上沒有看到熒光的聚集(見圖2-A和圖2-C,黃色箭頭所示);而在未被侵染的紅細胞中只見Rho A和Rac1 GTP酶在紅細胞中均勻分布(見圖2-B和圖2-D)。該實驗結果提示在被惡性瘧原蟲感染的紅細胞內的納蟲泡膜上未出現Rho A和Rac1 GTP酶聚集的現象。
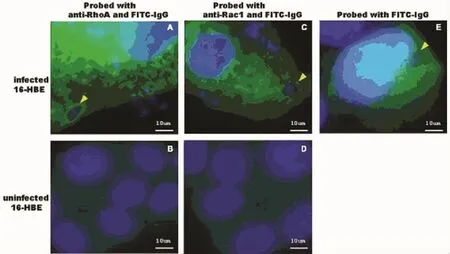
圖1 弓形蟲RH株速殖子侵染16-HBE細胞后抗Rho A、Rac1單抗免疫熒光檢測結果Fig.1 The immunofluorescence detection with anti-RhoA and anti-Rac1 mAb of 16-HBE cells infected with T.gondii RH tachyzoites
在綠色熒光顯微鏡下可見宿主細胞的Rho A和 Rac1 GTP酶在弓形蟲納蟲泡膜上的高豐度聚集(Fig 1-A,和 Fig 1-C,黃色箭頭所示),而在陰性對照實驗組中,當細胞只與FITC標記的Ig G二抗孵育時,熒光沒有在納蟲泡膜上聚集的現象(Fig 1-B,和 Fig 1-D)。
在綠色熒光顯微鏡下可見紅細胞的Rho A和Rac1 GTP酶在惡性瘧原蟲(包括環狀體、未成熟裂殖體和成熟裂殖體等階段)納蟲泡膜上均沒有聚集(Fig 2-A,和 Fig 2-C,黃色箭頭所示),而在未被侵染的紅細胞中只見Rho A和Rac1 GTP酶在紅細胞中均勻分布(Fig 2-B,和 Fig 2-D)。
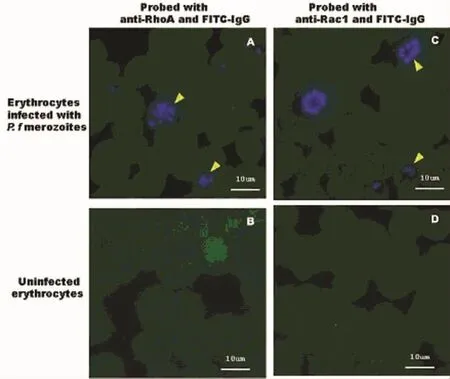
圖2 惡性瘧原蟲裂殖子侵染人紅細胞后抗Rho A、Rac1單抗免疫熒光檢測結果Fig.2 The i mmunofluorescence detection with anti-Rho A and anti-Rac1 mAb of human erythrocytes infected with Plasmodium f alcipar um mer ozoites
3 討 論
雖然弓形蟲與瘧原蟲均屬于頂復門的細胞內原蟲,并以納蟲泡的形式在宿主細胞內寄生并增殖,但是兩者入侵細胞及納蟲泡膜形成的過程卻各有不同的特點。弓形蟲對宿主細胞無特異的選擇性,幾乎可以感染所有的有核細胞。弓形蟲入侵宿主細胞的過程是主動入侵,弓形蟲以滑動的運動方式靠近宿主細胞膜,其類錐體緊密粘附于宿主細胞膜并向前推進,弓形蟲棒狀體與前端表膜融合后釋放調控蛋白誘導宿主細胞表面形成絲狀偽足和通道輔助其入侵,同時宿主細胞膜向內凹陷,蟲體通過類錐體端進入細胞[17]。入侵部位的宿主細胞膜形成環狀結構壓縮包圍蟲體,入侵完成后宿主細胞膜封閉,納蟲泡形成[18-20]。在與宿主細胞的吸附過程中,弓形蟲分泌的微粒體蛋白和棒狀體頸蛋白形成的運動連接(moving junction,MJ)[21-22]是弓形蟲吸附于宿主細胞的結構,且具有從納蟲泡膜中篩選宿主細胞膜組分的功能[23]。一些宿主細胞膜組分如與膜筏(membrane raft)、細胞骨架定位及分子多聚體形成相關的跨膜蛋白等,被迅速清除并在成熟的納蟲泡膜中消失,這些組分的排除可避免納蟲泡被內膜系統融合[24],但許多膜脂卻被保留下來。納蟲泡外表面還與宿主細胞的細胞器如線粒體、內質網緊密結合,這些細胞器的膜組分為納蟲泡的生長擴大提供膜組分來源[18-19]。納蟲泡膜的組分中,大部分來源于宿主細胞膜,少數來源于宿主細胞質,還包括弓形蟲分泌的棒狀體蛋白、微粒體蛋白、致密顆粒蛋白[18-19]。由此,弓形蟲在入侵后在宿主細胞內形成了一個非融合小室—納蟲泡包圍著蟲體,來抵抗宿主細胞內涵體的酸化及溶酶體的融合作用,即防止被宿主細胞清除。
瘧原蟲裂殖子入侵紅細胞則具有高度的宿主特異性,這是因為瘧原蟲是以配體-受體結合的方式來識別紅細胞的[25]。瘧原蟲裂殖子入侵紅細胞的過程開始于裂殖子與紅細胞表面之間的微弱的吸附作用,是通過尚未鑒定的原蟲配體與紅細胞受體之間的相互作用,接著裂殖子的類錐體頂端與紅細胞表面緊密結合[26-27]。裂殖子觸發了與紅細胞之間“連接(junction)”的形成,該連接在電子顯微鏡下顯示為電子致密區,存在于裂殖子類錐體的一端。此外,裂殖子分泌棒狀體蛋白進入紅細胞,可能促進入侵的過程[27-29]。裂殖子最終通過原蟲表面蛋白和原蟲的肌動蛋白-肌球蛋白馬達之間的相互作用,隨著該“連接”向紅細胞內的移動而進入紅細胞[30]。因此,該“連接”的形成及其與原蟲分子馬達之間的相互作用是入侵的關鍵步驟[31-32]。而納蟲泡是由紅細胞膜向細胞內流動而形成,與原蟲進入紅細胞的過程同步完成[29],在入侵過程結束的時候,“連接”部分的電子致密區成為納蟲泡的一部分包裹著剛入侵的原蟲[27]。
從弓形蟲與瘧原蟲入侵宿主細胞的過程和納蟲泡形成過程來看,兩者都具有很多的相同之處,如在入侵開始時,弓形蟲速殖子和瘧原蟲裂殖子入侵宿主細胞都形成一個特殊的結構——“運動連接(moving junction)”,并在該連接處形成一個宿主細胞F-肌動蛋白環,激活宿主細胞骨架發生重組[2];此外,兩種原蟲納蟲泡膜的組分大部分是來源于宿主細胞膜,小部分來源于原蟲本身的分泌蛋白,而且還有一些來源于宿主細胞質。
弓形蟲感染宿主細胞后,在納蟲泡膜上有宿主細胞Rho A與Rac1 GTP酶的聚集,這兩種宿主細胞的酶類被納入了弓形蟲的納蟲泡膜上的方式有可能包括以下三種:1、隨同宿主細胞膜一同被組成到納蟲泡膜上;2、通過擴散作用,從宿主細胞質中被組成到納蟲泡膜上;3、來源于與弓形蟲納蟲泡膜緊密結合且作為納蟲泡擴大中主要膜成分來源的宿主細胞器如內質網、線粒體等。
盡管Rho AGTP酶被發現存在于紅細胞的胞質和胞膜上,而且高度親合性地結合于紅細胞膜的胞質面上[15],但是瘧原蟲納蟲胞膜上沒有發現Rho A和Rac1 GTP酶聚集,這個現象有可能說明:1、紅細胞膜上的Rho GTP酶并沒有在納蟲泡形成時隨著紅細胞膜被納入到納蟲泡膜上;2、細胞質中的Rho GTP酶也沒有被組成到納蟲泡膜上;3、因為紅細胞內沒有內質網、線粒體等細胞器,因而也不可能通過膜融合的方式被組成到納蟲泡膜上。
盡管弓形蟲、瘧原蟲的入侵過程需要宿主細胞骨架發生重組,而細胞骨架的重組又是由Rho GTP酶家族所調控,但是這個過程的具體細節仍是未知。宿主細胞Rho GTP酶在弓形蟲速殖子與瘧原蟲裂殖子入侵宿主細胞時不同的分布現象,顯示這兩種原蟲通過不同的途徑來調節宿主細胞骨架重組。
[1]Zhao WX.Hu man parasitology[M].3rded.Beijing:People’s Health Publishing House,2004:175.(in Chinese)趙慰先.人體寄生蟲學[M].3版.北京:人民衛生出版社,2004:175.
[2]Gonzalez V,Combe A,David V,etal.Host cell entry by apico mplexa parasites requires actin poly merization in the host cell[J].Cell Host Micr obe,2009,5(3):259-272.DOI:10.1016/j.cho m.2009.01.011
[3]Go mes-Santos CS,Itoe MA,Afonso C,etal.Highly dynamic host actin reorganization around developing Pl asmodiu m inside hepatocytes[J].PLoS One,2012,7(1):e29408.
[4]Elliott DA,Clar k DP.Cr yptosporidiu m par vu m induces host cell actin accu mulation at the host-parasite interface[J].Infect Immun,2000,68(4):2315-2322.DOI:10.1128/IAI.68.4.2315-2322.2000
[5]da Silva CV,da Silva EA,Cruz MC,etal.ARF6,PI3-kinase and host cell actin cytoskeleton in Toxopl asma gondii cell invasion[J].Biochem Biophys Res Co mmun,2009,378(3):656-661.DOI:10.1016/j.bbrc.2008.11.108
[6]Coppens I,Dunn JD,Ro mano JD,etal.Toxopl asma gondii sequesters lysoso mes from ma mmalian hosts in the vacuolar space[J].Cell,2006,125(2):261-274.DOI:10.1016/j.cell.2006.01.056
[7]Oh SS,Voigt S,Fisher D,etal.Plasmodiu m f alcipar u m erythrocyte membrane protein 1 is anchored to the actin-spectrin junction and knob-associated histidine-rich pr otein in the eryt hrocyte skeleton[J].Mol Biochem Parasitol,2000,108 (2):237-247.DOI:10.1016/S0166-6851(00)00227-9
[8]Pei X,Guo X,Coppel R,etal.Plasmodiu m f alcipar u m erythr ocyte me mbrane protein 3 (Pf EMP3)destabilizes er yt hr ocyte membrane skeleton[J].J Biol Chem,2007,282 (37):26754-26758.DOI:10.1074/jbc.M701612200
[9]Mill holland MG,Chandramohanadas R,Pizarr o A,etal.The malaria parasite progressively dismantles the host erythrocyte cytoskeleton for efficient egress[J].Mol Cell Pr oteo mics,2011,10(12):M111.010678.DOI:10.1074/mcp.M111.010678
[10]Hall A.Rho GTPases and the actin cytoskeleton[J].Science,1998,279(5350):509-514.DOI:10.1126/science.279.5350.509
[11]Sch wartz M.Rho signalling at a glance[J].J Cell Sci,2004,117(Pt 23):5457-5458.DOI:10.1242/jcs.01582
[12]Burridge K,Wennerberg K.Rho and Rac take center stage[J].Cell,2004,116(2):167-179.DOI:10.1016/S0092-8674(04)00003-0
[13]Etienne-Manneville S,Hall A.Rho GTPases in cell biology[J].Nature,2002,420(6916):629-635.DOI:10.1038/nat ure01148
[14]Kalfa TA,Pushkaran S,Mohandas N,etal.Rac GTPases regulate the mor phology and defor mability of the er yt hr ocyte cyt oskeleton[J].Blood,2006,108(12):3637-3645.DOI:10.1182/blood-2006-03-005942
[15]Boukharov AA,Cohen CM.Guanine nucleotide-dependent translocation of Rho A from cytosol to high affinity membrane binding sites in hu man er yt hr ocytes[J].Biochem J,1998,330(Pt 3):1391-1398.
[16]Trager W,Jensen JB.Hu man malaria parasites in continuous culture[J].Science,1976,193 (4254):673-675.DOI:10.1126/science.781840
[17]Mac Laren A,Attias M,de Souza W.Aspects of the early moments of interaction bet ween tachyzoites of Toxopl asma gondii with neutrophils[J].Vet Parasitol,2004,125(3-4):301-312.DOI:10.1016/j.vetpar.2004.07.006
[18]Peng HJ,Chen XG,Lindsay DS.A review:Co mpetence,co mpromise,and concomitance-reaction of the host cell to Toxopl asma gondii infection and develop ment[J].J Parasitol,2011,97(4):620-628.DOI:10.1645/GE-2712.1
[19]Peng HJ.For mation mechanism and the f unction of parasitophorous vacuole of Toxopl asma gondii[J].Chin J Parasitol Parasit Dis,2010,28(5):81-84.(in Chinese)彭鴻娟.剛地弓形蟲納蟲泡的形成機制及其作用[J].中國寄生蟲學與寄生蟲病雜志,2010,28(5):81-84.
[20]Liang ZH.Research progress of Toxoplasma gondii invading host cells mechanism[J].Chin J Zoonoses,1995,11(5):34-36.(in Chinese)梁志慧.弓形蟲速殖子侵入宿主細胞機理的研究進展[J].中國人獸共患病雜志,1995,11(5):34-36.
[21]Alexander DL,Mital J,War d GE,etal.Identification of the moving junction co mplex of Toxopl asma gondii:a collaboration bet ween distinct secret or y organelles[J].PLoS Pat hog,2005,1(2):e17.
[22]Cao J,Kaneko O,Thongkukiatkul A,etal.Rhoptry neck protein RON2 for ms a co mplex wit h micr one me pr otein A MA1 in Pl asmodiu m f alcipar u m merozoites[J].Parasitol Int,2009,58(1):29-35.DOI:10.1016/j.parint.2008.09.005
[23]Straub K W,Cheng SJ,Sohn CS,etal.Novel co mponents of the apico mplexan moving junction reveal conser ved and coccidia restricted elements[J].Cell Microbiol,2009,11(4):590-603.DOI:10.1111/j.1462-5822.2008.01276.x
[24]Sibley LD,Dobrowolski JM,Morisaki JH,etal.Invasion and intracell ular survival by Toxopl asma gondii[M]//Russell DG.In:Strategies for Intracellular Sur vival of Microbes.London:Bailliere Tindall.1994:245-264.
[25]Srinivasan P,Beatty WL,Diouf A,etal.Binding of Plasmodiu m merozoite proteins RON2 and A MA1 triggers commit ment to invasion[J].Pr oc Natl Acad Sci U S A,2011,108(32):13275-13280.DOI:10.1073/pnas.1110303108
[26]Dvorak JA,Miller LH,Whitehouse WC,etal.Invasion of er yt hr ocytes by malaria mer ozoites[J].Science,1975,187(4178):748-750.DOI:10.1126/science.803712
[27]Aikawa M,Miller LH,Johnson J,etal.Erythrocyte entry by malarial parasites.A moving junction bet ween er yt hr ocyte and parasite[J].J Cell Biol,1978,77(1):72-82.
[28]Miller LH,Aikawa M,Johnson JG,etal.Interaction bet ween cytochalasin B-treated malarial parasites and eryt hrocytes.Attach ment and junction for mation[J].J Exp Med,1979,149(1):172-184.
[29]Aikawa M,Miller L H,Rabbege JR,etal.Freeze-fracture st udy on the er yt hr ocyte me mbrane during malarial parasite invasion[J].J Cell Biol,1981,91(1):55-62.
[30]Bau m J,Richar d D,Healer J,etal.A conser ved molecular motor drives cell invasion and gliding motility acr oss malaria life cycle stages and other apicomplexan parasites[J].J Biol Chem,2006,281(8):5197-5208.DOI:10.1074/jbc.M509807200
[31]Jewett TJ,Sibley LD.Aldolase for ms a bridge bet ween cell surface adhesins and the actin cyt oskelet on in apico mplexan parasites[J].Mol Cell,2003,11(4):885-894.DOI:10.1016/S1097-2765(03)00113-8
[32]Buscaglia CA,Coppens I,Hol WG,etal.Sites of interaction bet ween aldolase and t hro mbospondin-related anony mous protein in plasmodiu m[J].Mol Biol Cell,2003,14(12):4947-4957.DOI:10.1091/mbc.E03-06-0355

