針灸對帕金森小鼠模型運動機能調(diào)節(jié)的分子機制研究
黃 慶 孫艷紅 王 璐 張 一 諸 穎 李曉明 孔華庭 王少朋 胡 鈞 樊春海
(中國科學院上海應用物理研究所 嘉定園區(qū) 上海 201800)
針灸早在公元前 2000年就成為一種防治疾病的手段,是以針刺或艾灸身體的穴位,并通過全身經(jīng)絡的傳導,來調(diào)理氣血和臟腑功能,從而達到治病防病的目的。相對于藥物來說,針灸具有療效好、操作簡單、副作用低的優(yōu)勢。為什么對機體特殊部位(穴位)進行這種針刺或熱療就能防治疾病, 是一直以來都比較受關注的課題,盡管穴位和經(jīng)絡的本質(zhì)問題都還在探索之中,還處于假說的驗證階段,但是針灸的臨床效果在國際上有目共睹,在20世紀70年代末針灸作為一種治療疾病的手段,相繼得到了世界衛(wèi)生組織(WHO)和美國國立衛(wèi)生研究院(NIH)的肯定和認可,尤其在緩解疼痛,改善偏癱后遺癥等運動障礙有較好的臨床療效。
帕金森病(Parkinson disease,PD) 又名震顫性麻痹,是中老年人常見的神經(jīng)系統(tǒng)退行性疾病[1]。其主要病理改變?yōu)橹心X黑質(zhì)致密部多巴胺(DA)能神經(jīng)元進行性變性丟失,紋狀體區(qū)多巴胺含量減少,以及殘存的多巴胺能神經(jīng)元內(nèi)形成以a-突觸共核蛋白(a-syn)為主要成分的嗜酸性包涵體—路易小體(Lewy body,LB)生成為主要的病理特征[2-5]。近年來臨床研究證實, 采用頭針、體針等方案治療針灸可以有效改善帕金森病的震顫、肌肉僵直、運動障礙等癥狀,實驗研究發(fā)現(xiàn)針灸可以改善MPTP導致的PD小鼠模型的運動協(xié)調(diào)性,增加中腦黑質(zhì)內(nèi)多巴胺能神經(jīng)元數(shù)量,提高了腦內(nèi)多巴胺的利用率[6-9],2007年的Nature news專門有篇關于針灸治療PD的報道,提示針灸在PD的防治中具有較好的應用前景。針刺遠端肢體的穴位,能夠緩解 PD這種腦部病變引起的癥狀,其分子機制一直受到極大的關注。本工作利用MPTP腹腔注射建立PD模型,并探討針灸對其運動機能的影響及其分子機制。
1 材料與方法
1.1 試劑及儀器
MPTP、Lamp1、a-synuclein一抗、二抗購于Sigma,華佗牌針灸針,規(guī)格0.19 mm ′10mm,華佗牌針刺手法診療儀,型號 SXDZ-100,中國蘇州醫(yī)療用品廠有限公司;BCA蛋白測定試劑盒,碧云天生物技術有限公司。電泳儀,BIO-RAD。
1.2 動物
ICR小鼠,雄性,體重28–30g,購于上海斯萊克實驗動物有限公司,合格證號:SCXK(滬)2007-0005。
1.3 實驗方法[6-9]
1.3.1 分組及治療
小鼠適應性飼養(yǎng)1周,隨機分為生理鹽水組,MPTP組,針灸治療組。針灸穴位選取陽陵泉(GB34)穴,用針刺手法針療儀進行捻轉(zhuǎn)手法刺激,連續(xù)15s。生理鹽水組和MPTP組在實驗第1天開始分別腹腔注射生理鹽水和MPTP (30mg/kg),每天1次,連續(xù)5天,在每次注射MPTP后2h針灸治療。
1.3.2 旋棒儀進行行為學檢測
于試驗第5天,針灸治療后30min,用旋棒儀進行行為學測試,轉(zhuǎn)速為 20r/min,測定前訓練 3次,記錄在2min內(nèi)第1次掉落的時間(潛伏期),超過2min以2min計。
1.3.3 透射電鏡標本取材及固定
MPTP停止注射后繼續(xù)針灸7天,于末次治療后30min,每組取1只小鼠進行心臟灌注,將針頭插入左心室,先緩慢推注30mL生理鹽水,然后再快速推注20mL 4%多聚甲醛固定液,然后用小鼠腦切片模具取中腦黑質(zhì)部位,切成1mm3的小塊放入2.5%的戊二醛固定液,送透射電鏡觀察。
1.3.4 western blot蛋白樣品取材
小鼠脫頸椎處死,取中腦黑質(zhì)部位放于液氮保存,次日取出進行蛋白裂解,測定蛋白濃度后,進行 western blot 檢測 Lamp1、a-synuclein的蛋白表達。
2 實驗結果
2.1 小鼠模型的構建及針灸的治療效果
對小鼠的針灸如圖1所示。小鼠在注射MPTP后 1h左右出現(xiàn)活動減少,豎毛、豎尾等表現(xiàn),在注射 3天后就開始出現(xiàn)輕度的靜止性震顫, 運動協(xié)調(diào)性下降。

圖1 對小鼠GB34穴位進行針灸處理Fig. 1 Acupuncture treatment at acupoint GB34 in mice.
圖2 為注射MPTP 5天后用旋棒儀進行的行為學測試結果,生理鹽水組大多數(shù)都在 120s以上,MPTP組在棒上時間明顯減少,大部分在10s以內(nèi),而針灸治療組掉落潛伏期較MPTP組明顯延長,說明針灸可以改善MPTP導致的帕金森模型小鼠運動的協(xié)調(diào)性。
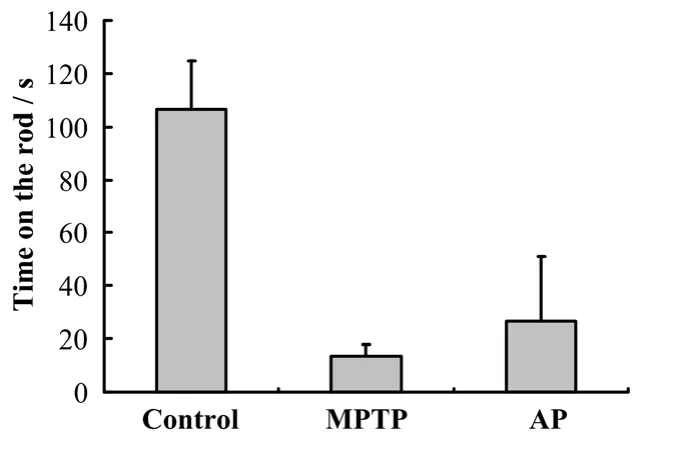
圖2 針灸GB34穴位對帕金森模型小鼠行為學的影響Fig.2 Effect of acupuncture treatment on motor function in Parkinson’s disease mice model.
2.2 中腦黑質(zhì)Lamp1、a-synuclein蛋白表達
取中腦黑質(zhì)后進行蛋白裂解,分別對Lamp1、a-synuclein蛋白表達情況進行了western blot檢測,結果見圖3。與生理鹽水組比較,注射MPTP組的溶酶體膜蛋白Lamp1的表達明顯下降,a-synuclein蛋白的表達上升,提示MPTP引起的小鼠黑質(zhì)致密部的溶酶體膜破壞導致了清除a-synuclein的能力下降。針灸GB34穴后,可以增加溶酶體膜蛋白的表達,減輕 MPTP對溶酶體膜蛋白的損傷,促進a-synuclein蛋白的有效降解。結果提示針灸可能能通過改善溶酶體的功能,從而促進了a-synuclein蛋白的降解。眾所周知,蛋白酶體和自噬系統(tǒng)是清除缺陷蛋白的兩大重要途徑,由針灸引發(fā)的a-synuclein蛋白降解很有可能是來自自噬水平的上升所致。
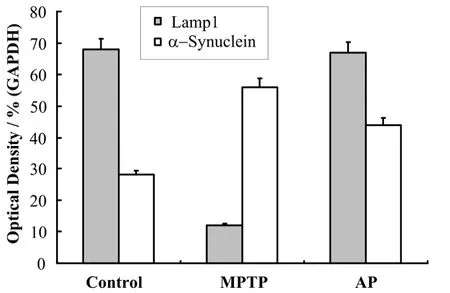
圖3 針灸GB34穴位對帕金森模型小鼠黑質(zhì)Lamp1、a-synuclein蛋白表達的影響Fig.3 Effect of acupuncture treatment on protein expression of Lamp1 and a-synuclein.
2.3 針灸對PD小鼠模型黑質(zhì)超微結構的影響
對各組小鼠黑質(zhì)的電鏡結果發(fā)現(xiàn):正常對照組核膜完整,線粒體結構完整,細胞質(zhì)中細胞器結構清晰,溶酶體結構完整;MPTP組出現(xiàn)核膜破損,核質(zhì)彌散,有邊集情況,線粒體腫脹空泡化,溶酶體數(shù)量減少,細胞質(zhì)中出現(xiàn)大量的雙層膜結構的自噬小泡;針灸組線粒體的損害明顯減輕,溶酶體數(shù)量明顯增多,能見到與溶酶體體融合的自噬體。提示針灸可以改善MPTP引起溶酶體減少和自噬體積累的情況,使a-Synuclein 蛋白能夠有效清除,從而改善帕金森模型的運動障礙。

圖4 針灸GB34穴位對帕金森模型小鼠黑質(zhì)神經(jīng)細胞超微結構的影響(′5000倍) (a) 正常對照 (b) 模型組 (c) 針灸組Fig.4 Effect of acupuncture treatment on dopaminergic neurons cell structure in the substantia nigra detected by TEM.(a) Control (b) MPTP (c) Acupuncture(AP)
3 討論
針灸作為一種通過對身體體表面穴位進行刺激或熱療的物理療法,達到治病防病的目的,受到廣大患者的歡迎。尤其在像中風偏癱、帕金森等運動障礙性疾病的治療和康復方面,起著舉足輕重的作用。但是對其作用機制方面的研究卻非常少,許多治療效果得不到客觀合理的解釋,就使得針灸具有了神秘的傳奇色彩。借助先進的檢測手段和現(xiàn)代的醫(yī)學理論將有助于我們探求針灸的作用機制及經(jīng)絡和穴位的本質(zhì)。針灸對多種病具有療效,這種作用實質(zhì)上有一個共同點,就是通過穴位刺激,使人體氣血通暢,重新回復一個平衡狀態(tài),即機體層面的穩(wěn)態(tài)。
細胞自噬是近年來提出的一個對維持細胞穩(wěn)態(tài)有重要意義的生理現(xiàn)象,是細胞在應激狀態(tài)下自保和更新的一種機制。近年來的研究表明,自噬在PD的發(fā)病過程占有非常重要的地位。經(jīng)過MPP處理的神經(jīng)細胞、MPTP造的小鼠模型和PD病人的中腦黑質(zhì)中都出現(xiàn)了溶酶體的缺失和自噬體的積累,因為溶酶體膜的通透性改變,蛋白酶外泄,導致自噬體不能與溶酶體融合,不僅大量的有毒蛋白如a-synuclein不能有效清除,而且溶酶體內(nèi)的蛋白酶外泄后還會損傷正常的細胞及細胞器,導致多巴胺神經(jīng)元功能受損[10-12]。因此,穩(wěn)定溶酶體膜及其功能、調(diào)節(jié)自噬降解通路是治療PD的又一新的途徑。
用MPTP制備的帕金森小鼠模型是目前國內(nèi)外應用比較廣的模型, 可以出現(xiàn)類似帕金森病人的運動不協(xié)調(diào)和中腦黑質(zhì)的多巴胺損傷的病理變化。該模型小鼠由于溶酶體功能受到破壞,導致自噬通路中斷,進而產(chǎn)生毒性蛋白累積。在本研究中發(fā)現(xiàn),通過針灸治療能一定程度上改善溶酶體的功能,使累積的自噬體減少,促進a-synuclein 蛋白的降解,從而調(diào)節(jié)了帕金森模型的自噬。Western blot的結果也支持這一結論,表現(xiàn)為 Lamp1蛋白表達上升,a-synuclein蛋白表達有所下降。這些結果提示,針灸可能通過調(diào)節(jié)神經(jīng)細胞自身的自噬水平來清除過度積累的毒性蛋白,從而保護神經(jīng)細胞免受毒性蛋白的損傷,改善PD小鼠的運動障礙。應該指出,本次實驗中使用小鼠的規(guī)模較小,還必須進行更大樣本的動物實驗來得到更加準確,更有說服力的證據(jù)。綜上所述,本論文在揭示針灸治療帕金森病的作用及機理方面提供了一條新的思路,其詳細的作用機制,尤其是自噬水平上升的確認以及針灸刺激如何轉(zhuǎn)導到中腦黑質(zhì)發(fā)揮作用等,都需要進一步系統(tǒng)深入的研究。
1 Levine B, Kroemer G. Autophagy in the pathogenesis of disease[J]. Cell, 2008, 132: 27–42
2 Jenner P, Olanow C W. Understanding cell death in Parkinson's disease[J]. Ann Neurol, 1998, 44(3 Suppl 1):S72–S84
3 Dunnett S B, Bjorklund A. Prospects for new restorative and neuroprotective treatments in Parkinson's disease[J].Nature, 1999, 399(6738 Suppl): 32–39
4 Masliah E, Rockenstein E, Veinbergs I, et al.Dopaminergic loss andinclusion body formation in alpha-synuclein mice: implications for neurodegenerative disorders[J]. Science, 2000, 287 (5456): 1265–1269
5 Baba M, Nakajo S, Tu P H, et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson!s disease and dementia with Lewy bodies[J]. Am J Pathol,1998, 152 (4): 879–884
6 Kang JM, Park HJ, Choi YG, et al.Acupuncture inhibits microglial activate ion and inflammatory events in the MPTP-induced mouse model[J]. Brain Research, 2007,1131: 211–219
7 Jeon S, Kim YJ, Park HJ, et al. Proteomic analysis of the neuroprotective mechanisms of acupuncture treatment in a Parkinson’s disease mouse model[J]. Proteomics, 2008,8: 4822–4832
8 Choi YG, Park JH, Lim S, et al. Acupuncture inhibits ferric iron deposition and ferritin-heavy chain reduction in an MPTP-induced parkinsonism model[J]. Neuroscience Letters, 2009, 450:92–96
9 Jeon S, Lee H, Park HJ, et al. Acupuncture Enhances the Synaptic Dopamine Availability to Improve Motor Function in a Mouse Model of Parkinson’s Disease[J].PLoS ONE, 2011: 6 (11): 27566
10 Benjamin Dehay, Jordi Bove, Natalia Rodríguez-Muela,Celine Perier, Ariadna Recasens, Patricia Boya, and Miquel Vila, Pathogenic Lysosomal Depletion in Parkinson’s Disease[J]. The Journal of Neuroscience,2010, 30(37): 12535–12544
11 Dehay B, Ramirez A, Martinez-Vicente M, et al. Loss of P-type ATPase ATP13A2/PARK9 function induces general lysosomal deficiency and leads to Parkinson disease neurodegeneration[J]. PNAS, 2012
12 Vila M, Bové J, Dehay B, Rodríguez-Muela N, et al.Lysosomal membrane permeabilization in Parkinson disease[J]. Autophagy, 2011, 7:1, 98–100

