飼糧NFC/NDF對奶山羊瘤胃上皮細胞胰島素樣生長因子Ⅰ及其受體的基因表達的影響
周向麗 劉大程* 孫 鴿 高 民 胡紅蓮
(1.內蒙古農業大學獸醫學院,呼和浩特 010018;2.內蒙古農牧業科學院,呼和浩特 010030)
近些年隨著高精料飼糧的大量使用,反芻動物的生產性能得到了極大的提高。這種以淀粉為能量來源高精料飼糧的大量使用極易導致瘤胃酸中毒等代謝性疾病的發生[1]。正常情況下,反芻動物瘤胃發酵產生的揮發性脂肪酸(VFA)大多被瘤胃上皮細胞吸收[2],而瘤胃對VFA的吸收是一個被動過程,位于瘤胃壁上的瘤胃乳頭可增強此被動吸收過程[3],因此,增加瘤胃乳頭長度和表面積可增強其對VFA的吸收,在一定程度上避免了VFA堆積。飼糧的營養水平會影響胰島素樣生長因子Ⅰ(insulin-like growth factor Ⅰ,IGF-Ⅰ)的基因表達和濃度。高營養飼糧能夠增加瘤胃上皮細胞胰島素樣生長因子Ⅰ受體(IGF-Ⅰ receptor,IGF-ⅠR)的基因表達,同時血液中IGF-Ⅰ的濃度也顯著高于低營養飼糧組[4]。與此同時許多體內外試驗研究發現反芻動物瘤胃上皮生長發育受IGF-Ⅰ等激素或生長因子的調節。IGF-Ⅰ具有調節細胞代謝,促進細胞生長、分化和分裂以及抑制細胞死亡的作用。此外,IGF-Ⅰ又可促進體外培養的山羊瘤胃上皮細胞DNA合成[4]。因此一些學者推斷高營養飼糧可經IGF-Ⅰ系統增加瘤胃上皮乳頭的數量及大小[5]。目前,關于亞急性瘤胃酸中毒(SARA)發生、發展過程中,瘤胃上皮細胞IGF-Ⅰ和IGF-ⅠR的基因表達量變化以及SARA過程中IGF-Ⅰ與瘤胃上皮生長之間存在的聯系,鮮見報道。因此,本試驗在逐漸增加飼糧非纖維性碳水化合物和中性洗滌纖維比(NFC/NDF)誘導奶山羊發生SARA的基礎上,采用實時定量 PCR(qRTPCR)技術研究SARA發生、發展過程中瘤胃上皮細胞IGF-Ⅰ及IGF-ⅠR的基因表達量的變化。
1 材料與方法
1.1 試驗動物與試驗設計
選用12只體況良好的泌乳期關中奶山羊,平均體重30~35 kg,年齡2~3歲。整個試驗期,試驗動物單籠飼養,每天06:00和18:00 2次等量飼喂,自由飲水。
試驗飼糧參照NRC(1981)山羊營養需求[6]和文獻[7]配制,以玉米、豆粕、麥麩、青干草為主要原料。試驗分4期進行,每期15 d,依次飼喂NFC/NDF為1.02(Ⅰ期)、1.24(Ⅱ期)、1.63(Ⅲ期)、2.58(Ⅳ期)的4組飼糧誘導奶山羊發生SARA。試驗飼糧組成及營養水平見表1。
1.2 樣品采集與處理
試驗分4期進行,通過觀察動物的精神狀態、采食量及糞便的變化等判定動物發生酸中毒,SARA誘導成功。在每期試驗結束后,選3只奶山羊宰殺取樣,每只羊取3個平行樣。所有山羊宰殺前禁食12 h,奶山羊屠宰后,迅速打開瘤胃,為了便于定位每次采取后腹盲囊靠近后溝處組織,鈍性分離其黏膜,生理鹽水洗凈表層瘤胃內容物后,剪成糊狀裝入1支1.5 mL離心管,迅速置于液氮中保存,后轉于-80℃冰箱保存,用于qRTPCR定量分析。
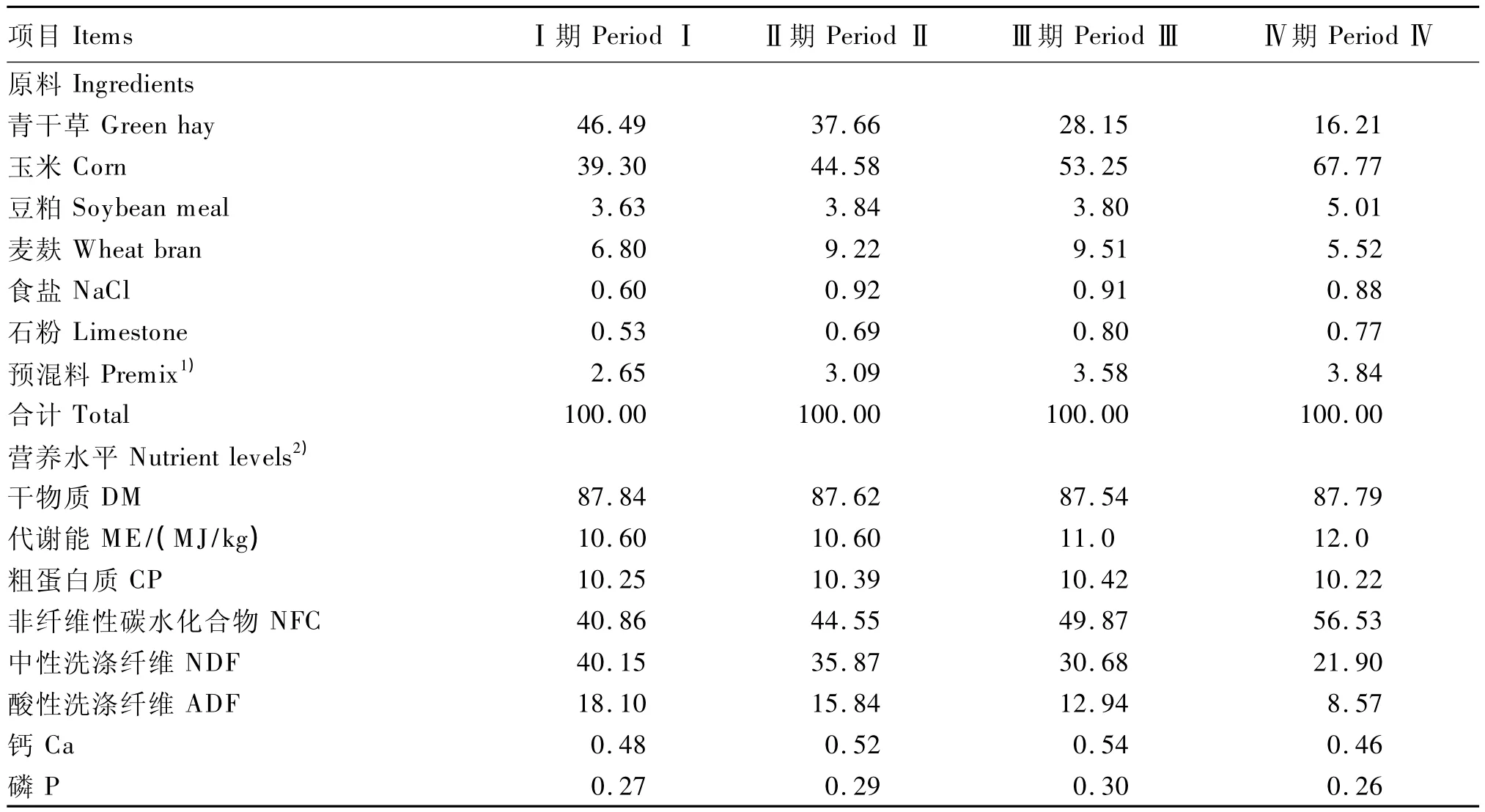
表1 試驗飼糧組成及營養水平(風干基礎)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.3 瘤胃上皮細胞總RNA的提取
用總RNA提取試劑盒[天根生化科技(北京)有限公司]提取瘤胃上皮細胞總RNA并用紫外分光光度計測定吸光度,以OD260nm/OD280nm來判斷提取總RNA的純度。
1.4 cDNA第1鏈的合成
定量取山羊瘤胃組織總RNA為模板,建立反轉錄PCR檢測方法。以oligo(dT)18引物進行反轉錄,合成 cDNA第1鏈,采用20 μL反應體系,組成如下:總 RNA 5~500 ng、Anchored Oligo(dT)18(0.5 μg/μL)1 μL、2 × TS Reaction Mix 10 μL、TransScript RT/RI Enzyme Mix 1 μL,加RNase-free Water至 20 μL。
1.5 目標片斷的擴增與鑒定
3對特異性引物設計參照文獻[8],所有引物均由大連寶生物有限公司合成,引物序列及參數見表2。反應使用反轉錄PCR試劑盒購自日本TaKaRa公司。25 μL反應體系如下:模板cDNA 3 μL、上游和下游引物(10 μmol/L) 各 0.5 μL、2 × TransTaq-T PCR SuperMix 12.5 μL,加雙蒸水至 25 μL。
反轉錄PCR擴增參數如下:94℃預變性5 min;94℃變性30 s,退火溫度(表2)下退火30 s,72℃延伸45 s,32個循環;72℃最終延伸7 min。
產物經2.0%瓊脂糖凝膠電泳檢測。

表2 引物序列及參數Table 2 Sequences and parameters of primers
1.6 目的片段膠回收、克隆及鑒定
用膠回收試劑盒[天根生化科技(北京)有限公司]對反轉錄PCR擴增產物進行膠回收,按照pEASY-T1 Cloning Kit試劑盒(北京全式金生物技術有限公司)將3個膠回收片段分別與pEASY-T1載體連接,轉化入感受態細胞(Trans1-T1 Phage Resistant),隨機挑取幾個白色菌落,分別以其裂解液為模板,用上述引物進行反轉錄PCR擴增,其反應體系和反應條件均與1.5相同,用2.0%的瓊脂糖凝膠電泳檢測擴增片段的大小以鑒定重組質粒。挑選反轉錄PCR鑒定陽性菌落分別接種于1 mL含有 1.4 μL 氨芐青霉素(Amp,100 μg/mL)的LB液體培養基中,37℃振蕩培養過夜,送至大連寶生物有限公司進行測序。
1.7 重組質粒的提取及qRT-PCR
用質粒提取試劑盒(美國AXYGEN公司)提取含有目的片段的重組質粒,使用微量紫外分光光度計(德國Eppendorf公司)測定質粒DNA溶液的濃度,將提取的質粒進行10倍系列稀釋,制備10~105拷貝的反應用模板共5個梯度濃度,用Premix Ex TaqTM試劑盒(日本TaKaRa公司)配制25 μL 反應體系,組成如下:模板 cDNA 3 μL、SYBRB Premix Ex TaqTMⅡ(2 ×)12.5 μL、上游和下游引物(10 μmol/L)各 0.5 μL、8.5 μL 雙蒸水。
美國Bio-Rad公司 iQTM5多重 qRT-PCR儀上進行qRT-PCR擴增,反應參數如下:95℃預變性30 s;95℃變性10 s,退火溫度(表2)下退火30 s,72℃延伸30 s(收集熒光),40個循環。
反應結束后軟件自動繪制以拷貝數的對數為橫坐標,以qRT-PCR反應過程中到達熒光閾值的初始循環數(Ct)為縱坐標的標準曲線。
1.8 樣品DNA的測定
獲得樣品Ct,計算相對表達量。計算公式[9]如下:

1.9 數據統計分析
數據統計分析采用SPSS 17.0軟件ANOVA過程進行方差分析,多重比較用Duncan氏法。
2 結果與分析
2.1 瘤胃上皮細胞總RNA的提取及質量檢測
提取的總RNA經紫外分光光度計檢測,其OD260nm/OD280nm在1.8~2.0之間,說明提取的總RNA有較好的純度。經2.0%的瓊脂糖凝膠電泳鑒定樣品總RNA的完整性,如圖1所示,18S和28S條帶清晰,無DNA污染,無明顯降解,表明提取的總RNA質量較高。
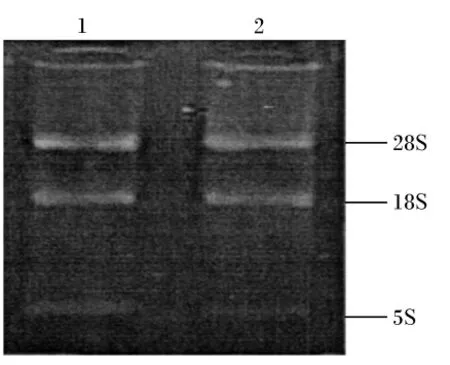
圖1 RNA凝膠電泳圖譜Fig.1 Agarose gel image of total RNA
2.2 目標片段擴增與序列分析
用2.0%瓊膠糖凝膠電泳檢測,反轉錄PCR擴增產物專一且內參 β-肌動蛋白、IGF-Ⅰ和IGF-ⅠR目標片段大小分別在330、393和215 bp(圖2、圖3和圖4)。每種引物實際擴增片段大小與預期目的片段大小相符。將這3種反轉錄PCR產物回收、克隆、陽性重組質粒進行反轉錄PCR,擴增出的條帶與目標片段大小一致(圖5)。
2.3 熔解曲線分析
內參β-肌動蛋白、IGF-Ⅰ和IGF-ⅠR的基因的熔解曲線各只有1個特異性峰(圖6),表明無引物二聚體及非特異性產物形成,說明所設計引物有很好的特異性,PCR反應條件得到了較好的優化。
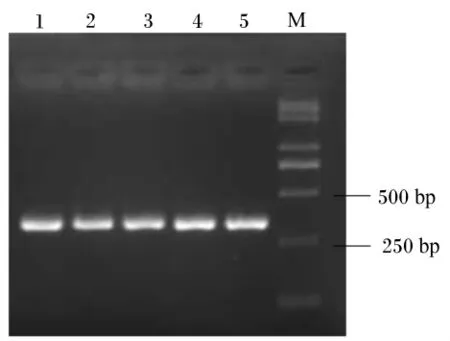
圖2 β-肌動蛋白反轉錄PCR電泳檢測結果Fig.2 Reverse transcription PCR electrophoresis results of β-actin
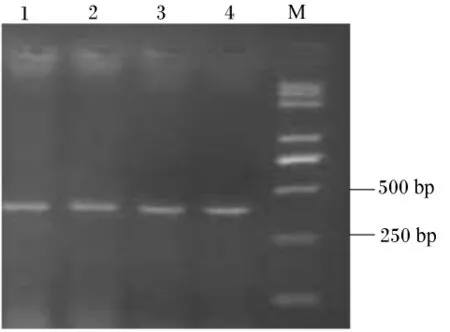
圖3 IGF-Ⅰ反轉錄PCR電泳檢測結果Fig.3 Reverse transcription PCR electrophoresis results of IGF-Ⅰ

圖4 IGF-ⅠR反轉錄PCR電泳檢測結果Fig.4 Reverse transcription PCR electrophoresis results IGF-ⅠR
圖5 含有目的片段的質粒反轉錄PCR電泳結果Fig.5 Reverse transcription PCR electrophoresis results of plasmids with target fragments
2.4 質粒標準曲線的構建
經紫外分光光度計測定β-肌動蛋白、IGF-Ⅰ和IGF-ⅠR質粒DNA溶液的濃度分別為31、29和34 μg/mL。qRT-PCR儀中軟件自動生成的質粒標準品擴增反應曲線,Ct和拷貝數呈線性關系,所構建的質粒標準品起始模板為10~105,繪制出的拷貝數log值(y)和Ct(x)的標準曲線方程分別為:β-肌動蛋白,y= -3.283x+24.874(R2=0.992);IGF-Ⅰ,y= - 3.637x+29.076(R2=0.995);IGF-ⅠR,y= - 3.935x+22.893(R2=0.997)。表明拷貝數的Log值與Ct之間的線性關系良好,其他非特異性反應產生的雙鏈干擾較少,所建立的標準曲線符合qRT-PCR定量的要求。

圖6 β-肌動蛋白、IGF-Ⅰ和IGF-ⅠR熔解曲線Fig.6 Melting curves of β-actin,IGF-Ⅰ and IGF-ⅠR
2.5 IGF-Ⅰ和IGF-ⅠR定量分析結果
本試驗用qRT-PCR分別檢測出各組目的基因和內參基因的Ct(表3),代入公式進行相對定量(表4)。隨著 NFC/NDF的逐漸增大,IGF-Ⅰ和IGF-ⅠR的基因表達量均呈現不同程度的增加,且二者表達量的變化趨勢具有很好的一致性。以Ⅰ期瘤胃中的IGF-Ⅰ和IGF-ⅠR的基因表達量作為對照,Ⅱ期IGF-Ⅰ和 IGF-ⅠR的基因表達量分別是Ⅰ期的1.70和1.88倍,2組之間無顯著差異(P >0.05)。Ⅲ期較Ⅱ期相比,IGF-Ⅰ和 IGF-ⅠR的基因表達量出現顯著增加(P<0.05),且分別是Ⅰ期的2.71和3.09倍。Ⅳ期(SARA期)較Ⅲ期相比,IGF-Ⅰ和IGF-ⅠR的基因表達量分別出現極顯著(P<0.01)和顯著(P<0.05)增加,且分別是Ⅰ期的9.61和10.19倍,極顯著高于Ⅰ期(P<0.01)。
3 討論
qRT-PCR技術目前已成為一種被廣泛用于對未知模板進行定量分析的必要手段。本試驗在測定不同飼糧NFC/NDF條件下,奶山羊瘤胃上皮細胞IGF-Ⅰ和IGF-ⅠR的基因表達量時,通過特異性引物的設計、反應體系的優化等,使目的熔解曲線只有1個特異性峰,由此說明試驗過程中沒有引物二聚體及其他非特異性產物的生成,進而保證qRT-PCR反應的高質量。試驗結果得到的標準曲線R2均在0.990以上,表明拷貝數的log值與Ct之間的線性關系良好,其他非特異性雙鏈干擾較少。結果表明,目的片段成功制備、重組并保持了序列的完整性和特異性,為qRT-PCR表達檢測的順利進行奠定了良好的基礎。
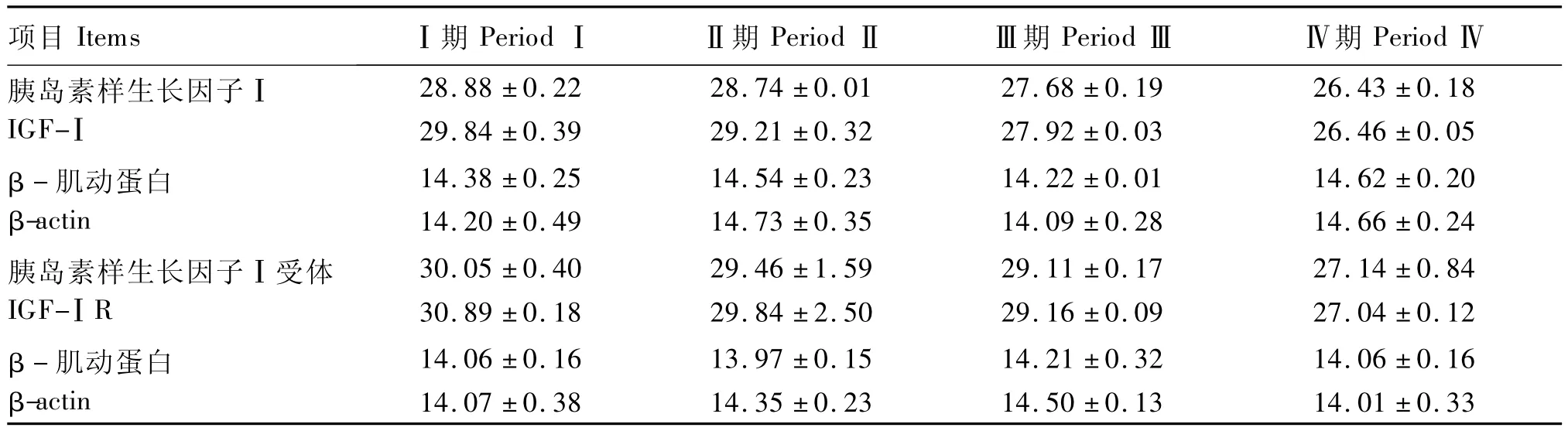
表3 qRT-PCR所測的各樣品的CtTable 3 The Ct values of samples determined by the qRT-PCR

表4 IGF-Ⅰ和IGF-ⅠR qRT-PCR定量結果Table 4 The results of qRT-PCR of IGF-Ⅰ and IGF-ⅠR
IGF-Ⅰ是一種合成代謝激素,在動物體內各組織器官中均有該基因的表達產物,可促進細胞對氨基酸和葡萄糖的攝取,增加蛋白質、脂肪和糖原合成,刺激DNA復制和細胞增殖分化,對許多組織細胞增殖、分化起調節作用,是動物生長發育過程中一種重要的生長因子。IGF-Ⅰ的功能主要依靠與IGF-ⅠR結合來執行,IGF-ⅠR廣泛分布于多種組織及培養細胞中,在新生犢牛瘤胃上皮細胞[10]和青年山羊瘤胃上皮細胞均存在 IGF-Ⅰ和IGF-ⅠR的基因表達。IGF-Ⅰ的基因表達受到生長激素、營養狀態等因素的調控,營養素對IGF-Ⅰ具有直接調控作用,飼糧中蛋白質水平對IGF-Ⅰ的基因表達有顯著影響,營養不良時,肝臟、肌肉等組織中 IGF-Ⅰ的基因表達發生變化,血液中IGF-Ⅰ水平降低[11-12]。飼糧蛋白質水平低于生長需要時,大鼠[13]及肥育豬[14]血漿 IGF-Ⅰ濃度均下降。本試驗結果顯示隨著飼糧NFC/NDF增高,即飼糧營養水平逐漸增加時,瘤胃上皮細胞中IGF-Ⅰ和IGF-ⅠR的基因表達量均呈現不同程度的增加,特別是在NFC/NDF為2.58時,IGF-Ⅰ的基因表達量是試驗初期的9.61倍,而IGF-ⅠR的基因表達量也是試驗初期的10.19倍,這不僅說明高營養飼糧有利于促進瘤胃上皮細胞IGF-Ⅰ的基因表達,同時也說明IGF-Ⅰ和 IGF-ⅠR的基因表達具有很好的一致性,這有助于IGF-Ⅰ更好的發揮其生物學功效。
IGF-Ⅰ對動物胃腸道的發育和更新具有重要的調節作用。口服重組人胰島素樣生長因子Ⅰ(rhIGF-Ⅰ)有助于新生反芻動物胃腸道的生長發育。而體外培養的瘤胃上皮細胞經IGF-Ⅰ處理后,細胞分裂加快,細胞DNA合成增多,促進了細胞增殖。體內外試驗都表明IGF-Ⅰ對瘤胃上皮的生長發育具有促進作用。本試驗結果中IGF-Ⅰ和IGF-ⅠR的基因表達量隨飼糧NFC/NDF的增加而增加。試驗過程中,由于瘤胃體積較大,取材部位與取材標準會對試驗產生很大影響,因此在取材的過程中為統一定位,每次采取瘤胃后腹盲囊靠近后溝處組織作為研究對象。在此過程中我們發現前2期瘤胃上皮乳頭的長度和密度沒有明顯的區別,瘤胃黏膜上密布著棕褐色扁平而凸起的乳頭。到Ⅲ期時,視覺上可見瘤胃上皮乳頭長度比Ⅰ、Ⅱ期有所增加,乳頭密度沒有太大變化,但Ⅳ期時,瘤胃上皮乳頭長度與前幾期相比變短,乳頭密度變稀疏,且在某些部位出現損傷和脫落現象。之前報道IGF-Ⅰ具有促進瘤胃上皮乳頭生長的作用,而本試驗出現的這種結果與之相反。由課題組前期研究可知出現瘤胃上皮損傷的主要原因是飼糧 NFC/NDF為2.58時,試驗動物發生SARA,瘤胃內VFA大量堆積,瘤胃液pH急劇下降[15],瘤胃上皮細胞長時間浸潤在高滲和低 pH環境下導致的。而此時瘤胃上皮細胞IGF-Ⅰ和IGF-ⅠR的基因表達量均大大增加,有利于瘤胃上皮細胞對VFA的吸收,也可能是瘤胃內環境穩定性遭到破壞時動物機體的一種代償表現。同時研究發現,SARA狀態時,丁酸濃度顯著升高是導致瘤胃總揮發性脂肪酸(TVFA)濃度升高的主要因素,瘤胃中VFA蓄積增多對SARA發生起著決定性作用。當給瘤胃灌注丁酸后,血漿胰島素濃度升高,瘤胃上皮細胞分裂增強[16]。因此推測丁酸濃度的增加可能會刺激瘤胃上皮細胞IGF-Ⅰ和IGF-ⅠR的基因表達,以促進瘤胃上皮細胞生長并且增加瘤胃上皮細胞對丁酸的吸收,以此來減弱酸性環境對瘤胃的損傷。
4 結論
以提高飼糧NFC/NDF的方法逐漸誘導SARA,IGF-Ⅰ及 IGF-ⅠR 的基因表達量顯著提高,SARA發生后,它們的表達量有大幅增加。
[1]OWENS F N,SECRIST D S,HILL W J.Acidosis in cattle:a review[J].Journal of Animal Science,1998,76:275-286.
[2]何軍,陳代文.反芻動物瘤胃上皮發育規律及影響因素[J].中國草食動物,2007,27(5):56-58.
[3]BERGMAN E N.Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J].Physiological Reviews,1990,70:1580 - 1588.
[4]SHEN Z,SEYFERT H M,LOHRKE B,et al.An energy-rich diet causes rumen papillae proliferation associated with more IGF typeⅠreceptors and increased plasma IGF-Ⅰ concentrations in young goats[J].The Journal of Nutrition,2004,134:11 -7.
[5]曾求生.日糧營養水平對山羊瘤胃、瓣胃上皮生長及SCFA濃度的影響[D].碩士學位論文.南京:南京農業大學,2006.
[6]NRC.Nutrient requirements of goats:angora,dairy and meat goats in temperate and tropical countries[S].Washington,D.C.:National Academy Press,1981.
[7]金公亮.奶山羊飼養標準[J].畜牧獸醫雜志,1989,2:7-12.
[8]龔虹.羊乳腺中IGF-Ⅰ與其受體基因表達量的相關性研究[D].碩士學位論文.呼和浩特:內蒙古農業大學,2007.
[9]LIVAK K J,SCHMITGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod[J].Methods,2001,25:402 -408.
[10]ONTSOUKA E C,HAMMON H M,BLUM J W.Expression ofinsulin-like growth factors(IGF)-Ⅰand-Ⅱ,IGF-binding proteins-Ⅱ and -Ⅲ,and receptors for growth hormone,IGF type-Ⅰ and -Ⅱ and insulin in the gastrointestinal tract of neonatal calves[J].Growth Factors,2004,22(l):63 - 69.
[11]BREIER B H.Regulation of protein and energy metabolism by the somatotropic axis[J].Dourest Animal Endocrinol,1999,17(23):209 -218.
[12]SIMMEN F A,BADINGA L,GERRN M L,et al.The porcine insulin-like growth factor system:at the interface of nutrition,growth and reproduction[J].The Journal of Nutrition,1998,128(2):315S -320S.
[13]MACRAE J C.Regulation of protein metabolism[R]//Rowett research institute annual report.[S.l.]:Rowett Research Institute,1992:84 -90.
[14]WHANG K Y,DONOVAN S M,EASTER R A.Effects of protein deprivation on subsequent efficiency of dietary protein utiliza-tion in finishing pigs[J].Asian-Austrilia Journal of Animal Science,2000,13:659-665.
[15]韓昊奇,劉大程,高民,等.日糧不同NFC/NDF比對奶山羊瘤胃微生物及瘤胃pH變化的影響[J].動物營養學報,2011,23(4):597 -643.
[16]NEOGRADY Z,GALFI P,KUTAS F.Effect of intraruminal butyrate infusion on the plasma insulin level in sheep[J].Acta Veterinaria Hungarica,1989,37(3):247-53.

