實驗性變態反應性腦脊髓炎大鼠正中隆起室管膜細胞的變化及意義
劉 梅,曹翠麗,馬常升,王麗梅,王榮耕
(1河北醫科大學西山校區,石家莊 050200;2河北醫科大學基礎醫學研究所神經生物學研究室;3河北科技大學理學院)
實驗性變態反應性腦脊髓炎(EAE)的主要病理損害是脫髓鞘、血管周和腦室周圍的炎細胞浸潤及血腦屏障的破壞[1],是人類自身免疫性疾病多發性硬化的經典動物模型,對臨床神經免疫學的研究起重要作用[2]。室周器官(CVOs)是指位于第三、四腦室壁上缺少血腦屏障的8個微小器官,它們是血攜免疫信息分子(如細胞因子等)優先入腦位點[3],在體內參與神經內分泌和神經免疫的調節。正中隆起(ME)是重要的CVOs之一,位于下丘腦內側基底部,前后介于視交叉與垂體柄之間,正上方為第三腦室,腔面為室管膜細胞。2008年2月~2009年2月,我們采用光鏡觀察EAE大鼠不同時期ME室管膜細胞的變化及定位,進一步利用透射電鏡觀察室管膜細胞超微結構的改變,旨在探討其在EAE發病中可能的作用。
1 材料與方法
1.1 材料 選擇健康雌性Wistar大鼠20只,體質量180~200 g,普通環境飼養,保證12 h光照,12 h黑暗;成年豚鼠10只,體質量(400±20)g,由河北省實驗動物中心提供。20只大鼠隨機分為實驗組15只和對照組5只。
1.2 實驗方法 參考文獻[4]以豚鼠脊髓勻漿和完全福氏佐劑制備免疫抗原(同時加入百日咳桿菌以增加EAE的發病程度)[5],實驗組予四肢足墊內一次性接種制作,成功標準:免疫后14~16 d發病,癥狀體征評分4分,表現為體質量減輕,食欲減退,肢體麻痹,人為將鼠翻倒后不能復位,伴或不伴有小便失禁;5分為瀕死狀態。癥狀再持續5~7 d后體征自然緩解。本實驗動物體征評分、病理結果等均符合急性EAE診斷標準,死亡率極低。對照組四肢足墊內注射生理鹽水0.4 ml。實驗組于注射后7 d(潛伏期)、14 d(發病極期,表現為肢體麻痹,人為將鼠翻倒后不能復位或瀕死狀態)、21 d(恢復期,發病后癥狀緩解者,能自如活動)分別隨機選擇5只處死,對照組于實驗21 d處死。
1.3 室管膜細胞觀察 ①光鏡:動物麻醉,常規經心灌注固定,取出整腦,冠狀方向去除視交叉前和漏斗柄后部分,取中間腦組織在4%多聚甲醛磷酸緩沖液(4 ℃)后固定24 h,然后 PBS(0.1 M,pH 7.2)沖洗3次,梯度酒精脫水,入二甲苯透明,浸蠟包塊,用Leica石蠟切片機切片,取ME部位撈片,60℃烤箱過夜。然后依次脫蠟,梯度酒精脫水,HE染色,透明封片,室溫干燥后,顯微鏡觀片,Olympus萬能顯微鏡照相。②透射電鏡:同上法取下腦塊,將腦腹面向上,于視交叉兩側各1 mm平行做兩道矢狀切口,向后至漏斗柄處做一冠狀切口,在距離腦底面3 mm處做一平行切口,取下組織即含ME,光鏡定位,觀察時腹面朝下,取ME組織塊1.0 mm×1.0 mm×2.0 mm,2.5%戊二醛前固定,然后投入1%四氧化鋨作后固定,Epon812包埋,LKB-V型超薄切片機切片,覆蓋于銅制載網,同一樣品分別制作單孔和多孔各2張銅網,醋酸鈾、拘椽酸鉛染,日立T-7500N透射電鏡觀察照相。
1.4 統計學方法 采用攝像機將切片組織圖像輸入計算機,隨機選取ME 5個不重疊視野,采用華東理工大學自動免疫組化分析系統Version2.0自動分析儀記錄細胞。數據以表示。應用SPSS10.0軟件包進行統計處理。采用單因素方差分析,有顯著差異者用q檢驗進行兩兩比較。檢驗水準α=0.05。
2 結果
2.1 光鏡觀察 光鏡下,對照組室管膜帶室管膜細胞排列整齊,呈單層或雙層,較稀疏,100×100 μm2細胞數為(12.8±1.2)個(圖①)。實驗組7 d室管膜帶室管膜細胞數目增多,排列密集,約3~5層,不規則,100 ×100 μm2細胞數為(28.2 ±1.6)個(圖②);14 d室管膜帶室管膜細胞數目明顯增多,約5~7層以上,100 ×100 μm2細胞數為(37.3 ±3.1)個(圖③),21 d室管膜帶室管膜細胞數目與對照組相近,呈單層或雙層排列,100×100 μm2細胞數為(13.6 ±1.3)個。實驗組 14 d 每 100 ×100 μm2細胞個數明顯高于7 d,P 均 <0.01。

圖1 光鏡下室管膜帶室管細胞
2.2 透射電鏡觀察 對照組室管膜細胞腦室面可見微絨毛和微突起,核染色質疏松,細胞之間可見緊密連接(圖④)。實驗組7 d室管膜細胞腦室面可見微絨毛和微突起,室管膜細胞出現不同的分泌現象:有的分泌顆粒呈蘑菇形,均質狀,最大徑4.0 μm,無膜包裹(圖⑤);有的分泌顆粒結構疏松,顆粒內有大小不一的有膜囊泡,小的直徑60 nm,大的直徑180 nm,囊泡呈空泡狀,約有40~50個有膜囊泡,并可見分泌物質釋放彌散(圖⑥)。14 d室管膜細胞腦室面微絨毛變短、稀疏。室管膜細胞內線粒體形態腫脹,呈圓形、卵圓形,集中于細胞游離面。細胞內可見溶酶體吞噬現象。并觀察到室管膜細胞向外凸起,形成長橢圓形分泌顆粒,分泌顆粒有胞膜,最大徑約2.5 μm,其內有點狀顆粒,未見空泡,質地均勻,分泌顆粒有的部位胞膜破潰(圖⑦)。21 d室管膜細胞腦室面微絨毛仍較少,細胞核清晰,形態較規整,與對照組接近。
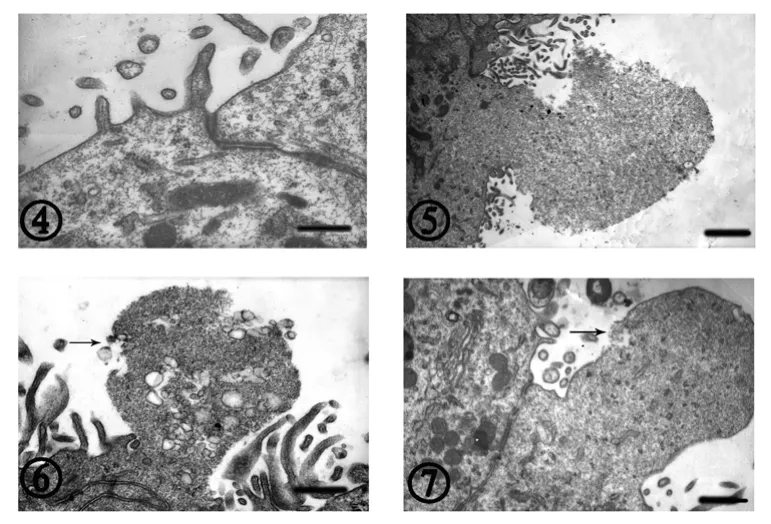
圖2 電鏡下ME室管膜細胞
3 討論
ME是腦脊液經第三腦室流入第四腦室的必由之路,從其部位、血管和神經聯系分布來看,對腦脊液成分,尤其是免疫信息分子具有重要的監控作用,是下丘腦—垂體—內分泌軸上傳下達的關鍵點[3],當機體免疫狀態改變時會發生形態學變化,被認為在腦脊液與垂體門脈之間進行物質轉運,對垂體行使某種調控作用[6]。
呂佩源等[7]發現,血管性癡呆小鼠ME的室管膜細胞表面凹凸不平,分泌顆粒明顯減少,有皺縮現象,存在著超微結構的損傷;宋春風等[8]認為,大鼠肌肉注射醋酸可的松后,下丘腦ME室管膜細胞出現孔洞樣變化,微絨毛結構和分布異常;一氧化氮是神經系統中的信使分子,朱進霞等[9]證實ME外側帶有一氧化氮合酶陽性神經元,說明其在激素釋放和遞質的轉運中起重要作用。
本研究發現,ME室管膜帶細胞在EAE的不同時期有所改變,光鏡下潛伏期出現細胞數目增多,發病極期達到高峰,恢復期基本接近正常,其變化特點與EAE發病程度相一致;透射電鏡下潛伏期時EAE還未發病,而ME室管膜細胞即出現分泌顆粒,提示有分泌物質進入腦脊液;發病極期分泌功能旺盛,恢復期基本正常,與EAE疾病進程相一致,此形態變化顯示ME在EAE時發生病理改變早于臨床癥狀出現,且與病情進展程度呈正相關,提示該處細胞對免疫物質刺激敏感,室管膜細胞的分泌物參與了疾病進程。由此我們推斷,在EAE發病過程中,血液中激活的T淋巴細胞及其分泌物質優先通過血—腦脊液途徑進入腦脊液,經免疫—神經—內分泌網絡處理后引起ME分泌;ME分泌物質進入腦脊液,通過腦脊液—腦通路入腦,激發引起腦室周的炎性反應,此與文獻報道相一致[6];此外ME所感受的信息又可以傳入垂體前葉,激發下丘腦—垂體—腎上腺軸,分泌腎上腺皮質激素,使機體免疫功能受抑制,反饋減少ME室管膜細胞的分泌,使恢復期細胞的形態結構基本恢復正常,說明ME室管膜細胞參與了腦內的免疫物質傳遞,從而對機體的自身免疫性反應進行調節,在免疫—神經—內分泌網絡中起重要作用。
總之,ME在EAE時發生病理改變早于臨床癥狀發生,且與病情進展程度呈正相關,提示其可能參與了腦的免疫調節。
[1]Linker RA,Sendtner M,Gold R.Mechanisms of axonal degeneration in EAE-lessons from CNTF and MHC I knockout mice[J].Neurol Sci,2005,233(1-2):167-172.
[2]Behi ME,Dubucquoi S,Lefranc D,et al.New insights into cellresponses involved in experimental autoimmune encephalomyelitis andmultiple sclerosis[J].Immunol Lett,2005,1(1):11-26.
[3]Gaillard RC.Interaction between the hypothalamo-pituitary-adrenal axis and the immunological system[J].Ann Endocrinol,2001,62(2):155.
[4]董梅,劉瑞春,郭力,等.Wistar大鼠多病程實驗性變態反應性腦脊髓炎的模型建立[J].中國免疫學雜志,2006,22(1):78-81.
[5]林嘉友.實驗性變態反應性腦脊髓炎動物模型[J].中國神經免疫學和神經病學雜志,2003,10(1):33-34.
[6]楊天祝,賈漪濤,馬常升,等.大鼠室周器官的形態學觀察[J].河北醫科大學學報,2002,23(3):129-132.
[7]呂佩源,尹昱,王麗,等.血管性癡呆小鼠第三腦室室管膜掃描電鏡特征觀察[J].中國醫學物理學雜志,2004,21(5):144-146.
[8]宋春風,尹桂山,李向印,等.糖皮質激素對正中隆起室管膜細胞的影響[J].電子顯微學報,2000,19(3):253-254.
[9]朱進霞,周明付,張華,等.一氧化氮合酶陽性神經元在大鼠下丘腦的分布[J].河南醫科大學學報,1996,31(2):42-44.

