辣椒素類物質生物合成途徑及其相關基因研究進展
吳智明 程蛟文 唐 鑫 胡開林*
(1仲愷農業工程學院園藝園林學院,廣東廣州 510225;2華南農業大學園藝學院,廣東廣州510642)
辣椒(CapsicumannuumL.)通常具有特殊的辛辣味,這主要是由于其果實中含有特殊的以辣椒素(capsaicin)為主的辣椒素類物質(capsaicinoids)。辣椒素的含量是評估辣椒果實品質性狀的重要指標之一,同時辣椒素在當今食品(Perkins et al.,2002)、醫藥(Liu & Nair,2010)、軍事(Reilly et al.,2001)和農藥(劉新和林永,2003)等領域的應用也非常廣泛,因此對于辣椒素的研究一直是農業、工業和醫療領域的熱點。
辣椒素類物質的生物合成與積累主要受遺傳基因控制,但同時也受到發育與外界環境條件的影響,不同辣椒品種或同一辣椒品種不同的生長發育階段在辣度上均表現出很大的差異(Kozukue et al.,2005;Mueller-Seitz et al.,2008;李光光 等,2010)。了解辣椒素類物質在辣椒果實中的生物合成途徑及其主要基因的功能,以及基因的表達調控機制,有助于人工調控辣椒素類物質的生物合成,對辣椒優質新品種選育具有重要的實踐意義。
1 辣椒素類物質的種類
辣椒素最早是由Thresh在1876年從辣椒果實中分離出來的。1919年,Nelson(1919)報道了辣椒素的結構,并命名為8-甲基-6-癸烯香草基胺,分子式為C18H27NO3,是一種含香草酰胺的生物堿。此后,又有一些辣椒素的同系物相繼從辣椒果實中被發現,統稱為辣椒素類物質。所有辣椒素類物質都是C9~C11支鏈脂肪酸和香草基胺合成的酰氨化合物,不同辣椒素類物質的主要差異在于脂肪側鏈長度、是否存在雙鍵、分支點和相對辣度。據報道,迄今為止己發現近20種辣椒素類物質(Mazourek et al.,2009),主要包括辣椒素、二氫辣椒素(dihydrocapsaicin)、降二氫辣椒素(nordihydrocapsaicin)、高二氫辣椒素(homodihydrocapsaicin)和高辣素(homocapsaicin)等,5種主要的辣椒素類物質及其相關特性見表1。后來,又在甜椒果實中發現兩種無辣味的類辣椒素物質(capsaicinoid-like substance,CLS):辣椒素酯(capsiate)和二氫辣椒素酯(dihydrocapsiate),辣椒素酯具有與辣椒素類物質相同的側鏈脂肪酸,但芳香成分卻被香莢蘭醇(vanillyl alcohol)代替,有學者推測其可能是辣椒素類物質合成的前體物(Kobata et al.,1998)。
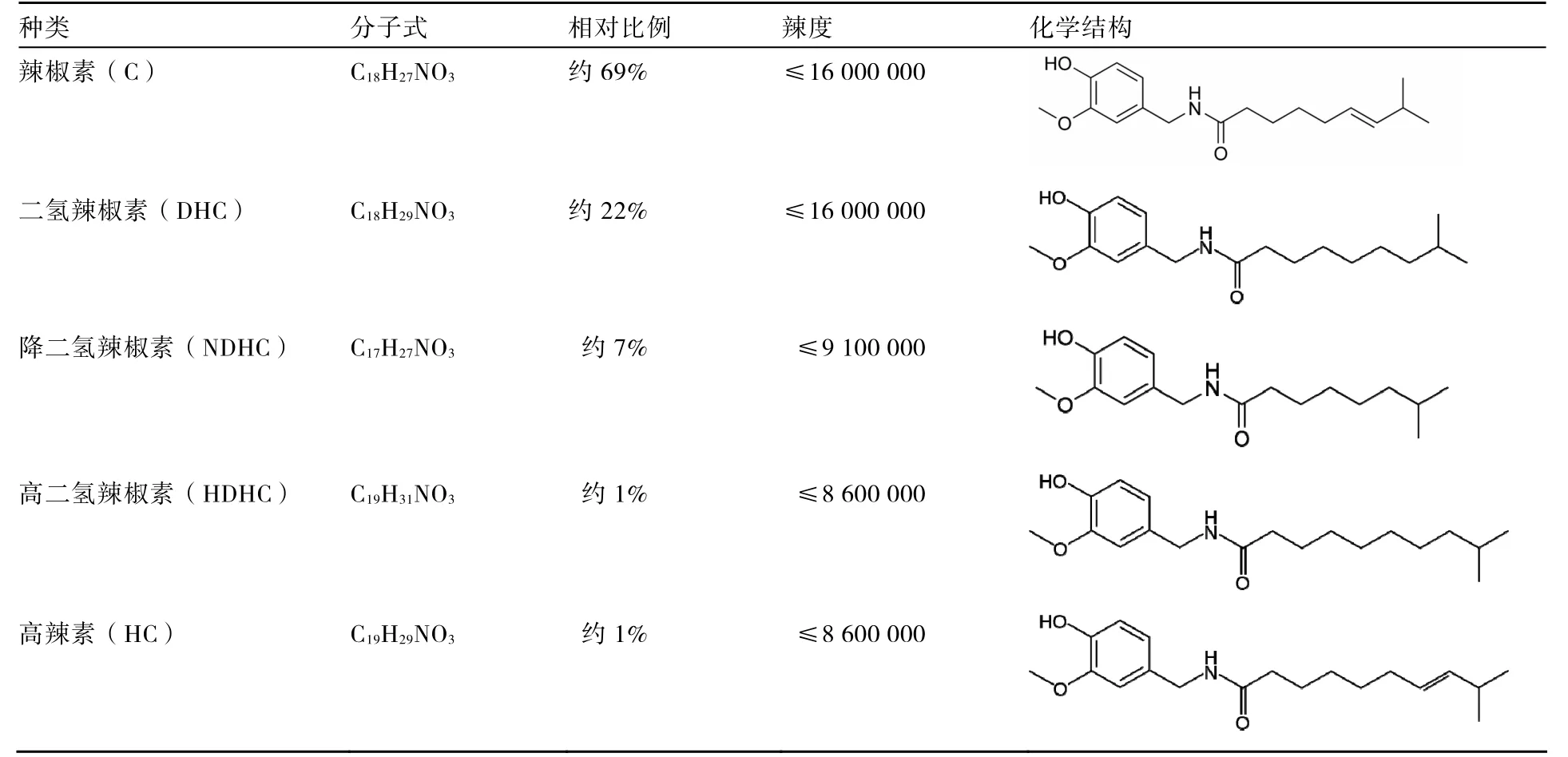
表1 辣椒素類物質包含的主要種類及其特性
2 辣椒素類物質的生物合成
前期對辣椒素類物質在辣椒植株中的合成部位存在一定的爭議。20世紀 60年代,有學者認為種子是辣椒素類物質的合成部位,也有學者則認為子房隔膜上的有些腺體細胞可以分泌辣椒素。1979年,Iwai等(1979)采用同位素示蹤技術,研究認為辣椒素類物質在辣椒果實的胎座中積累。進一步研究結果表明,辣椒素主要在果實胎座表皮細胞的液泡中形成和積累,再通過子房膜(壁)運輸到果肉表皮細胞的液泡中積累起來。辣椒素在果實不同部位的含量不同,胎座中的辣椒素含量最高,果肉次之,種子最低(Estrada et al.,2002),而果皮中的辣椒素以果實中段最多,近萼片端次之,近尖端最少(鄒學校,2002)。對于辣椒素在辣椒果實中的合成時期,目前普遍認為,絕大多數的辣椒品種中辣椒素類物質的生物合成發生在開花后約20 d(Iwai et al.,1979)。
辣椒素類物質的生物合成途徑相當復雜,這也導致了辣椒素類物質的多樣性。關于辣椒素類物質的生物合成途徑的研究始于20世紀60年代末。研究者通過同位素示蹤技術研究辣椒素類物質合成的前體,發現部分香草基胺的合成前體是苯丙氨酸,而支鏈脂肪酸源于纈氨酸(Bennett & Kirby,1968;Leete & Louden,1968)。由此推測辣椒素類物質生物合成途徑包含兩條途徑:以苯丙氨酸為前體的苯丙烷途徑和以纈氨酸或亮氨酸為前體的支鏈脂肪酸途徑。最近,Mazourek等(2009)在前人的研究基礎上全面、詳細總結了辣椒素類物質的生物合成途徑,并建立了辣椒素類物質生物合成模型(CapCyc Model)(圖1):辣椒素類物質生物合成起始于莽草酸途徑(shikimate pathway),在質體中先形成分支酸(chorismate)(步驟①),然后合成苯丙氨酸(phenylalanine)(步驟②);在內質網上,苯丙氨酸轉變為羥基肉桂酰輔酶A(feruloyl-CoA)(步驟③),隨后由羥基肉桂酰輔酶 A裂解酶催化合成香草基胺(vanillylamine)(步驟④)。丙酮酸酯是纈氨酸的合成前體(步驟⑤),隨后纈氨酸被轉運到線粒體中催化合成異丁酰基-CoA(isobutyryl-CoA)(步驟⑥);合成的異丁酰基-CoA再轉運到質體中,在脂肪酸合酶催化下合成8-甲基-6-壬烯酸(8-methyl-nonenoic acid)(步驟⑦);8-甲基-6-壬烯酸從質體轉運到細胞質過程中合成硫代酸酯-CoA(8-methylnonenoic-CoA)。最后,硫代酸酯-CoA和香草基胺在辣椒素合成酶(CS)催化下合成辣椒素(步驟⑧),然后轉運出細胞。
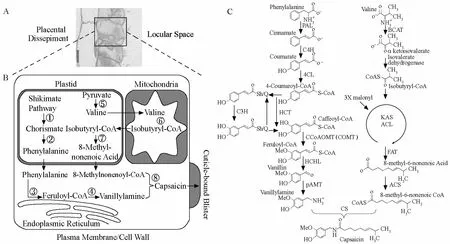
圖1 細胞中辣椒素類物質生物合成示意圖及合成途徑
3 辣味基因的標記與QTL定位
早期的遺傳學研究認為,辣椒辣味的產生是由單一顯性基因C(Pun1)控制的,在純合隱性基因c(pun1)作用下表現為辣味缺失,并且該基因對所有其他的辣味相關基因具有上位作用(Greenleaf,1952)。Tanksley等(1988)最先找到了一個與C基因連鎖的分子標記CD35,但遺傳距離大于10 cM。Ben-Chaim等(2001)最先將C基因位點定位于辣椒的第2號染色體上。后來,Blum等(2002)以甜椒品種Maor(Capsicum annuum)與高辣辣椒BG2816(Capsicum frutescens)為親本,構建了包含242個單株的F2群體,通過RFLP標記方法,遺傳作圖證實C基因位于第2號染色體上,并首次獲得了與C基因緊密連鎖的3個RFLP標記和1個離C基因位點僅0.4 cM的CAPS標記。隨后,Blum等(2003)在前期構建的F2群體基礎上,利用BSA法篩選到3個在不辣基因池與辣味基因池之間表現多態性的RAPD標記位點,通過成功轉換成SCAR標記后,將其中的一個主效QTL位點cap定位于辣椒的第7號染色體上,實驗證明該QTL位點可解釋在不同生境條件下表型變異的34%~38%。Lee等(2005)在一年生辣椒(Capsicum annuum)中分離到一個與C基因共分離的辣椒素合成酶基因(Capsaicin Synthase,CS),序列分析表明甜椒的CS基因5’上游區域存在一段2529 bp堿基缺失。
Ben-Chaim等(2006)以微辣辣椒品種 NuMex RNaky(Capsicum annuum)與高辣品種BG2814-6(Capsicum frutescens)為親本,構建了包含396個單株的F2群體及相應的F3群體,同時構建了包括 SSR、AFLP、RFLP共 728個標記的分子圖譜,找到了 6個與辣椒素類物質含量相關的QTL位點,并分別定位于第 3、4和 7號染色體上。分析表明,辣椒素類物質含量表型變化主要貢獻(24%~42%)來自于主效QTL位點cap7.1和定位于2號染色體無主效作用的標記(NP0326)間的二基因作用,而QTL位點cap7.2很可能是Blum等(2003)證實的對辣椒素類物質含量有顯著影響的QTL位點cap。Stewart等(2007)在C. chinense辣椒中發現了一個Pun1基因的等位基因位點,并命名為pun12。序列分析發現pun12位點存在4個堿基缺失,導致編碼的蛋白質發生移碼突變,最終導致辣椒辣味的散失。王巖等(2007)通過同源克隆法,從不同基因型辣椒中克隆了C基因的全長,序列比對分析證實,甜椒C基因5’端約689 bp的堿基缺失可能是造成其辣味散失的原因。最近,Stellari等(2010)又在另一個辣椒種Capsicum frutescens中發現了新的等位基因位點pun13,實驗證明pun13轉錄本的缺失與辣椒辣味的散失相關。Wyatt等(2012)在前人研究基礎上發展了一套標記,用以區別不同辣椒種中Pun1、pun11、pun12和pun13基因型,這些標記的獲得為辣椒種質資源的鑒定與辣椒育種提供了很好的參考。
4 辣椒素類物質生物合成過程中基因的克隆
辣椒素的合成與累積除受結構基因C影響外,還受到諸多調控基因的控制。為了通過基因工程方法調控辣椒素的含量,探討辣椒素生物合成的分子機理,研究者長期以來對辣椒素生物合成途徑中的相關基因進行了克隆,并研究了相關基因表達與辣味之間的關系。到目前為止,已克隆的與辣椒素類物質生物合成相關的酶類基因超過50種(表2)。
其中,Curry等(1999)最先從轉錄水平檢測了不同基因型辣椒果實發育過程中辣椒素合成相關酶的表達,從辣椒(C. chinense)胎座cDNA文庫中篩選獲得了參與辣椒素合成的3個特異酶基因:苯丙氨酸裂解酶(Pal)、肉桂酸羧化酶(Ca4h)和咖啡酰輔酶A氧甲基轉移酶(Comt),研究表明,在辣椒果實發育過程中,這些基因的轉錄水平與辣椒素合成量呈正相關。Kim等(2001)利用抑制差減雜交(SSH)技術獲得了4個與辣椒素代謝有關的基因片段。序列比對分析發現,這些片段與氨基轉移酶(pAMT)、3-氧酰基〔酰基載體蛋白〕還原酶(Kas)、乙酰基轉移酶(AT)、脂肪酸乙醇氧化酶(FAO)序列有較高同源性,這些基因在辣椒果實胎盤中特異表達,表達水平與辣椒素積累具有相同的模式。Aluru等(2003)研究脂肪酸合成酶復合物組成因子與辣味關系,通過差顯的方法克隆了Kas、酰基載體蛋白(Acl)和硫酯酶(Fat)基因,并分別將它們定位于第1、1和6連鎖群,實驗證明KAS蛋白的積累與辣椒辣味呈正相關。Stewart等(2005)在Kim等(2001)分離的一個 EST(SB2-66)基礎上,通過RACE方法獲得了Pun1基因全長,并將其命名為AT3。研究認為Pun1基因編碼一個在辣椒素合成過程中非常重要的酶,它可能是一個乙酰基轉移酶。研究發現,AT3活性和表達量與辣味積累呈正相關,免疫方法證實AT3特異性定位到辣椒果實胎座,說明AT3可能是辣椒素生物合成途徑中的關鍵基因。同時他們提出早期在Capsicum annuum的馴化中,決定不辣的Pun1位點上的缺失可能在種間廣泛存在。Lee等(2006)從表達差異蛋白角度入手,綜合采用蛋白質組學方法,研究了辣味和無辣味辣椒果實胎座組織抽提物中蛋白質表達的差異,結果表明 22個蛋白點在辣味辣椒中強烈表達,在無辣味辣椒果實胎座中則沒有相對應的蛋白點。del Rosario Abraham-Juarez等(2008)利用病毒誘導的基因沉默(VIGS)技術研究了Comt、pAMT和Kas基因表達水平與辣椒素的積累量關系,其中任何一個基因的沉默都會導致辣椒素含量的急劇下降。Lang等(2009)研究發現甜椒 CH-19是由有辣味辣椒pAMT基因在1291 bp處插入了一個堿基T,產生新的終止密碼子TGA突變得到的。最近,Mazourek等(2009)定位并克隆了幾十種辣椒素類物質生物合成過程中相關的酶類基因,如表2所示。
5 展望
辣椒素作為辣椒重要品質性狀和醫藥、工業的重要原料,對其生物合成路徑以及相關基因的表達、辣椒素含量的分子標記研究等都取得了重要進展。但目前的研究還沒有明確辣椒素類物質生物合成路徑的調控機制,包括一些關鍵基因的定位、克隆和調控的分子機理,相關基因啟動子的分離和調控作用。而且,到目前為止,還沒有真正能夠利用基因工程的方法獲得轉基因植株,能自由調控辣椒果實中辣椒素的合成。這些都應該成為下一步研究的重點。
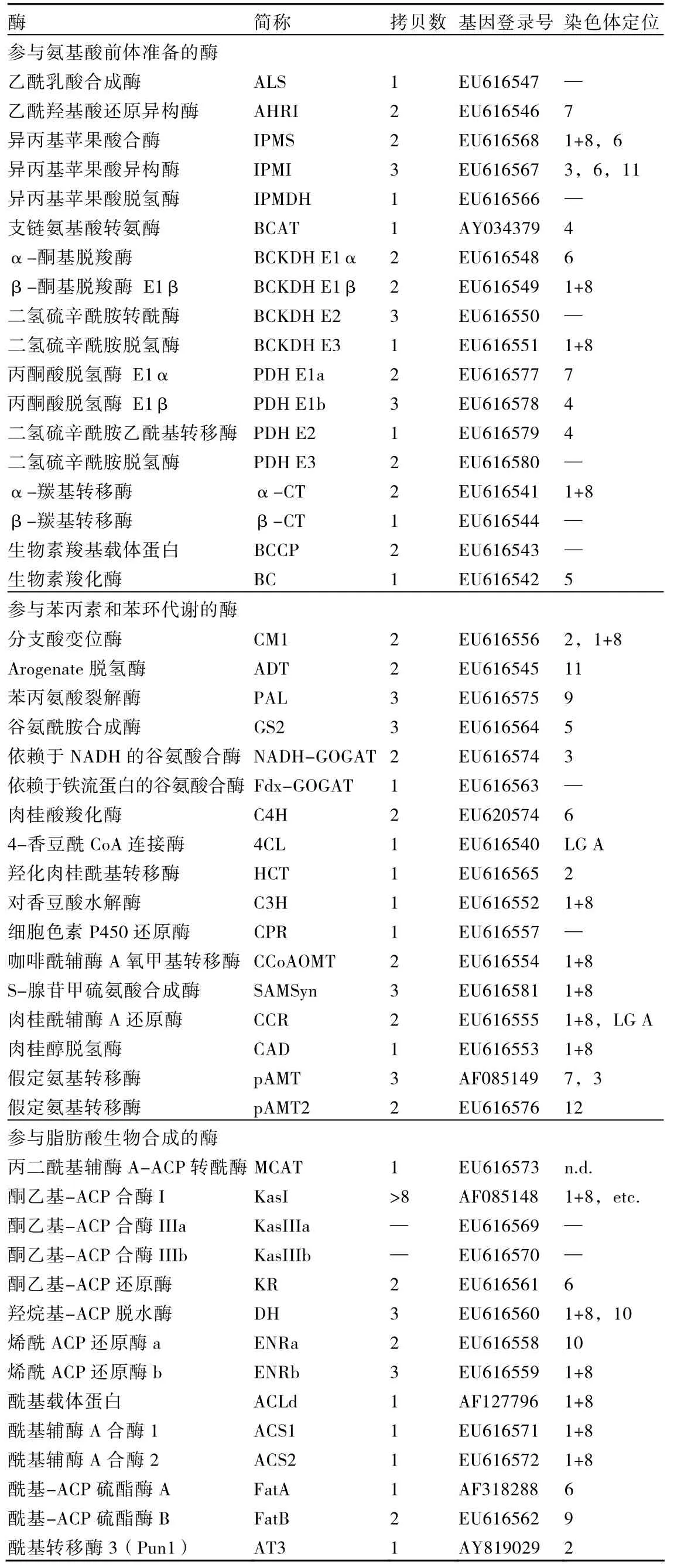
表2 與辣椒素類物質生物合成途徑相關的酶
另外,辣椒素類物質種類繁多,除了辣椒素外其他不同類型的辣椒素類物質的生物合成過程還不清楚,而且一些環境因子如光照、溫度、水分、肥料等在辣椒素的生物合成與積累過程中起著非常重要的作用,這些環境因子是如何影響辣椒素在果實中的合成的分子機理還值得進一步深入研究。
李光光,陳國菊,曹必好,張財順,雷建軍.2010.不同辣椒基因型辣椒素的積累特性.中國蔬菜,(24):31-35.
劉新,林永.2003.辣椒堿對桃蚜的生物活性及其與幾種殺蟲劑的聯合作用.農藥學學報,5(2):94-99.
王巖,張寶璽,張延國,張國裕,王立浩,徐有明,王曉武.2007.辣椒C基因全長序列比較分析.園藝學報,34(1):143-146.
鄒學校.2002.中國辣椒.北京:中國農業出版社.
Aluru M R,Mazourek M,Landry L G,Curry J,Jahn M,O'Connell M A.2003.Differential expression of fatty acid synthase genes,Acl,FatandKas,inCapsicumfruit.Journal of Experimental Botany,54(388):1655-1664.
Aza-Gonzalez C,Núňnez-Palenius H G,Ochoa-Alejo N.2011.Molecular biology of capsaicinoid biosynthesis in chili pepper(Capsicumspp.).Plant Cell Reporter,30(5):695-706.
Ben-Chaim A,Paran I,Grube R,Jahn M,van Wijk R,Peleman J.2001.QTL mapping of fruit related traits in pepper(Capsicum annuum).Theoretical Applied Genetics,102:1016-1028.
Ben-Chaim A,Borovsky Y,Falise M,Mazourek M,Kang B C,Paran I,Jahn M.2006.QTL analysis for capsaicinoid content inCapsicum.Theoretical Applied Genetics,113:1481-1490.
Bennett D J,Kirby G W.1968.Constitution and biosynthesis of capsaicin.Journal of the Chemistry Society C,4:442-446.
Blum E,Liu K,Mazourek M,Yoo EY,Jahn M,Paran I.2002.Molecular mapping of the C locus for presence of pungency inCapsicum.Genome,45:702-705.
Blum E,Mazourek M,O'Connell M,Curry J,Thorup T,Liu K,Jahn M,Paran I.2003.Molecular mapping of capsaicinoid biosynthesis genes and quantitative trait loci analysis for capsaicinoid content inCapsicum.Theoretical Applied Genetics,108:79-86.
Curry J,Aluru M,Mendoza M,Nevarez J,Melendrez M,O'Connell M A.1999.Transcripts for possible capsaicinoid biosynthetic genes are differentially accumulated in pungent and non-pungentCapsicumspp.Plant Science,148:47-57.
del Rosario Abraham-Juarez M,del Carmen Rocha-Granados M,Lopez M G,Rivera-Bustamante R F,Ochoa-Alejo N.2008.Virus-induced silencing ofComt,pAmtandKasgenes results in a reduction of capsaicinoid accumulation in chili pepper fruits.Planta,227:681-695.
Estrada B,Bernal M A,Diaz J,Pomar F,Merino F.2002.Capsaieinoids in vegetative organs ofCapsicum annuumL.in relation to fruiting.Journal of Agriculture and Food Chemistry,50(5):1188-1191.
Greenleaf W H.1952.Inheritance of pungency and of the deciduous character in chili(Capsicum annuum).Proc Assoc 8thAgric Workshop,49:110-111.
Iwai K,Suzuki T,Fujiwake H.1979.Formation and accumulation of pungent principle of hot pepper fruits,capsaicin and its analogs,inCapsicum annuunvar.annuumcv.Karayatsubusa at different growth-stages after fl owering.Agricultural and Biological Chemistry,43:2493-2498.
Kim M,Kim S,Kim B D.2001.Isolation of cDNA clones differentially accumulated in the placenta of pungent pepper by suppression subtractive hybridization.Molecular Cells,11(2):213-219.
Kobata K,Todo T,Yazawa S,Iwi K,Watabe T.1998.Novel capsaicinoid-like substances,capsiate and dihydrocapsiate,from the fruits of a nonpungent cultivar,CH-19 sweet,of pepper(Capsicum annuumL.).Journal of Agriculture and Food Chemistry,46:1695-1697.
Kozukue N,Han J S,Kozukue E,Lee S J,Kim J A,Lee K R,Levin C E,Friedman M.2005.Analysis of eight capsaicinoids in peppers and pepper-containing foods by high-performance liquid chromatography and liquid chromatography-mass spectrometry.Journal of Agriculture and Food Chemistry,53(23):9172-9181.
Lang Y,Kisaka H,Sugiyama R,Nomura K,Morita A,Watanabe T,Tanaka Y,Yazawa S,Miwa T.2009.Functional loss ofpAMTresults in biosynthesis of capsinoids,capsaicinoid analogs,inCapsicumannuumcv.CH-19 sweet.Plant Journal,59(6):953-961.
Lee C J,Yoo E,Shin J,Lee J,Hwang H S,Kim B D.2005.Non-pungentCapsicumcontains a deletion in the capsaicinoid synthetase gene,which allows early detection of pungency with SCAR markers.Molecular Cells,19(2):262-267.
Lee J M,Kim S,Lee J Y,Yoo E Y,Cho M C,Cho M R,Kim B D,Bahk Y Y.2006.A differentially expressed proteomic analysis in placental tissues in relation to pungency during the pepper fruit development.Proteomics,6(19):5248-5259.
Leete E,Louden M C L.1968.Biosynthesis of capsaicin and dihydrocapsaicin inCapsicum frutescens.Journal of the American Chemical Society,90:6837-6841.
Liu Y,Nair M G.2010.Capsaicinoids in the hottest pepper Bhut Jolokia and its antioxidant and antiin fl ammatory activities.Natural Products Communication,5:91-94.
Mazourek M,Pujar A,Borovsky Y,Paran I,Mueller L,Jahn M M.2009.A dynamic interface for capsaicinoid systems biology.Plant Physiol,150(4):1806-1821.
Mueller-Seitz E,Hiepler C,Petz M.2008.Chili pepper fruits:content and pattern of capsaicinoids in single fruits of different ages.Journal of Agriculture and Food Chemistry,56(24):12114-12121.
Nelson E K.1919.The constitution of capsaicin-the pungent principle of capsaicin.Am Chem Soc,41:1115-1121.
Perkins B,Bushway R,Guthrie K,Fan T,Stewart B,Prince A,Williams M.2002.Determination of capsaicinoids in salsa by liquid chromatography and enzyme immunoassay.Journal of AOAC International,85:82-85.
Prasad B C,Gururaj H B,Kumar V,Giridhar P,Ravishankar G A.2006.Valine pathway is more crucial than phenyl propanoid pathway in regulating capsaicin biosynthesis inCapsicum frutescensMill.Journal of Agriculture and Food Chemistry,54(18):6660-6666.
Reilly C A,Crouc D J,Yost G S,Fatah A A.2001.Determination of capsaicin,dihydrocapsaicin,and nonivamide in self-defense weapons by liquid chromatography-mass spectrometry and liquid chromatography-tandem mass spectrometry.Journal of Chromatography A,912:259-267.
Stellari G M,Mazourek M,Jahn M M.2010.Contrasting modes for loss of pungency between cultivated and wild species ofCapsicum.Heredity,104(5):460-471.
Stewart C J,Kang B C,Liu K,Mazourek M,Moore S L,Yoo E Y,Kim B D,Paran I,Jahn M M.2005.ThePun1gene for pungency in pepper encodes a putative acyltransferase.Plant Journal,42(5):675-688.
Stewart C J,Mazourek M,Stellari G M,O'Connell M,Jahn M.2007.Genetic control of pungency inC. chinensevia thePun1locus.Journal of Experimental Botany,58(5):979-991.
Tanksley S D,Bernatzky R,Lapitan N L,Prince J P.1988.Conservation of gene repertoire but not gene order in pepper and tomato.Proceedings of the National Academy of Sciences of USA,85:6419-6423.
Wyatt L E,Eannetta N T,Stellari G M,Mazourek M.2012.Development and application of a suite of non-pungency markers for thePun1gene in pepper(Capsicumspp.).Molecular Breeding,30(3):1525-1529.

