花椰菜種子活力和抗氧化酶活性及幼苗光合色素對NaCl脅迫的響應
朱世楊張小玲羅天寬劉慶唐征荊贊革
(溫州市農業科學研究院,浙南作物育種重點實驗室,浙江溫州 325006)
土壤鹽堿化是世界性的環境問題,已成為限制農業生產的重要障礙因子(楊小環 等,2011)。全世界鹽漬土壤面積約占陸地面積的7.6%,我國鹽漬土壤面積約有0.7億hm2(李源 等,2010),并且隨著工業污水的任意排放,化肥的盲目增施及土壤的不科學管理,土壤鹽堿化面積仍在進一步的擴大。如何開發利用如此大面積的鹽堿地資源,對發展國民經濟有著重要的戰略意義。花椰菜(Brassica oleraceaL.var.botrytisL.)為十字花科蕓薹屬甘藍種的一個變種,其營養豐富,味道鮮美,具有抗癌防癌功效,在浙江、江蘇、甘肅、河南等地均有種植,是人們餐桌上重要的蔬菜作物之一(陳珍,2009)。現階段加強花椰菜鹽脅迫的生理生態機制研究,對其在灘涂鹽堿地的開發種植,為廣大老百姓提供高品質健康蔬菜具有重要的指導意義;對開展花椰菜耐鹽種質資源評價及抗鹽品種選育亦具有深遠的參考價值。前人對向日葵(Mehmet et al.,2006)、苜蓿(Wang & Han,2009)和秋葵(Dkhil & Denden,2010)等植物鹽脅迫的研究較多。關于花椰菜,前人在干旱脅迫(陳國菊 等,2002)、高溫脅迫(汪炳良 等,2004)和重金屬脅迫(陳珍,2009)方面有少許研究報道,但花椰菜鹽脅迫的生理生化研究尚未見報道。本試驗初步研究了不同濃度NaCl脅迫強度對花椰菜種子活力和抗氧化酶活性及幼苗光合色素的變化特點,旨在探討花椰菜萌發期鹽脅迫的生理生化機制,為花椰菜鹽堿地開發利用及耐鹽種質篩選提供參考。
1 材料與方法
1.1 試驗材料
試驗材料為2009年5月采收的花椰菜銀農70天自交系種子(10 ℃冰箱中貯藏),由溫州市農業科學研究院生物工程技術研究所花椰菜課題組提供。試驗于2009年12月在本課題組的培養室和細胞與基因工程研究室進行。
1.2 試驗設計與處理
用雙蒸餾水和分析純 NaCl配制 34、68、102、136、170、204 mmol·L-1的 NaCl處理液,對照為雙蒸餾水(0 mmol·L-1)。將兩層濾紙墊入培養皿(Φ=9 cm),加入3 mL NaCl處理液使濾紙飽和吸水后作為發芽床。選取 100粒發育飽滿的種子整齊排列于發芽床上,培養皿蓋上蓋后置于全自動控制的培養室(杭州求是人工氣候環境有限公司設計和安裝)中連續培養7 d。培養室溫度設置為25 ℃,每天光照12 h,黑暗12 h。每天定時更換濾紙和鹽溶液,以保持各處理NaCl濃度不變。發芽試驗4次重復。
1.3 測定指標和方法
1.3.1 種子活力測定 種子萌發期間,每天統計發芽的種子數,2 d統計發芽勢,7 d統計發芽率并測定幼苗鮮質量和干質量(每個處理每次重復測定 10株)。發芽指數和相對鹽害率參考苗春樂等(2008)的方法。

Gt為第t天發芽的種子數,Dt為相應的發芽天數。
1.3.2 抗氧化酶活性和丙二醛(MDA)含量測定 超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)活性和丙二醛含量測定每個處理 3次重復。酶液提取參考 Zhu等(2010)的方法,稱取30粒種子置于相應NaCl處理液中25 ℃萌動24 h后,在-20 ℃預冷的研缽中用6 mL 0.05 mol·L-1pH 7.0磷酸緩沖液研磨成勻漿,然后將提取液15 000 r·min-14 ℃離心20 min,上清液即為酶粗提液,用于SOD、POD和CAT活性及MDA含量的測定(李合生,2000)。
1.3.3 光合色素含量的測定 光合色素含量測定每個處理3次重復。取發芽7 d幼苗子葉0.5 g置于丙酮酒精溶液(乙醇∶丙酮∶H2O=9V∶9V∶2V)中,25 ℃黑暗條件下浸提72 h,浸提液用Unico UV-2802PC紫外可見分光光度計測定葉綠素a(Chla)、葉綠素b(Chlb)和類胡蘿卜素(Car)含量,并計算總的葉綠素含量(Chl)=Chla+Chlb和葉綠素a/b(Chla/Chlb)及Car/Chl的值(李合生,2000;王建成 等,2004)。
1.4 數據分析
對不同 NaCl脅迫濃度下各指標進行單因素方差分析(ANOVA),平均值之間的比較采用LSD檢驗;并對各參數在 NaCl脅迫濃度梯度上的變化趨勢進行曲線擬合。所有數據分析采用Microsoft Excel 2003和方差分析軟件進行。
2 結果與分析
2.1 不同NaCl脅迫濃度對花椰菜種子活力和幼苗干鮮質量的影響
在NaCl脅迫濃度梯度上,花椰菜種子的發芽率、發芽勢和發芽指數變化趨勢基本一致,都隨NaCl脅迫強度增加呈線性降低趨勢(圖1)。發芽率、發芽勢和發芽指數在34~68 mmol·L-1NaCl脅迫下與對照無顯著差異,但102~204 mmol·L-1NaCl脅迫下隨NaCl濃度增加顯著降低。相對鹽害率在NaCl脅迫濃度梯度上呈“倒鐘形”拋物線變化(圖1),其中34 mmol·L-1NaCl脅迫下出現最小值,而102~204 mmol·L-1NaCl脅迫下則比對照顯著增加了8.2%~95.7%。幼苗鮮質量和干質量隨NaCl脅迫濃度呈拋物線變化規律(圖1),NaCl濃度為68 mmol·L-1時出現最大值,分別為42.75、4.50 mg·株-1;在34~102 mmol·L-1NaCl脅迫下幼苗鮮質量和干質量分別較對照增加21.4%~26.6%和21.7%~36.8%,而136~170 mmol·L-1NaCl脅迫下則分別降低15.6%~26.0%和9.5%~32.5%。
2.2 不同NaCl脅迫濃度對花椰菜種子抗氧化酶活性和MDA含量的影響
圖2顯示了不同NaCl脅迫濃度下花椰菜種子抗氧化酶活性和MDA含量的變化情況。由圖2可以看出,不同抗氧化酶活性在NaCl脅迫濃度梯度上的變化趨勢有所不同。SOD活性隨NaCl脅迫濃度梯度遞增呈“鐘形”拋物線變化規律,102 mmol·L-1NaCl脅迫下SOD活性最高,比對照提高了83.8%;而204 mmol·L-1NaCl脅迫下SOD活性則降低了28.4%,差異極顯著。在NaCl脅迫濃度梯度上POD與CAT活性表現出相似的趨勢,呈多項式變化特點,且均在136 mmol·L-1NaCl脅迫下活性最高,分別比對照升高了31.1%和41.5%;而204 mmol·L-1NaCl脅迫下則分別降低了 44.2%和 51.9%,差異極顯著。MDA含量隨 NaCl脅迫濃度增強呈線性遞增趨勢,而且NaCl脅迫濃度越大,MDA含量增加幅度越大,尤其102~204 mmol·L NaCl脅迫下MDA含量比對照增加1.4~3.6倍,差異極顯著。
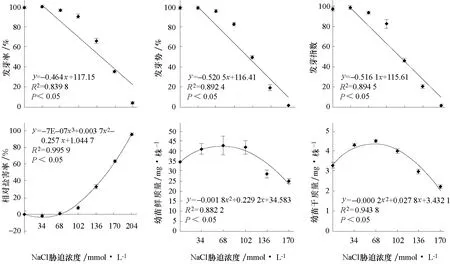
圖1 不同NaCl脅迫濃度下花椰菜種子活力、幼苗干質量和鮮質量的變化
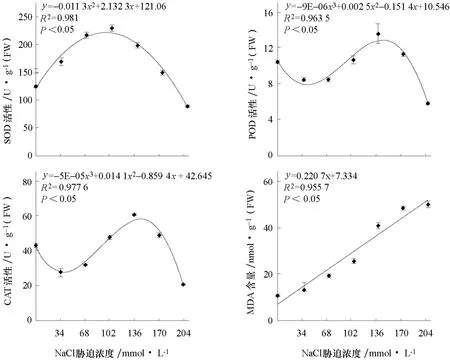
圖2 不同NaCl脅迫濃度下花椰菜種子SOD、POD、CAT活性和MDA含量的變化
2.3 不同NaCl脅迫濃度對花椰菜幼苗光合色素含量的影響
由圖3可看出,花椰菜幼苗子葉中Chla、Chlb、Chl和Car含量隨NaCl脅迫濃度遞增呈拋物線變化;其中Chla、Chlb和Chl含量于102 mmol·L-1NaCl脅迫下出現峰值,分別為7.85、3.82、11.67 mg·g-1(FW),比對照增加了58.4%、87.4%和66.9%,差異極顯著;Car含量則于68 mmol·L-1NaCl脅迫下出現峰值,為1.26 mg·g-1(FW),較對照增加了39.5%,差異極顯著。Chla/Chlb和Car/Chl值在NaCl脅迫濃度梯度上呈線性降低趨勢(圖3),在34~170 mmol·L-1NaCl脅迫下,Chla/Chlb和Car/Chl值分別比對照降低6.7%~23.2%和12.2%~38.9%。

圖3 不同NaCl脅迫濃度下花椰菜幼苗子葉中Chla、Chlb、Chl和Car含量及Chla/Chlb和Car/Chl值的變化
3 結論與討論
種子萌發期是植物生活史中最為關鍵的生長階段,也是其生活史中抗逆性最為薄弱的一個環節(Pujari & Chanda,2002)。鹽脅迫對植物種子造成毒害,降低了種子的發芽率和發芽速度,影響了幼苗的生長和發育(喬紹俊 等,2009)。本試驗中,花椰菜種子發芽率、發芽勢和發芽指數隨鹽脅迫濃度增加呈線性降低變化規律,其中34~68 mmol·L-1NaCl脅迫下各發芽指標較對照無顯著差異,但 136~204 mmol·L-1NaCl脅迫下卻極顯著降低;相對鹽害率在 102~204 mmol·L-1NaCl脅迫下明顯增加;幼苗干、鮮質量雖在34~102 mmol·L-1NaCl脅迫下有所提高,但136~170 mmol·L-1NaCl脅迫下顯著降低。這可能與高濃度NaCl導致種子吸水受抑制而影響種子萌發和幼苗生長有關,亦可能與高濃度NaCl引起的離子毒害作用有關。這與李建設等(2009)在燕麥鹽脅迫研究中的發現類似。
Chla、Chlb、Chl和Car是植物主要的光合色素,它們的含量和比例是反映光合能力的重要指標;Car還是內源抗氧化劑,具有抗氧化功能,能夠防止細胞膜脂過氧化作用(陳健妙 等,2009;秦景 等,2009)。本試驗中,不同NaCl脅迫濃度梯度下,花椰菜幼苗子葉中4種光合色素的含量變化規律一致,在 NaCl脅迫濃度梯度上均呈拋物線的變化趨勢。可能是低濃度 NaCl脅迫下花椰菜通過增加光合色素合成以提高自身的抗鹽性,而高濃度NaCl脅迫強度下光合色素合成受阻,降解加快,從而導致光合色素含量迅速下降。同時,高濃度NaCl脅迫下Car含量的降低也抑制了其對活性氧自由基的清除作用,進一步加劇了葉綠體膜的破壞,造成葉綠素的快速降解,進而影響到葉片的光合能力(陳健妙 等,2009;秦景 等,2009)。花椰菜幼苗干、鮮質量在 NaCl脅迫下的變化趨勢或許與光合色素的變化特點有關。這與前人在沙棘(秦景 等,2009)、麻風樹(陳健妙 等,2009)鹽脅迫研究中的發現相一致。Chla/Chlb值的變化能反映植物光合活性的強弱(秦景 等,2009),Car/Chl值與植物清除活性氧能力和忍受逆境能力有關(陳健妙 等,2009)。本試驗中發現,Chla/Chlb和Car/Chl在NaCl脅迫濃度梯度上呈線性降低趨勢,表明NaCl脅迫下花椰菜子葉中Chla破壞程度大于Chlb,且 Car含量大幅度下降,降低了幼苗抵抗氧化脅迫的能力,增強了活性氧脅迫對葉綠體膜的傷害,從而導致其幼苗的光合能力降低。
植物的耐鹽性是一個受多種因素影響的復雜數量性狀;不同的物種對某一具體指標的耐鹽性反應不一定相同;單一指標難以全面準確地反映耐鹽性的強弱(江珊 等,2009)。綜合分析發現,花椰菜種子抗氧化酶(SOD、POD和CAT)活性、相對鹽害率及Chla、Chlb、Chl和Car含量在 NaCl脅迫濃度梯度上具有明顯的反應拐點,說明這些指標能夠在一定程度上指示 NaCl脅迫對花椰菜種子活力和抗氧化酶活性及幼苗光合色素傷害的強度水平;這些參數的變化拐點一般在NaCl脅迫濃度處于102~136 mmol·L-1,表明102~136 mmol·L-1NaCl脅迫下花椰菜種子生理及幼苗光合色素受到顯著影響,可作為花椰菜耐鹽性評價的生理生化閾值,以供鹽漬土壤開發利用及耐鹽種質評價參考。
陳國菊,楊暹,吳筱穎.2002.干旱脅迫對花椰菜葉片細胞保護酶及超微結構的影響.中國蔬菜,(2):8-11.
陳健妙,鄭青松,劉兆普,隆小華,劉聯.2009.麻瘋樹(Jatropha curcasL.)幼苗生長和光合作用對鹽脅迫的響應.生態學報,29(3):1356-1365.
陳珍.2009.水楊酸對鎘脅迫下花椰菜種子萌發及幼苗生長的影響.種子,28(2):39-42.
董濤,張志剛,尚慶茂.2009.水楊酸和殼聚糖對黃瓜幼苗耐鹽性的共誘導作用.中國蔬菜,(2):46-50.
江珊,張文輝,劉新成.2009.3種園林樹木種子萌發期耐鹽性研究.西北植物學報,29(4):733-741.
李合生.2000.植物生理生化實驗原理和技術.北京:高等教育出版社:164-167.
李建設,沈國偉,任長忠,胡銀崗,劉春貴.2009.燕麥種子萌發和幼苗生長對不同鹽脅迫的反應.麥類作物學報,29(6):1043-1047.
李源,劉貴波,高洪文,孫桂枝,趙海明,謝楠.2010.紫花苜蓿種質耐鹽性綜合評價及鹽脅迫下的生理反應.草業學報,19(4):79-86.
苗春樂,郝麗珍,王萍,楊忠仁,李紅艷,王六英,趙清巖.2008.NaCl脅迫對沙蔥種子生活力及抗氧化酶活性的影響.華北農學報,23(4):172-175.
喬紹俊,李會珍,張志軍,張鑫.2009.鹽脅迫對不同基因型紫蘇種子萌發、幼苗生長和生理特征的影響.中國油料作物學報,31(4):499-502.
秦景,董雯怡,賀康寧,陳靜,于洋,王占林.2009.鹽脅迫對沙棘幼苗生長與光合生理特征的影響.生態環境學報,18(3):1031-1036.
汪炳良,徐敏,史慶華,曹家樹.2004.高溫脅迫對早熟花椰菜葉片抗氧化系統和葉綠素及其熒光參數的影響.中國農業科學,37(8):1245-1250.
王建成,胡晉,張新覺,徐群,周勝利,徐盛春.2004.鹽引發對不同水分條件下油菜種子發芽成苗的影響.種子,23(1):6-8,12.
徐玉偉,郭世榮,程玉靜,熊銀鋒,黃海桃.2010.Ca(NO3)2對鹽脅迫下黃瓜幼苗生長及膜質過氧化的影響.中國蔬菜,(4):14-18.
楊平,吳鳳芝.2011.不同化感效應小麥根系分泌物對黃瓜苗葉片保護酶活性及滲透調節物質的影響.中國蔬菜,(12):32-36.
楊小環,馬金虎,郭數進,李新基,李盛.2011.種子引發對鹽脅迫下高粱種子萌發及幼苗生長的影響.中國生態農業學報,19(1):103-109.
Dkhil B B,Denden M.2010.Salt stress induced changes in germination,sugars,starch and enzyme of carbondrate metabolism inAbelmoschus esculentusL.Moench seeds.African Journal of Agricultural Research,5(6):408-415.
Gulen H,Turhan E,Eris A.2006.Changes in peroxidase activities and soluble proteins instrawberry varieties under salt-stress.Acta Physiologiae Plantarum,28(2):109-116.
Mehmet D K,Gamze O,Mehmet A,Yakup C,Ozer K.2006.Seed treatments to overcome salt and drought stress during germination in sunflower(Helianthus annuusL.).European Journal of Agronomy,24:291-295.
Pujari D S,Chanda S V.2002.Effect of salinity stress on growth,peroxidase and IAA oxidase activities in vigna seedlings.Acta Physiologiae Plantarum,24(4):435-439.
Wang X S,Han J G.2009.Changes of proline content,activity,and active isoforms of antioxidative enzymes in two a lfalfa cultivars under salt stress.Agricultural Sciences in China,8(4):431-440.
Zhu S Y,Hong D L,Yao J,Zhang X L,Luo T K.2010.Improving germination,seedling establishment and biochemical characters of aged hybrid rice seed by priming with KNO3+ PVA.African Journal of Agricultural Research,5(1):78-83.

