miR-21在大腸癌細胞遷移和侵襲中的作用及機制探討
胡 婷,陳梅香,閆雍容,鐘雪云
(1暨南大學醫學院病理學系,廣州 510632;2廣州醫學院護理學院)
大腸癌是我國最常見的惡性腫瘤之一,復發和轉移是導致患者死亡的主要原因。近年來,發現了一類在真核生物中起轉錄后調控作用的小分子、非編碼RNA(miRNA),在細胞正常生長發育、增殖、分化與凋亡等生命活動中具有重要作用。研究證實,miRNA在腫瘤中異常表達,可作為癌基因或抑癌基因參與大腸癌等多種腫瘤的發生、發展、侵襲、遷移,并與腫瘤的診斷和預后等密切相關。具有原癌基因作用的miR-21在大腸癌中常呈過度高表達狀態[1],其能影響細胞的增殖、凋亡、侵襲和遷移等,但miR-21在大腸癌侵襲和遷移過程中的作用機制尚不清楚。為此我們于2010年9月~2011年11月進行了如下研究。
1 材料和方法
1.1 材料 Trizol試劑購自Invitrogen公司;Prime-ScriptTM逆轉錄試劑盒、SYBR Premix Ex TaTM熒光定量PCR試劑盒均購自Takara公司;miR-21和U6 snRNA的Bulge-LoopTM miRNA qRT-PCR Primer Set由廣州銳博公司合成;miR-21 mimics和 miRNA mimics negative control購自上海吉瑪公司;jetPRIMETMTransfection Reagent購自Polyplus Transfection公司;24孔Transwell小室購自美國Corning公司;Matrigel購自BD公司;緊密連接蛋白(ZO-1)、上皮鈣粘蛋白(E-cadherin,E-cad)、神經鈣黏蛋白(N-cad)、Slug、第10號染色體同源缺失性磷酸酶-張力蛋白(PTEN)、磷酸化蛋白激酶B(p-Akt)兔抗人單克隆抗體均購自美國Cell Signaling公司;0.45 μm硝酸纖維素膜購自美國Millipore公司;β-肌動蛋白(β-Actin)鼠抗人單克隆抗體、辣根過氧化物酶(HRP)標記山羊抗兔IgG、HRP標記山羊抗鼠IgG皆購自Protein Tech Group公司;BCA法蛋白質定量試劑盒購自海門碧云天公司;ECL底物發光檢測試劑盒購自美國Pierce公司。
1.2 實驗方法
1.2.1 細胞培養及干預 人結腸癌細胞株SW480為本實驗室凍存保藏,用含10%FBS RPMI-1640培養基于37℃、5%CO2、飽和濕度的細胞培養箱中培養,用0.25%胰酶+0.02%EDTA消化傳代。取對數生長期狀態良好的SW480細胞消化計數,5.0×105/孔接種于6孔板中。轉染組加入終濃度為30 nmol/L 的 miR-21 mimics、200 μL jetPRIMETMBuffer和4 μL jetPRIMETMreagent(轉染組);對照組是將miR-21 mimics換為同濃度的miRNA mimics negative control,余同實驗組,轉染步驟按說明書操作;兩組均用含5%FBS RPMI-1640調至2 mL。24 h后將培養液換為10%FBS RPMI-1640。
1.2.2 觀察項目
1.2.2.1 miR-21表達 采用 RFQ-PCR 法。用 Trizol提取細胞總RNA,經分光光度計檢測,A260/A280值為1.8~2.1的用于cDNA合成。RT反應:用PrimeScriptTM逆轉錄試劑盒、按說明書進行RT反應,62.5 nmol/L miR-21 及U6 Bulge-LoopTM miRNA RT Primer各2 μL,反應體系20 μL,反應條件為37℃ 15 min、85℃ 5 s。RFQ-PCR:反應體系 20 μL,SYBR Premix Ex TaTM 10 μL,5 μmol/L Bulge-LoopTM miR-21或U6 snRNA上下游引物各1 μL,cDNA 1 μL,無酶水7 μL,反應條件為 95 ℃預變性20 s,之后95 ℃ 10 s、60 ℃ 20 s、70 ℃ 30 s,擴增40個循環。采用2-ΔΔCt評定不同細胞中miR-21相對表達量,ΔCt=CtmiR-21-CtU6,ΔΔCt=ΔCtmiR-21mimics-ΔCtnegative control。
1.2.2.2 細胞遷移和侵襲能力 將 Matrigel用無血清RPMI1640培養基按1∶1比例配制成細胞外基質膠,按30 μL/室加入Transwell小室聚碳酸酯膜(直徑6.5 mm,孔徑 8 μm)上面,包被細胞外基質膠。轉染24 h后,用2.5%胰酶消化,懸浮于無血清RPMI-1640培養基中,調整細胞濃度為1×106/mL。細胞遷移試驗:用未包被細胞外基質膠的Transwell小室,在小室的上室中加入100 μL細胞懸液,下室中加入600 μL含10%FBS的 RPMI1640培養基,置于37℃、5%CO2、飽和濕度培養箱中孵育14 h;細胞侵襲試驗:用聚碳酸酯膜包被了細胞外基質膠的Transwell小室,在小室的上室中加入200 μL細胞懸液,在培養箱中孵育24 h,余同遷移試驗。每組設3個平行孔,實驗重復3次。孵育結束后,擦除小室濾膜內表面的細胞,用4%多聚甲醛固定、PBS輕洗、0.1%結晶紫染色,200倍顯微鏡下分別計數穿過膜的細胞(遷移細胞及侵襲細胞)并拍照,隨機選取5個視野,取其平均值。
1.2.2.3 細胞相關蛋白表達檢測 采用 Western blot法。收集細胞,RIPA細胞裂解液提取蛋白質樣品。用BCA法在酶標儀上用570 nm波長測定總蛋白濃度。樣本經SDS-PAGE電泳后,用電轉儀以350 mA恒流1 h轉印至硝酸纖維素膜,5%脫脂奶粉室溫封閉1 h,加入一抗,4℃搖床孵育過夜,TBST洗膜3次,每次10 min。再加入二抗室溫孵育1 h,TBST洗膜3次,每次10 min。ECL化學發光試劑盒顯影。用Image J軟件分析條帶的強度。
1.3 統計學方法 采用SPSS13.0統計軟件。計量資料以±s表示,兩組之間均數的比較采用獨立樣本的t檢驗。P≤0.05為差異有統計學意義。
2 結果
2.1 miR-21表達 轉染組及對照組miR-21相對表達量分別為 2185.62 ±69.75、1.00 ±0.00(P <0.001)。
2.2 細胞的遷移和侵襲能力 遷移試驗中,對照組細胞數為(90.4±10.26)個,轉染組為(181.0±22.16)個 ,P <0.001;侵襲試驗中,對照組細胞數為(73.8 ±9.2)個,轉染組為(148.0 ±7.31)個 ,P <0.001。
2.3 相關蛋白表達 見圖1。由圖1可見,與對照組相比,轉染組細胞ZO-1、E-cad、PTEN表達量明顯下降(P <0.001),而 N-cad、Slug、p-Akt表達量卻明顯升高(P <0.001)。
3 討論
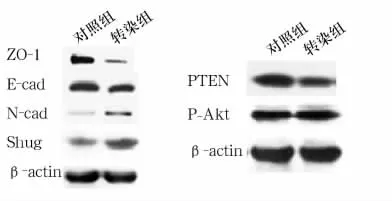
圖1 各相關標志物電泳圖
復發與轉移是影響大腸癌患者術后生存率的關鍵要素。大腸癌轉移是一個多步驟、多因素參與的復雜過程,與胞外基質降解、細胞遷移運動及信號傳導等諸多因素有關,具體機制尚不清楚。新近發現的miRNA在細胞的分化、增殖、代謝及胚胎發育等生命活動中具有重要作用,在腫瘤的發生、發展和轉移等過程中也具有重要作用。自1993年Lee等發現第一個miRNA以來,miRNA基因序列數據庫現已收錄動植物及病毒等成熟miRNA 18 226條,其中人類的為1 527條。人類成熟miRNA至少調控著30%人類蛋白質編碼基因。miRNA可通過完全互補或部分互補的方式與靶mRNA相互作用,一種miRNA可作用于多種靶mRNA,多個miRNA也可協同作用于同一個靶 mRNA[2]。miRNA可能是基因調控網絡中的關鍵節點,亦可能是腫瘤治療的有效新靶點。
目前已發現多種miRNA在大腸癌組織及大腸癌細胞系中異常表達。在大腸癌組織中,miR-19a、miR-21、miR-29a、miR-92、miR-148a、miR-200b 等的表達明顯上調,而 miR-30c、miR-133a、miR-143 和miR-145 等的表達明顯下調[1]。miR-320a、Let-7c和miR-137 等可抑制大腸癌的侵襲和遷移[3,4],miR-31、miRNA-200家族和miR-21等可促進大腸癌侵襲和遷移[5~7]。本研究結果顯示,與對照組相比,轉染組細胞中miR-21的表達顯著上調;細胞的遷移和侵襲能力皆明顯增強,說明 miR-21能增強大腸癌SW480細胞的遷移和侵襲能力。
Han等[8]發現,miR-21可通過誘導 EMT促進乳腺癌MCF-7細胞遷移和侵襲。EMT是指上皮細胞在特定的情況下喪失細胞極性向間質細胞轉分化的現象。EMT是胚胎時期三胚層、器官形成等所必須的生理過程,亦常見于慢性炎癥、創傷修復與組織纖維化、以及惡性腫瘤的浸潤轉移等病理過程。EMT的發生涉及多個環節,包括細胞因子(TGF-β、HGF)和轉錄因子(Snail、Slug、Twist等)表達上調,上皮標志物(E-cad、ZO-1等)表達下調,間質標志物(波形蛋白Vimentin、N-cad等)表達上調,有輔助作用的基質金屬蛋白酶MMP-2和MMP-9、Ⅰ型膠原和Ⅲ型膠原等表達上調。其中E-cad表達下調是EMT發生中最重要的分子事件。越來越多的證據表明EMT是多種腫瘤侵襲和轉移早期的一個重要過程[9]。在多種實體腫瘤中,腫瘤中央的細胞呈上皮表型,而周邊的細胞多呈現間質細胞表型,其黏附能力下降、遷移運動能力增強、易于離開原有位置、發生原位浸潤或侵入血管和淋巴管而發生轉移。結果顯示,上調miR-21表達的轉染組細胞,上皮標志物ZO-1和E-cad的表達皆明顯低于對照組,而間質標志物N-cad表達卻明顯高于對照組,核轉錄因子Slug表達亦明顯高于對照組。Slug是鋅指轉錄因子Snail家族中的一員,可與E-cad的啟動子結合而抑制E-cad的轉錄進而誘導細胞發生EMT。上述結果提示,SW480細胞中上調的miR-21可能是通過激活Slug,繼而下調E-cad和ZO-1的表達、上調N-cad的表達,誘導細胞發生EMT,從而促進細胞遷移和侵襲。
Zhang等[10]發現,在胃癌細胞 BGC-823 中,miR-21可通過靶向PTEN促進細胞的增殖和侵襲[10]。在肝癌、乳腺癌等多種腫瘤中抑癌因子PTEN是miR-21的直接靶標[11]。在人大腸癌細胞中miR-21能否靶向抑制PTEN尚不清楚。本研究結果顯示,在轉染上調miR-21表達后SW480細胞中PTEN蛋白的表達明顯下調,而p-Akt蛋白表達卻明顯升高。Yao等[12]研究發現,在人類腎臟近端小管上皮細胞系中,過表達PTEN可以抑制TGF-β誘導EMT的形成。Song等[13]在人鼻咽癌上皮細胞中發現,抑制PTEN蛋白表達可增強細胞的遷移和侵襲能力。PTEN是磷酸肌醇-3激酶/蛋白激酶B(PI3K/Akt)通路的負性調節因子。以上結果和資料表明,在大腸癌細胞中上調miR-21可抑制PTEN蛋白表達,激活PI3K/Akt通路,進而誘導EMT并促進細胞侵襲和遷移。然而,miR-21的靶基因可能具有組織細胞特異性,在大腸癌細胞中PTEN是否是miR-21的直接靶標,仍需進一步研究。
有研究發現,在大腸癌中,miR-21也可靶向抑制抑癌因子程序性細胞死亡因子4(PDCD4)和RhoB,進而促進細胞遷移和侵襲[7,14]。一種 miRNA可作用于多種靶mRNA,目前已發現,miR-21還可靶向抑制抑癌因子Maspin、PTEN、基質金屬蛋白酶抑制因子Kazal基序逆向誘導半胱氨酸豐富蛋白(rRECK)、金屬蛋白酶組織抑制因子(TIMP)、異質核核糖核體蛋白 K(HNRPK)、TAp63、p53、豆蔻酰化富丙氨酸蛋白激酶C底物(MARCKS)、富亮氨酸重復序列相互作用蛋白1(LRRFIP1)、CC亞族趨化因子配體20(CCL20)等多種腫瘤相關蛋白的表達,參與調節 p53、TGF-β、線粒體凋亡、核因子-κB(NF-κB)、PI3K/Akt、Bcl-2、表皮生長因子受體等通路[15,16]。總之,miR-21作為一種致癌基因可參與調節多條信號通路中多種腫瘤相關蛋白的表達,進而促進細胞的生長、遷移和侵襲等;miR-21可能是基因調控網絡中的關鍵節點及惡性腫瘤治療的有效靶標,靶作用于miR-21或許能夠實現“單擊多靶”效應。
[1]Bandrés E,Cubedo E,Agirre X,et al.Identification by Real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues[J].Mol Cancer,2006,5:29-38.
[2]Lim LP,Lau NC,Garrett-Engele P,et al.Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs[J].Nature,2005,433(7027):769-773.
[3]Zhang Y,He X,Liu Y,et al.microRNA-320a inhibits tumor invasion by targeting neuropilin1 and is associated with liver metastasis in colorectal cancer[J].Oncol Rep,2012,27(3):685-694.
[4]Han HB,Gu J,Zuo HJ,et al.Let-7c functions as a metastasis suppressor by targeting MMP11 and PBX3 in colorectal cancer[J].J Pathol,2012,226(3):544-555.
[5]Wang CJ,Stratmann J,Zhou ZG,et al.Suppression of microRNA-31 increases sensitivity to 5-FU at an early stage,and affects cell migration and invasion in HCT-116 colon cancer cells[J].BMC Cancer,2010,10:616-626.
[6]Burk U,Schubert J,Wellner U,et al.A reciprocal repression between ZEB1 and members of the miR-200 family promotes EMT and invasion in cancer cells[J].EMBO Rep,2008,9(6):582-589.
[7]Asangani IA,Rasheed SA,Nikolova DA,et al.MicroRNA-21(miR-21)post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion,intravasation and metastasis in colorectal cancer[J].Oncogene,2008,27(15):2128-2136.
[8]Han M,Liu M,Wang Y,et al.Re-expression of miR-21 contributes to migration and invasion by inducing epithelial-mesenchymal transition consistent with cancer stem cell characteristics in MCF-7 cells[J].Mol Cell Biochem,2012,363(1-2):427-436.
[9]Gos M,Miloszewska J,Przybyszewska M.Epithelial-mesenchymal transition in cancer progression[J].Posteby Biochem,2009,55(2):121-128.
[10]Zhang BG,Li JF,Yu BQ,et al.microRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN[J].Oncol Rep,2012,27(4):1019-1026.
[11]Roy S,Khanna S,Hussain SR,et al.MicroRNA expression in response to murine myocardial infarction:miR-21 regulates fibroblast metalloprotease-2 via phosphatase and tensin homologue[J].Cardiovasc Res,2009,82(1):21-29.
[12]Yao Y,Wei H,Liu L,et al.Upregulated DJ-1 promotes renal tubular EMT by suppressing cytoplasmic PTEN expression and Akt activation[J].J Huazhong Univ Sci Technolog Med Sci,2011,31(4):469-475.
[13]Song LB,Li J,Liao WT,et al.The polycomb group protein Bmi-1 represses the tumor suppressor PTEN and induces epithelial-mesenchymal transition in human nasopharyngeal epithelial cells[J].J Clin Invest,2009,119(12):3626-3636.
[14]Liu M,Tang Q,Qiu M,et al.miR-21 targets the tumor suppressor RhoB and regulates proliferation,invasion and apoptosis in colorectal cancer cells[J].FEBS Lett,2011,585(19):2998-3005.
[15]Pan X,Wang ZX,Wang R.MicroRNA-21:a novel therapeutic target in human cancer[J].Cancer Biol Ther,2011,10(12):1224-1232.
[16]Vicinus B,Rubie C,Faust SK,et al.miR-21 functionally interacts with the 3'UTR of chemokine CCL20 and down-regulates CCL20 expression in miR-21 transfected colorectal cancer cells[J].Cancer Lett,2012,316(1):105-112.

