三個煙草防御素基因的克隆及序列分析
林世鋒,任學良,王 軼,王仁剛
(貴州省煙草科學研究所,貴陽 550081)
植物防御素(Plant defensins)是一類富含半胱胺酸的低分子量短肽,廣泛分布于植物體內,參與植物的防衛反應,是極為重要的一種抗病因子[1]。植物防御素因種類和結構的差別具有不同作用,包括抗真菌[2-3]和抗細菌[4],以及蛋白酶抑制和抗蟲作用[5-6],部分研究也發現防御素可以在環境脅迫情況下對植物體起保護作用[7]。目前,已有不同學者分別從煙草屬的普通煙草(Nicotiana tabacum)[8]、高煙草(N.excelsior)[9]、圓錐煙草(N.paniculata)、漸狹葉煙草(N.attenuata)[10]和花煙草(N.alata)[11-12]中克隆到防御素基因,其中部分基因的功能已初步明確,如從花煙草中獲得的防御素基因具有抗真菌和抗蟲雙重作用。
電子克隆(In silico cloning)是近年來伴隨著基因組計劃和 EST計劃而發展起來的基因克隆新方法[13],它依賴于各種生物信息數據庫,利用生物軟件拼接延伸EST序列,獲得目的基因的部分乃至全長的cDNA序列。本研究采用電子克隆的方法獲得煙草栽培品種K326(N.tabacum)的3個防御素基因cDNA序列并進行生物信息學分析,以期為進一步研究該類基因的進化關系和功能差異,比較其在煙草病蟲害防御反應中的作用奠定基礎。
1 材料與方法
1.1 煙草防御素基因的電子克隆
以辣椒防御素CaDEF1基因的全長cDNA序列(GenBank登陸號:AF442388)[7]為信息探針,對GenBank中 EST_others數據庫指定物種煙草(Nicotiana tabacum)進行BLAST檢索,將檢索到的來自于煙草栽培品種K326的全部EST序列利用DNAMAN 6.0軟件進行拼接,形成重疊群(contig)。然后用此重疊群再次進行同源檢索、拼接,重復以上過程直至沒有更多煙草栽培品種 K326的重疊EST檢出,最終獲得煙草栽培品種 K326防御素cDNA序列片段。再以此片段在 GenBank中進行blastx同源搜索,與其他物種的防御素同源蛋白進行序列比較,進而判斷拼接得到的煙草防御素基因cDNA的正確性以及其ORF序列的完整性。
1.2 煙草防御素基因的生物信息學分析
利用NCBI網站(http://www.ncbi.nlm.nih.gov/)提供的ORF finder軟件對開放閱讀框進行分析并翻譯成蛋白質,通過BlastP程序進行序列相似性分析和氨基酸保守性預測;利用瑞士生物信息研究所網站(http://www.expasy.org/tools/)提供的ProtParam、SignalP和NetPhos軟件進行蛋白的基本特性、信號肽和磷酸化位點分析,通過 SWISS-MODEL和CPHmodels在線工具對蛋白質的三級結構進行預測;利用 http://www.predictprotein.org/網站提供的Predict Protein軟件進行蛋白質二硫鍵的預測;運用DNAMAN 6.0、ClustalX 2.0和MEGA3.1軟件進行氨基酸序列比對和進化樹分析。
2 結 果
2.1 煙草防御素基因的電子克隆
利用已知的辣椒防御素基因的核苷酸序列對GenBank中煙草EST數據庫進行BLAST檢索分析,發現 97條相似性高的 EST序列來自煙草品種K326。對它們進行重疊群分析,結果顯示97條EST可拼接成3個獨立的cDNA序列,長度為554 bp、496 bp和434 bp,代表煙草3個不同的防御素基因,分別命名為NtDEF1、NtDEF2和NtDEF3(Nicotiana tabacumdefensins)。經NCBI ORF finder分析,三者分別包括一個長度237 bp、234 bp和231 bp的開放讀碼框,依次編碼由78、77和76個氨基酸組成的防御素(圖1)。
2.2 煙草防御素的結構特征分析
將推導出的 3個煙草防御素氨基酸序列利用SignalP軟件進行信號肽分析,發現 NtDEF1和NtDEF2蛋白氨基端的前20個氨基酸,NtDEF3蛋白氨基端的前19個氨基酸為信號肽(圖1)。植物防御素的信號肽不僅具有幫助多肽有效靶向分泌的作用,同時也具有緩解蛋白毒性的作用,只在到達作用空間需要防御素發揮毒性作用的時候才將成熟多肽釋放出來[14]。
用推測的氨基酸序列進行BLASTp比較,發現NtDEF1、NtDEF2和NtDEF3均具有γ-硫素蛋白家族(γ-thionin family)結構域(圖1),該序列編碼具有殺菌功能的毒素功能結構[14-15]。
2.3 煙草防御素的基本特性分析
利用ProtParam軟件對3個煙草防御素成熟蛋白進行基本特性分析,結果顯示NtDEF1含有原子總數為855,分子式為C259H415N87O84S10,其分子量為6412.2 Da,理論等電點為8.52。在氨基酸組成上,半胱氨酸和精氨酸相同各有8個,均占13.8%;其次是甘胺酸和蘇氨酸相同各有6個,均占10.3%。總的帶正電荷和總的帶負電荷的氨基酸殘基數分別為9和6。預測該蛋白不穩定指數為61.06,屬于不穩定蛋白。
顯示NtDEF2含有原子總數為860,分子式為C268H414N90O78S10,其分子量為6 465.3 Da,理論等電點為8.95。在氨基酸組成上,半胱氨酸含量最高有8個,占14.0%;其次是精胺酸7個占12.3%。總的帶正電荷和總的帶負電荷的氨基酸殘基數分別為11和4。預測該蛋白不穩定指數為63.59,屬于不穩定蛋白。

圖1 煙草防御素1(A)、2(B)和3(C)cDNA序列及推導的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of the tobacco defensins
顯示NtDEF3含有原子總數為879,分子式為C271H430N90O80S8,其分子量為 6485.4 Da,理論等電點為9.22。在氨基酸組成上,半胱氨酸含量最高有8個,占14.0%;其次是甘胺酸和精氨酸相同各有7個,均占12.3%。總的帶正電荷和總的帶負電荷的氨基酸殘基數分別為11和4。預測該蛋白不穩定指數為28.89,屬于穩定蛋白。
總平均親水性 GRAVY(grand average of hydropathicity)分析表明,三者 GRAVY值分別為-0.579、-0.523和-0.705,這表明三者均為親水性蛋白。
2.4 煙草防御素的二硫鍵預測
NtDEF1、NtDEF2和NtDEF3都含有8個半胱氨酸,經PredictProtein預測軟件分析,發現8個半胱氨酸在煙草3種防御素中形成的二硫鍵連接方式一致,均為Cys-1-Cys-8、Cys-2-Cys-5、Cys-3-Cys-6、Cys-4-Cys-7。其中,圖2為NtDEF1二硫鍵預測結果,這與典型的植物防御素二硫鍵結構模型相同[14]。
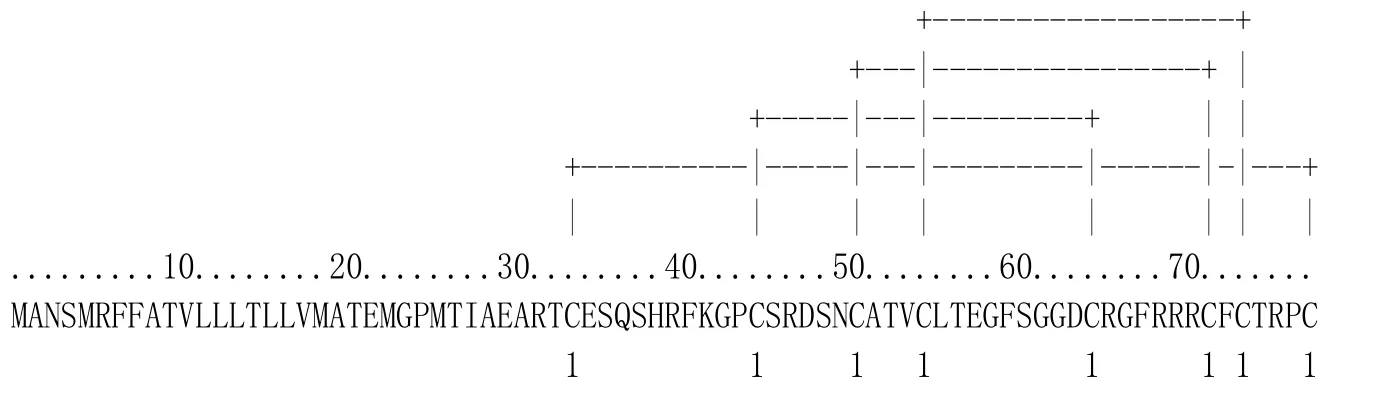
圖2 煙草防御素NtDEF1二硫鍵預測Fig.2 Predicted disulifide bridges in NtDEF1
2.5 煙草防御素三維結構預測
分別應用SWISS-MODEL和CPHmodels在線工具對3個煙草防御素進行蛋白三維結構預測,以PDB數據庫中大麥(Hordeum vulgare)防御素(DEF1_HORVU)[16-17]的三維結構(PDB id=1gpt)為模板,對NtDEF1和NtDEF2進行三維結構同源建模,序列一致性為53.2%;以PDB數據庫中小麥(Triticum aestivum)防御素(DEF1_WHEAT)[17-18]的三維結構(PDB id=1gps)為模板,對 NtDEF3進行三維結構同源建模,序列一致性為46.8%。預測結果如圖3所示。從圖中可以看出煙草三種防御素蛋白的三維結構都含有三段反向平行的 β-折疊和一段α-螺旋,與己推導出的植物防御素蛋白結構一致。
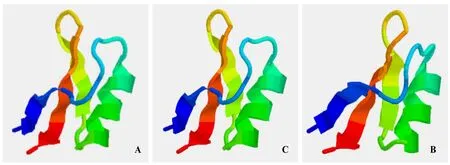
圖3 煙草防御素1(A)、2(B)和3(C)的三級結構預測Fig.3 Tertiary structure prediction of the tobacco defensins
2.6 氨基酸序列比對和同源性分析
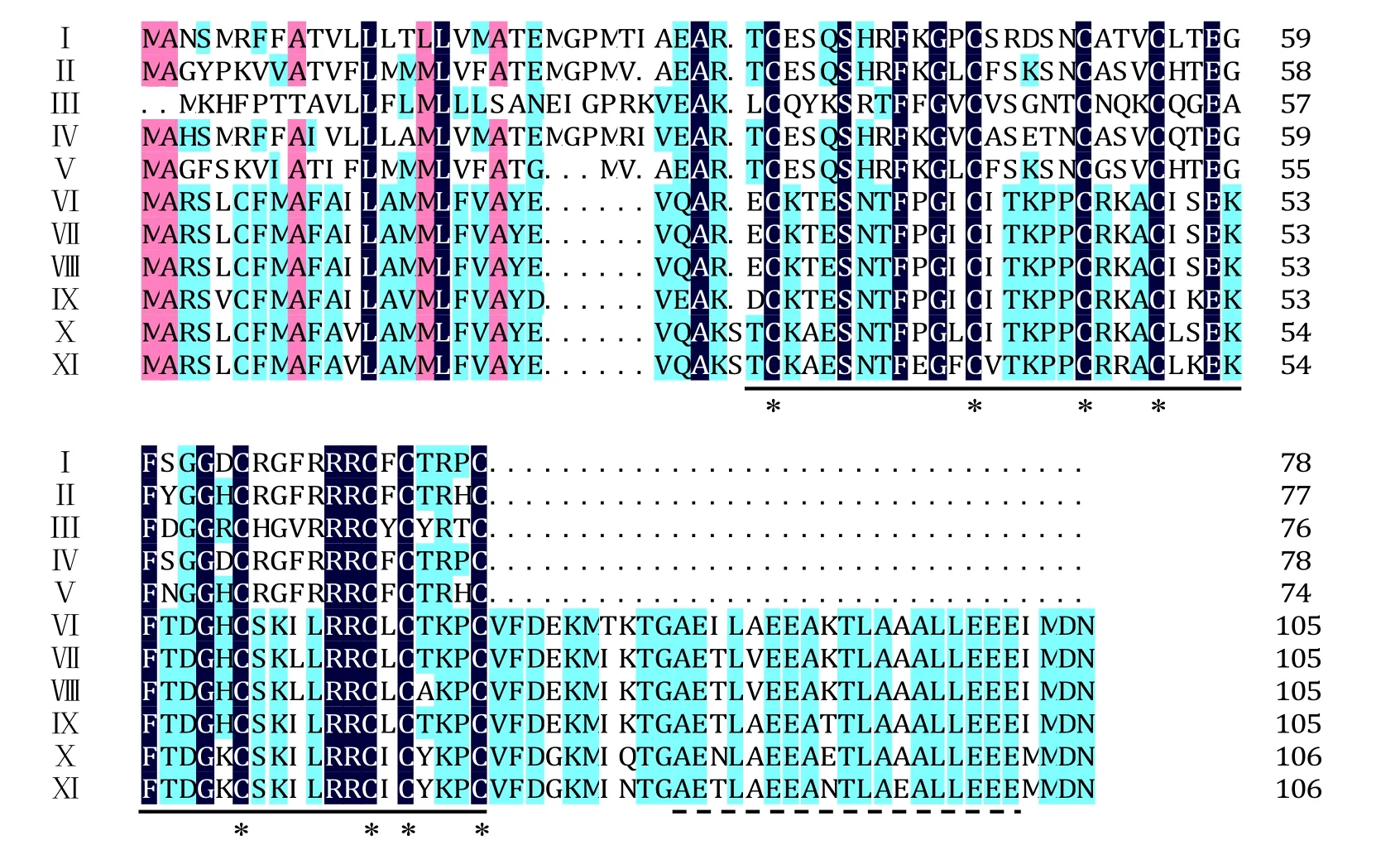
圖4 不同植物防御素基因氨基酸序列同源性比較Fig.4 Alignment of deduced amino acid sequences of defensin genes of different plants
3個煙草防御素氨基酸序列與部分其他植物進行比對,結果顯示在植物防御素中一些保守的氨基酸在煙草中同樣存在(圖4),例如:植物防御素的典型特征序列即γ-硫素蛋白結構域在煙草中同樣保守,且具有構成4個二硫鍵所需的8個半胱氨酸殘基。利用DNAMAN軟件對煙草3種防御素進行同源性分析顯示,NtDEF1和NtDEF2的一致性最高為72%,NtDEF1和NtDEF3的一致性最低為40%,NtDEF2和NtDEF3的一致性為47%。與其他物種相比較,三者均與辣椒的一致性最高,在50%~87%。盡管在普通煙草、高煙草、圓錐煙草、漸狹葉煙草及花煙草中已有防御素基因的報道,但是與其一致性都較低,在 33%~40%,且氨基酸 C-端不具備與其對應的低復雜性區域(Low Complexity Region,LCR),表明NtDEF1、NtDEF2和NtDEF3是3個新的煙草防御素基因。
2.7 系統進化樹分析
從 GenBank上獲得已知的植物防御素的氨基酸序列經ClustalX 2.0比對后,利用Mega 3.1以鄰位相接(NJ)構建系統進化樹(圖5)。結果表明,防御素基因在煙草、辣椒、番茄、擬南芥等植物中均以多種形式存在,且序列差異較大,在系統進化樹中分散在遺傳距離很遠的分支上。NtDEF1、NtDEF2和NtDEF3處于第Ⅰ分支的不同小分支上,而已報道的煙草屬防御素基因均處于第Ⅱ分支上,進一步證明前者是煙草3種新的防御素基因。

圖5 煙草與其他物種防御素同源蛋白的系統進化分析Fig.5 Phylogenetic analysis of amino acid sequences of defensin genes from tobacco and other species
3 討 論
基于表達序列標簽(Expressed Sequence Tags,EST)的電子克隆策略,具有簡單、快速、針對性強等優點,現已成為一種廣泛使用的基因克隆技術[13]。本研究以煙草與辣椒同屬茄科植物,物種間同源基因序列相對保守為切入點,以辣椒防御素CaDEF1基因cDNA序列作為探針,對煙草EST數據庫進行檢索拼接,成功克隆到目的物種的3個新防御素基因序列。在電子克隆檢索過程中,目標物種鎖定煙草(Nicotiana tabacum),全部EST序列來源于同一品種 K326,避免了品種間基因多態性造成序列拼接工作的復雜性,進而增加了電子克隆的準確性。同時,K326是我國主栽煙草品種之一,對其重要功能基因的研究,勢必具有重要的理論及應用價值。
研究證實植物防御素具有抗真菌[2-3]、抗細菌[4]和蛋白酶抑制劑[5]等生物活性,而 γ-硫素類防御素由于其功能廣泛、分子量小以及穩定等特點在植物基因工程中極具應有前景[14-15]。γ-硫素蛋白超家族功能區具有嚴格保守的8個半胱氨酸殘基,形成4個分子內二硫鍵以穩定三段反向平行的 β-折疊和一段α-螺旋,從而形成具有復雜三維折疊結構的抗菌短肽[14-15]。盡管本研究克隆到的3個防御素同樣具備上述保守功能區,但3個防御素在氨基酸組成上存在一定的區別,如纈氨酸、賴氨酸、蘇氨酸和苯丙氨酸的數目差異較顯著。這些氨基酸的差異是否造成功能上的差異還需要進一步深入研究。
目前,在番茄、辣椒等茄科植物中已克隆得到多個防御素cDNA序列,其中辣椒防御素CaDEF1和CaDEF2的氨基酸序列一致性為64%,它們在根、莖、葉和果實中的表達模式各不相同[7,19]。我們利用本研究克隆的防御素基因進行 Blastn同源檢索時,在煙草的EST數據庫中得到了數目不同且高度同源的煙草品種K326的防御素EST序列,其中以NtDEF1為最高。這預示著在煙草中盡管存在結構相對保守的多種防御素,但是其表達分布或者在同一組織中的表達量可能各不相同,提示它們可能在不同或相同的組織中發揮著特異的作用。
[1]Broekaert W F, Terras F R, Cammue B P, et al.Plant defensins: novel antimicrobial peptides as components of the host defense system [J].Plant Physiol, 1995, 108:1353-1358.
[2]Lai F M, DeLong C, Mei K, et al.Analysis of the DRR230 family of pea defensins: gene expression pattern and evidence of broad host-range antifungal activity [J].Plant Sci, 2002, 163: 855-864.
[3]Solis J, Medrano G, Ghislain M.Inhibitory effect of a defensin gene from the Andean crop maca (Lepidium meyenii) againstPhytophthora infestans[J].J Plant Physiol, 2007, 164: 1071-1082.
[4]Choi Y, Choi Y D, Lee J S.Antimicrobial activity of γ-thionin-like soybean SE60 inE.coliand tobacco plants[J].Biochem Biophys Res Commun, 2008, 375: 230-234.
[5]Wijaya R, Neumann G M, Condron R, et al.Defense proteins from seed ofCassia fistulainclude a lipid transfer protein homologue and a protease inhibitory plant defensin [J].Plant Sci, 2000, 159: 243-255.
[6]Chen K C, Lin C Y, Kuan C C, et al.A novel defensin encoded by a mungbean cDNA exhibits insecticidal activity against bruchid [J].J Agric Food Chem, 2002, 50:7258-7263.
[7]Do H M, Lee S C, Jung H W, et al.Differential expression and in situ localization of a pepper defensin(CADEF1) gene in response to pathogen infection,abiotic elicitors and environmental stresses inCapsicum annuum[J].Plant Sci, 2004, 166: 1297-1305.
[8]Gu Q, Kawata E E, Morse M J, et al.A flower-specific cDNA encoding a novel thionin in tobacco [J].Mol Gen Genet, 1992, 234: 89-96.
[9]Yamada S, Komori T, Imaseki H.cDNA cloning of γ-thionin fromNicotiana excelsior(Accession No.AB005266) (PGR97-131) [J].Plant Physiol, 1997, 115:314.
[10]Lou Y, Baldwin I T.Nitrogen supply influences herbivore-induced direct and indirect defenses and transcriptional responses inNicotiana attenuate[J].Plant Physiol, 2004, 135: 496-506.
[11]Lay F T, Brugliera F, Anderson M A.Isolation and properties of floral defensins from ornamental tobacco and petunia [J].Plant Physiol, 2003, 131: 1283-1293.
[12]Lay F T, Schirra H J, Scanlon M J, et al.The three-dimensional solution of NaD1,a new floral defensin fromNicotiana alataand its application to a homology model of the crop defense protein alfAFP [J].J Mol Biol, 2003, 325: 175-188.
[13]Gill R W, Sanseau P.Rapid in silico cloning of genes using expressed sequence tags (ESTs) [J].Biotechnol Annu Rev, 2000, 5: 25-44.
[14]Carvalho A O, Gomes V M.Plant defensins-prospects for the biological functions and biotechnological properties[J].Peptides, 2009, 30: 1007-1020.
[15]Pelegrini P B,Franco O L.Plant γ-thionins: novel insights on the mechanisms of actions of a multi-functional class of defense proteins [J].Int J Biochem Cell Biol, 2005, 37:2239-2253.
[16]Mendez E, Moreno A, Colilla F, et al.Primary structure and inhibition of protein synthesis in eukaryotic cell-free system of a novel thionin, γ-hordothionin, from barley endosperm [J].Eur J Biochem, 1990, 194: 533-539.
[17]Bruix M, Jimenez M A, Santoro J, et al.Solution structure of gamma 1-H and gamma 1-P thionins from barley and wheat endosperm determined by 1H-NMR: a structural motif common to toxic arthropod proteins [J].Biochemistry, 1993, 32: 715-724.
[18]Colilla F J, Rocher A, Mendez E.γ-Purothionins: amino acid sequence of two polypeptides of a new family of thionins from wheat endosperm [J].FEBS Lett, 1990,270: 191-194.
[19]Meyer B, Houlne G, Pozueta-Romero J, et al.Fruit-specific expression of a defensin-type gene family in bell pepper.Upregulation during ripening and upon wounding [J].Plant Physiol, 1996, 112: 615-622.

