三七皂甙Rg1對脂多糖誘導的大鼠肝細胞損傷的防護作用
李劍瑜 劉毅 高波 戴富林 武凡
現在廣泛認為脂多糖(liposaccharide,LPS)是導致膿毒血癥、敗血癥休克的直接原因,并可導致多功能不全綜合征(multi organ dysfunction syndrome,MODS)發生,而肝臟則是MODS最早受損和受損最為嚴重的臟器[1,2]。由于缺乏簡便有效的治療藥物,對MODS的治療至今未取得突破性的進展。三七皂甙Rg1是中國傳統中草藥三七的單體成分,其對急性肝損傷的作用和保護機理,目前鮮見報導。本實驗用透射電鏡、DNA凝膠電泳、單細胞凝膠電泳法(single cell gel electrophoresis assay,SCGE,又稱慧星電泳)探討LPS所致肝細胞損害的特點,并探討三七皂甙Rg1抗肝細胞損害的作用及作用機理,為急性肝細胞損傷的治療決策提供理論基礎。
1 材料與方法
1.1 主要試劑
LPS、膠原酶Ⅳ、percoll均購自sigma公司;triton x-100購于Furka公司,三七皂甙Rg1為昆明植物研究所產品。
1.2 實驗動物
Wistar大鼠32只,體重(200±12)g。
1.3 實驗方法
1.3.1 肝細胞分離與純化 膠原酶原位灌流法分離大鼠肝細胞,參照文獻[3]進行。取Wistar大鼠32只,隨機分為4組,每組8只,膠原酶原位灌流法分離大鼠肝細胞后用臺盼藍排除試驗檢測肝細胞存活率>90%,計算細胞濃度,調整細胞數為106個/ml。于正常對照組、LPS組、LPS+Rg1組、LPS+Quinacrine組分別加入20mmol/L PBS、3mg/L LPS、3mg/L LPS+20mmol/LRg1、3mg/L LPS+5μmol/L Quinaceine,于施加因素后0、2、4、6、8、12小時分別收集肝細胞和肝細胞培養液進行各指標測定。
1.3.2 透射電鏡觀察 肝細胞收獲后,離心棄上清,PBS漂洗三次,2%戊二醛液固定,1mol/L二甲砷酸緩沖液漂洗,1%四氧化鋨固定,丙酮系列脫水,環氧樹脂包埋,切片染色后觀察。
1.3.3 DNA 片段的提取 參照文獻[4]提取培養肝細胞的DNA片段,經空氣干燥后,溶于20μl的雙蒸水中,4℃保存。用于DNA梯度電泳。
1.3.4 SCGE檢測 參照文獻[3]并加以改進。于45℃,100μl 1%正常熔點瓊脂糖的無Ca2+、Mg2+PBS懸液澆注到磨粗的Dakin載玻片上將純化后的肝細胞進行固化成三層。然后將玻片置水平電泳槽液面下0.25cm,在堿性電泳緩沖液中放置20分鐘后25V,300mA,電泳20分鐘。用0.4mol/L Tris(pH 7.5)浸洗,每次15分鐘,共3次,然后用溴化乙錠水溶液染色。染色后的單個肝細胞應盡快在熒光顯微鏡下觀察。
1.4 統計學分析
統計軟件為SPSS 17.0統計軟件包。SCGE玻片用CM-2000B彩色醫用圖像分析系統分析。數據用±s表示,并經正態性檢驗以及方差齊性檢驗。凋亡與壞死的時相性變化相關分析采用pearson's檢驗。Rg1對大鼠肝細胞損害的抑制作用數據采用方差分析和組間q檢驗。
2 結果
2.1 肝細胞形態學變化
大鼠肝細胞在加入LPS(終濃度3mg/L)后培養2小時,透射電鏡下觀察,圖1可見較早期調亡的肝細胞。染色質固縮聚集于核膜,呈境界分明的塊狀或新月狀,在上方可見一個較小的凋亡小體。圖2可見正在形成凋亡小體的肝細胞,該細胞胞質濃縮,細胞周圍有大小不等的凋亡小體。
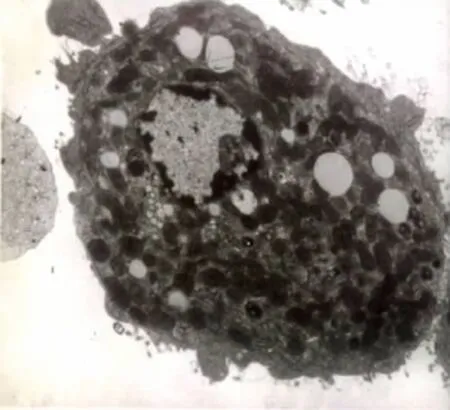
圖1 LPS處理2小時后肝細胞凋亡的電鏡檢測(×6000)
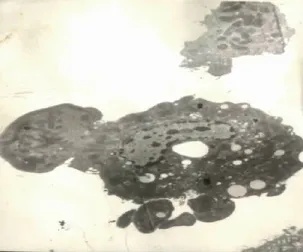
圖2 LPS處理2小時后肝細胞凋亡的電鏡檢測(×3500)
2.2 DNA梯度電泳
各組大鼠肝細胞在加入施加因素后于4小時后提取細胞DNA,在1.5%的瓊脂糖上電泳,35V,電泳2小時,泳道1為marker,泳道2和3為LPS組,泳道4為LPS+Rg1組、泳道5為LPS+Quinacrine組,泳道6為正常對照組,泳道2和3均出現典型的梯狀條帶,說明有明顯的凋亡現象,泳道4和泳道5的條帶顏色較淺,說明凋亡細胞明顯減少,而泳道6對照組無此現象,說明沒有凋亡細胞(見圖3)。
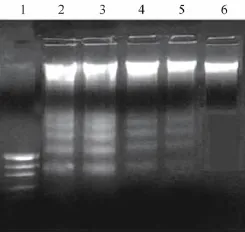
圖3 DNA梯度電泳
2.3 單細胞凝膠電泳檢測
在通常情況下,DNA雙鏈以組蛋白為核心。盤旋形成核小體。在核小體中DNA為負超螺旋結構。如果有去污劑進入細胞,核蛋白被濃鹽提取,DNA便形成殘留的類核,鏡下可見熒光強度較強的圖形頭部,無拖尾,為正常細胞(見圖4A)。如果類核中DNA斷裂,就會在核外形成一個DNA暈輪,DNA斷裂將引起超螺旋松散,電泳時DNA斷裂片向陽極伸展,形成特征性慧星(見圖4C)。細胞凋亡時DNA在質膜損傷以前斷裂,這種斷裂很容易被這種方法顯示,被稱為“凋亡之慧星”。凋亡慧星的數量可以代表凋亡細胞的數量。在慧星電泳中,壞死細胞由于細胞膜受損,DNA隨機斷裂,形成沒有明顯頭部的拖尾(見圖4B)。因為慧星電泳能將正常細胞、凋亡細胞和壞死細胞定量地區分開來,所以更有利于凋亡的深入研究。原代培養肝細胞于各培養皿中加入處理因素后培養0、2、4、6、8、12小時進行電泳。圖4為電泳2小時的各組細胞,對照組為正常細胞(見圖4A),而LPS組為凋亡細胞(見圖4C),壞死細胞(見圖4B)。
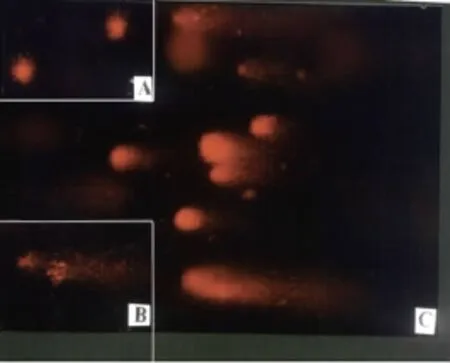
圖4 單細胞凝膠電泳檢測
由表1可見用SCGE法檢測LPS誘導肝細胞損害的時相性變化,6小時內凋亡細胞數增加較快,8小時后壞死細胞數急劇增加,12小時壞死細胞占絕大多數。
由表2可見三七皂甙Rg1明顯抑制LPS所致的肝細胞凋亡與壞死,其效果與凋亡抑制劑Quinacrine無明顯差異。
表1 用SCGE法檢測LPS誘導肝細胞凋亡與壞死的時相性變化(n=8,±s,%)

表1 用SCGE法檢測LPS誘導肝細胞凋亡與壞死的時相性變化(n=8,±s,%)
注:凋亡細胞與處理時間的相關性r=0.971,P<0.01;壞死細胞與處理時間的相關性r=0.941,P<0.01。
?
表2 Rg1對LPS誘導的原代培養8小時大鼠肝細胞損害的抑制作用(n=8,±s)

表2 Rg1對LPS誘導的原代培養8小時大鼠肝細胞損害的抑制作用(n=8,±s)
注:與正常對照組細胞相比aP<0.01;與LPS組相比b P<0.01。
?
3 討論
已知認為肝臟是LPS導致受損最為嚴重的器官[1,2],但受損的性質和機制尚存在爭議[5],更缺乏有效的治療藥物。三七皂甙具有抗炎、抗氧化、抗衰老作用,但對急性肝細胞損傷的作用機理尚未見報導。在本實驗中,用LPS(3mg/L)處理原代培養肝細胞2小時,電鏡可見典型的凋亡細胞和凋亡小體。DNA凝膠電泳也表現明顯的凋亡梯度,用SCGE檢測發現LPS(3mg/L)處理2小時肝細胞即可得到凋亡細胞為7.2%±2.6%,壞死細胞為10.2%±2.4%,提示LPS引起的肝損害的性質及嚴重程度。這說明LPS可以直接誘導肝細胞凋亡與壞死。LPS引起的肝細胞損害的時相性變化,至今也未見報導,本資料用改進的SCGE法做進一步探討發現LPS引起的肝細胞凋亡與壞死都有顯著的時相性變化。
SCGE也叫慧星電泳,是一種直接顯示單個細胞DNA損傷的微電泳技術[2,6]。但SCGE鮮見應用于肝細胞損傷研究的報道。由于SCGE能將正常細胞、凋亡細胞和壞死細胞定量地區分開,而且敏感性高、方法簡便、價格便宜,因而可以成批的檢測標本,SCGE比起昂貴的1995年Vermas首次使用的Annexinv/pI法定量分析凋亡細胞與壞死細胞顯示了更多的優越性,所以有利于肝損害的研究。用SCGE檢測原代培養肝細胞,加3mg/L LPS 2小時可以觀察到明顯的肝細胞凋亡與壞死,這比最近報導的使用LPS 10mg/L 4小時發現凋亡細胞與壞死細胞敏感的多[6]。表1顯示在8小時之內凋亡細胞與壞死細胞的增加與處理時間有明顯的相關性,到12小時凋亡細胞數急劇下降,而壞死細胞數從第8小時迅速上升,于12小時占絕大多數。本資料提示LPS誘導的肝臟損害是一個從肝細胞凋亡到壞死的過程。這一過程可能是細胞死亡連鎖反應的不同階段,其原因可能在于雖然凋亡與壞死是細胞死亡的兩種不同形式,但兩者不是毫無關聯的。它們之前的交錯在于無論哪種死亡形式,最終都伴有能量不足、大分子物質的降解以及自由基的形成[4],另一方面同一種誘導因素,如本實驗中刺激因素LPS,由于時間的不同而導致連鎖反應的兩個階段。
本資料用SCGE法表明LPS誘導的肝細胞損害的存在以及嚴重程度,因此尋找有效的特異治療MODS的藥物成為筆者進一步研究的焦點。Quinacrine可以抑制肝損害,但考慮到Quinacrine的作用有臟器選擇性及效應多樣性,該藥在進入治療急性肝損傷前,仍有許多向題尚未解決[3,4]。在國外學者把MODS稱為介質病,在用介質療法顯得蒼白無力的時候[3],本課題組用靈敏度高、價格便宜的SCGE對中藥進行篩選。研究發現具有抗炎、抗氧化、抗衰老作用的三七皂甙單體Rg1對急性肝損害有明顯抑制作用,顯著地抑制肝細胞凋亡與壞死,在治療急性肝損傷有著Quinacrine不可替代的優越性,預示其應用的廣泛前景。
總之,本資料提示SCGE法是研究肝細胞損害并進行藥物篩選的良好方法。用該法筆者發現LPS誘導的肝細胞損害是一個從肝細胞凋亡到壞死的過程,并證實三七皂甙Rg1為肝細胞損害的有效的保護劑,深化了對MODS的認識,為MODS的治療提供新的思路。
[1]武凡,張樹三,康格非.三七皂甙對肝纖維化大鼠分泌型磷脂酶A2和腫瘤壞死因子表達的影響[J].中華肝臟病雜志,2003,11(1):51-52.
[2]褚麗萍,劉強,王芹,等.線粒體DNA 4977bp缺失和彗星分析評價腫瘤細胞的輻射敏感性[J].中華放射醫學與防護雜志,2008,28(2):142-145.
[3]Relja B,Schwestka B,Lee VS,et al.Inhibition of C-Jun N-terminal kinase after hemorrhage but before resuscitation mitigates hepatic damage and inflammatory response in male rats[J].shock,2009,32(5):509-516.
[4]Croner RS,Hohenberger W,Jeschke MG.Hepatic gene expression during endotoxemia[J].J Surg Res,2009,154(1):126-134.
[5]王東吉,武凡.三七皂甙單體Rb1對大鼠腦缺血再灌注時腦細胞凋亡及cPLA2蛋白表達的影響[J].中國康復醫學雜志,2007,22(5):414-415.
[6]Greulich KO.Photons bring light into DNA repair:The comet assay and laser microbeams for studying photogeno toxicity of drugs and ageing[J].J Biophotonics,2011,4(3):165-171.

