復方苦參注射液對子宮內膜癌HEC-1B細胞Bcl-2/Bax、P27表達的影響*
張文謹,彭 瑤,連增林,靳 冉,李晉生,海麗娜
子宮內膜癌是婦科常見的惡性腫瘤,發病率僅次于子宮頸癌。大部分子宮內膜癌的發生與雌激素有關,分化好的腺癌雌激素受體陽性率高[1]。子宮內膜癌的治療方法眾多,中藥具有一定的抗腫瘤作用。復方苦參注射液是目前臨床應用比較廣泛的腫瘤輔助治療藥物之一,對放化療均有一定的增效減毒作用,但是缺乏其作用機制的深入研究。
本研究采用復方苦參注射液及其組方成分作用子宮內膜癌HEC-1B細胞,觀察用藥各組對HEC-1B細胞增殖作用的影響,初步探討復方苦參注射液抗腫瘤作用機制,研究不同藥物對Bcl-2/Bax、P27表達的影響。
1 材料與方法
1.1 實驗材料 人子宮內膜癌HEC-1B細胞株(中國科學院上海細胞庫),順鉑(北京中日友好醫院),復方苦參注射液、單苦參注射液、單白土苓注射液(均由山西振東制藥有限公司提供),DMEM培養基(美國Gibco公司),胎牛血清(FBS)(美國Gibco公司),Reverse Transcription System(美國Promega公司),Trizol Reagent(美國invitrogen公司),GoldView TM核酸染料、100 bp DNA Ladder,PCR反應體系(購于北京賽百盛基因技術有限公司)。
Mastercycler pros梯度PCR儀(德國Eppendorf公司),Molecular Imager Gel Doc(美國 Bio-Rad Laboratories公司),Inc、HERA cell 150恒溫二氧化碳(CO2)培養箱(美國 Thermo Electron Corporation公司),Olympus倒置顯微鏡(日本Olympus Corporation公司)。
所用引物序列以專業引物設計軟件Premier 5.0設計而成。ERα36、ERα66、GAPDH 引物由北京賽百盛基因技術有限公司合成。
1.2 實驗方法
1.2.1 細胞培養 HEC-1B細胞常規培養于含10%FBS的DMEM培養液中,放置于37℃、5%CO2飽和濕度的孵育箱中孵育,2.5%胰酶常規消化傳代培養,實驗時取對數生長期細胞。
1.2.2 MTT法檢測細胞增殖 取對數生長期HEC-1B細胞,以0.25%胰酶消化后用DMEM培養基(含10%胎牛血清)制成單細胞懸液,以1×105個/mL細胞濃度接種于96孔培養板中,100 μL/孔。當細胞生長至70%~80%融合時,換成無血清培養液繼續培養24 h,使細胞同步于靜止期后分組[2]。一共分為5組:細胞對照組、陽性對照組(DDP)、復方苦參注射液組(FK)、苦參注射液組(K)、白土苓注射液組(B)。順鉑注射用粉針劑用生理鹽水稀釋后加DMEM培養基,設高中低3個劑量組,終濃度分別為5、2.5、1.25 μg/mL。復方苦參注射液加DMEM培養基稀釋,終濃度為10%、5%、2.5%。各組藥物濃度配比設計見表1。各用藥組每個濃度均設5個平行孔,用藥處理 24、48、72 h 后,加入四甲基偶氮唑藍(MTT)繼續培養4 h后,吸去每孔的液體,加入二甲基亞砜(DMSO)100 μL/孔,微振蕩器上震蕩 15 min,用雙波長法(492 nm/630 nm)測出細胞對照組和各實驗組的吸光度值[3]。本實驗重復3次,按公式計算細胞生長抑制率(IR):IR=(1-實驗組 OD/對照組 OD)×100%。
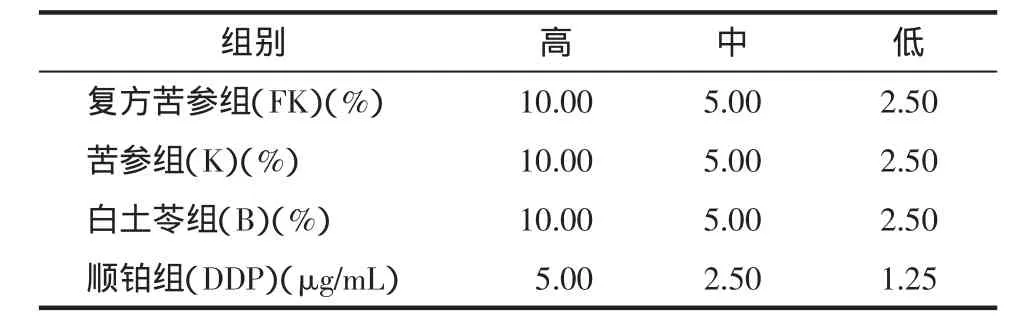
表1 各給藥組藥物終濃度配比表
1.2.3 RT-PCR法檢測Bcl-2/Bax、P27表達水平取對數生長期細胞,先用無血清培養液培養24 h,使細胞處于靜止期同步化后,分為5組:復方苦參注射液組(FK)、苦參注射液組(K)、白土苓注射液組(B)、順鉑注射液組(DDP)、空白對照組。藥物配制方法同上,各組藥物濃度設計見表2。加入各組藥物繼續培養48 h。

表2 各給藥組藥物終濃度配比表
按Trizol法提取細胞總RNA,紫外分光光度法測定提取的總RNA含量及純度,按照逆轉錄試劑盒說明書將mRNA逆轉錄為cDNA,以三磷酸甘油醛脫氫酶(GAPDH)為內參照,進行PCR反應。引物序列見表3。反應程序:Bcl-2(94℃變性5 min,94℃30秒,58℃ 30秒,72℃ 1 min,72℃延伸 5 min,共35個循環);Bax(94℃變性 150 s,94℃ 40秒,63℃40秒,72℃40 s,72℃延伸7 min,共30個循環);P27(94℃變性 5 min,94℃ 30秒,55℃ 30秒,72℃1 min,72℃延伸5 min,共 35個循環);GAPDH(95℃變性 5 min,94℃1 min,55℃ 1 min,72℃ 1 min,72℃延伸7 min,共30個循環)。
反應結束后以含有GoldView TM核酸染料的1.5%的瓊脂糖凝膠電泳。在紫外光凝膠成像分析系統下攝片,以Bcl-2/Bax、P27基因片段與GAPDH片段灰度值的比值作為其相應表達水平數值。實驗重復3次。

表3 引物序列及其PCR產物長度
1.3 統計學分析 應用SPSS 18.0軟件進行統計學分析,組間比較采用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 MTT法檢測細胞增殖 結果表明,各組藥物作用48 h后顯示出對細胞的抑制作用,復方苦參注射液和苦參注射液低濃度對人子宮內膜癌HEC-1B細胞不但沒有明顯的抑制增殖作用反而出現輕微的促增殖作用,但隨用藥濃度的增加表現出抑制作用,并且該作用隨著藥物劑量的增加而逐漸增強,其作用呈濃度依賴趨勢。白土苓注射液幾乎不影響細胞生長,吸光度值與空白對照組比較,組間差異無統計學意義(P>0.05)。不同給藥組組間比較差異有統計學意義(P<0.05),復方苦參注射液組對細胞抑制作用最強。各組細胞抑制率見圖1。
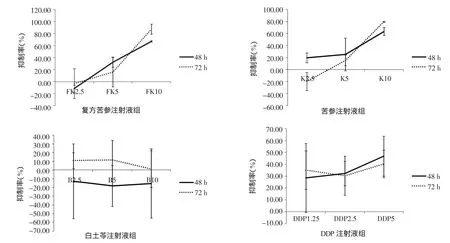
圖1 不同給藥組對HEC-1B細胞抑制率
2.2 RT-PCR檢測Bcl-2/Bax、P27的表達 從電泳圖觀察,FK、K、DDP組Bcl-2的表達較空白對照組明顯減弱(P<0.05),而Bax、P27的表達量明顯增強,組間差異有統計學意義(P<0.05)。見圖2、圖3。
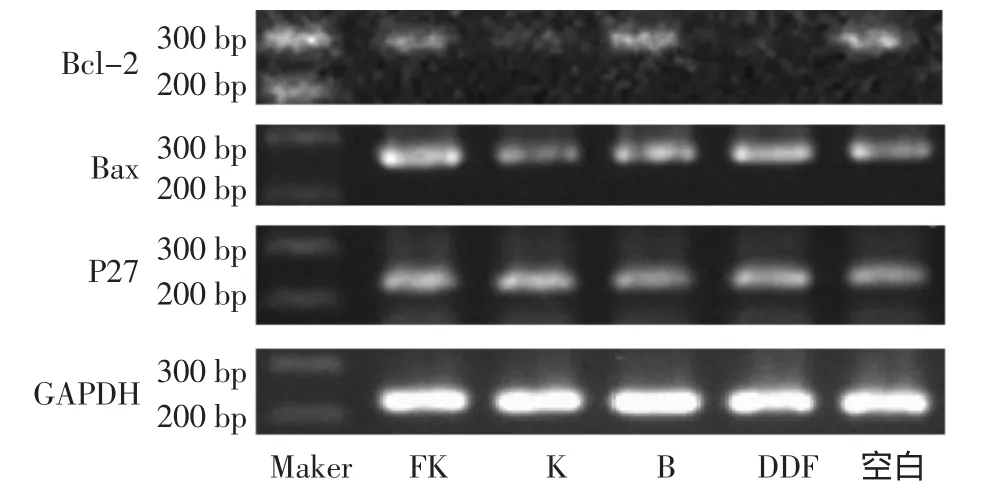
圖2 不同給藥組對Bcl-2/Bax、P27 mRNA水平的影響
3 討論
復方苦參注射液(巖舒)是以苦參、白土苓為主的兩味中草藥經現代技術加工制成,其功效為清熱利濕、涼血解毒、散結止痛。臨床多用于晚期癌癥的輔助治療,具有較好的輔助抗癌及緩解患者癌性疼痛的作用。近年來,大量臨床研究證實,復方苦參注射液在放化療中不僅能夠增強機體免疫功能,而且具有增效減毒作用[4]。本研究證實了復方苦參注射液和苦參注射液能夠抑制人子宮內膜癌HEC-1B細胞生長,且該作用呈劑量依賴關系。
Bcl-2基因家族是細胞凋亡的重要調節者,其成員通過調節線粒體外膜的通透性和完整性起重要調控作用。正常子宮內Bcl-2與Bax表達具有一定周期性,Bcl-2表達增殖期高于分泌期、Bax表達分泌期高于增殖期[5-7],說明雌孕激素可能通過調節細胞凋亡與增殖來維持子宮內膜的正常生理功能。本研究結果顯示,復方苦參注射液、苦參注射液均能有效抑制HEC-1B細胞Bcl-2基因mRNA水平的表達,但苦參并未見增加HEC-1B細胞Bax基因表達的作用,而復方苦參注射液在抑制Bcl-2表達的同時還可增加Bax基因表達,證明復方苦參注射液的抗腫瘤作用機制在于對Bcl-2/Bax表達的調控,誘導腫瘤細胞凋亡。
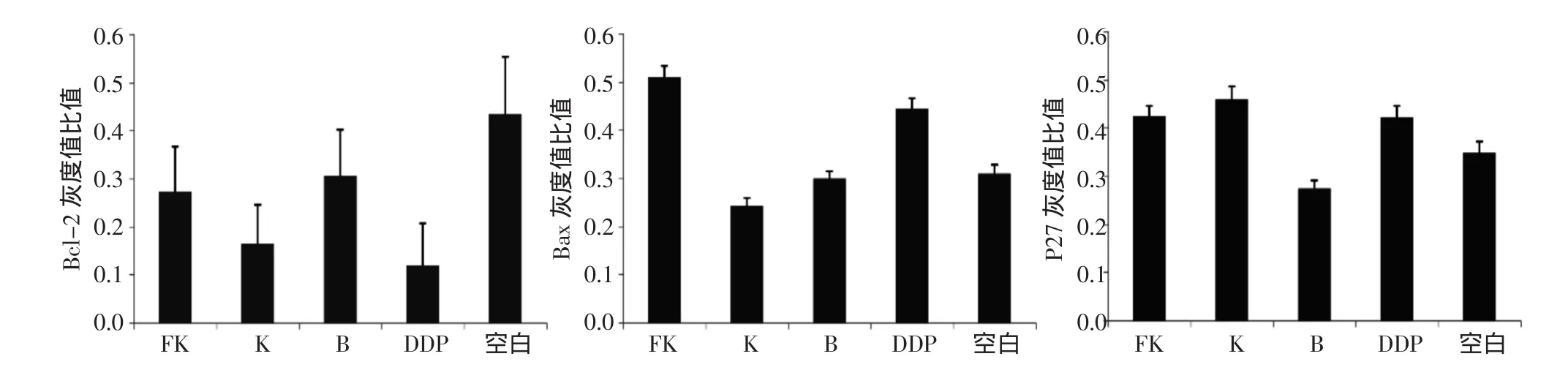
圖3 不同給藥組Bcl-2、Bax、P27相對表達量
P27基因是一種調控細胞周期并抑制細胞分裂的重要基因,定位于第12號染色體短臂1區3帶(12p13),其編碼的蛋白P27kip1是一種非特異性多功能周期素依賴性激酶抑制劑(CDKI),通過抑制cyclin-CDK復合物的生物活性來調控細胞周期,最終導致腫瘤細胞在G1/S期停滯[8]。研究發現P27在子宮內膜增殖過程中起到調控作用,其表達缺失是發展為子宮內膜癌的重要一步。本研究結果顯示復方苦參注射液和苦參注射液均有增加子宮內膜癌HEC-1B細胞P27基因mRNA水平表達,證明復方苦參注射液對HEC-1B細胞抑制作用還依賴于對細胞周期的影響[9]。
[1]孫健衡.觀念變化與臨床處理子宮內膜癌的一些問題[J].現代婦產科進展,2001,10(1):1-2.
[2]楊 勤,張亞聲.復方苦參注射液對胃癌SGC-7901細胞VEGF、CXCR4表達的影響[J].現代腫瘤醫學,2010,18(8):1481-1484.
[3]葉正青,梁重峰,丁 海,等.復方苦參注射液對人肝癌SMMC-7721腫瘤細胞作用的實驗研究[J].山東醫藥,2009,49(16):44-45.
[4]李春梅,張宗江,石 巖.復方苦參注射液的臨床應用[J].疾病監測與控制雜志,2010,4(6):330-332.
[5]Mertens HJ,Heineman MJ,Evers JL.The expression of apoptosis related proteins Bcl-2 and Ki67 in endometrium of ovulatory menstual cycles[J].Gynecol Obstet Invest,2002,53(4):224-230.
[6]Vaskivuo TE,Stenback F,Karhumaa P,et al.Apoptosis and apoptosis related proteins in human endometrium[J].Mol Cell Endocrinol,2000,165(122):75-83.
[7]Meresman GF,Bilotas MA,Lombardi E,et al.Effect of GnRH analogues on apoptosis and release of interleukin-1 beta and vascular endothelial growth factor in endometrial cellculturesfrompatientswithendometriosis[J].HumReprod,2003,18(9):1767-1771.
[8]Zhi JD,Xi JW.Relationship between expression of p27Kip1and cell proliferation in breast carcinoma tissue[J].Chin J Cancer Prev Treat,2009,16(2):114.
[9]Masciullo V,Susini T,Zamparelli A,et al.Frequent loss of expression of the cyclin-dependent kinase inhibitor p27Kip1 in estrogen-related endometrial adenocarcinomas[J].Clin Cancer Res,2003,9(14):5332-5338.

