HPLC測定奧美沙坦酯氫氯噻嗪片含量和有關物質
趙建峰
(北京萬生藥業有限責任公司,北京 101113)
奧美沙坦酯氫氯噻嗪片是治療高血壓新藥,2010年在我國上市,臨床用于治療高血壓、充血性心力衰竭。奧美沙坦酯與氫氯噻嗪有互補的作用機制,兩者合用既能協同降壓,又可以減少氫氯噻嗪的應用劑量,具有快速起效、強效降壓和持久降壓的特點,適于國內眾多高血壓患者使用。由于該產品上市時間短,目前文獻少見對該產品有關物質測定方法的報道,本研究建立了該產品含量和關物質的HPLC測定方法,簡單快速,結果準確。
1 儀器與試藥
安捷倫1200高效液相色譜儀及其色譜工作站(安捷倫公司);奧美沙坦酯對照品(原中國藥品生物制品檢定所,批號100864-200601);氫氯噻嗪對照品(原中國藥品生物制品檢定所,批號100309-200702);奧美沙坦酸對照品(自制);氯噻嗪對照品(中國藥品生物制品檢定所,批號101129-201101);奧美沙坦酯氫氯噻嗪片(自制,規格:奧美沙坦酯 20 mg,氫氯噻嗪 12.5 mg);乙腈、甲醇為色譜純,其余試劑均為分析純。
2 含量測定研究[1]
2.1 色譜條件[2]
C18色譜柱 (Kromasil,5μm,4.6 mm×250 mm);流動相:A液:0.02 mol/L磷酸二氫鈉溶液(用磷酸調節 pH 至 3.0),B 液:甲醇 - 乙腈(100∶900);梯度洗脫,0~17 min,流動相A的體積分數從85%降至20%;17~20 min流動相A的體積分數從20%增加至85%;20~25 min流動相A的體積分數保持85%不變。檢測波長為272 nm;柱溫為30℃。理論塔板數按奧美沙坦酯峰和氫氯噻嗪峰計應均不低于3 000。奧美沙坦酯峰和奧美沙坦酸峰的分離度應符合要求,氫氯噻嗪峰和氯噻嗪峰的分離度應符合要求。
2.2 線性關系考察
分別精密取奧美沙坦酯對照品20.26 mg,氫氯噻嗪對照品12.65 mg,精密稱定,置100 mL量瓶中,加稀釋液[0.02 mol/L磷酸二氫鈉溶液(調節 pH 至 3.0)-乙腈(50∶50)]超聲溶解后并稀釋至刻度,搖勻。在上述色譜條件下檢測,結果見圖1。
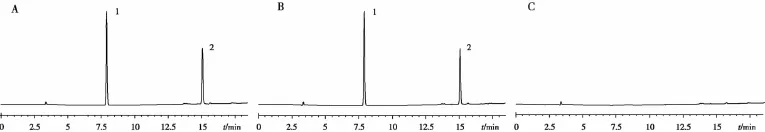
圖1 奧美沙坦酯氫氯噻嗪片含量HPLC圖A對照品 B供試品 C陰性對照
精 密 量 取 1、5、10、15、20 mL 上 述 溶 液 置100 mL量瓶中,用稀釋液稀釋至刻度,搖勻。精密量取各20μL注入液相色譜儀,測定峰面積。根據奧美沙坦酯濃度C與峰面積A繪制標準曲線,并求得線性回歸方程:

奧美沙坦酯濃度在0.002 026~0.040 52 mg/mL之間呈良好的線性關系;根據氫氯噻嗪濃度C與峰面積A繪制標準曲線,并求得線性回歸方程:
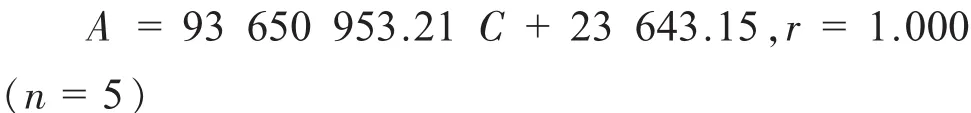
氫氯噻嗪濃度在0.001 265~0.025 30 mg/mL之間呈良好的線性關系。
2.3 回收率試驗
按處方量稱取輔料,另取奧美沙坦酯對照品20 mg和氫氯噻嗪對照品12.5 mg各3份,分別置100 mL量瓶中,加稀釋液超聲溶解并稀釋至刻度搖勻,濾過,精密量取5 mL置50 mL量瓶中,用稀釋液稀釋至刻度搖勻,得中濃度供試品溶液(100%)3份,同法制得低濃度供試品溶液(80%)和高濃度供試品溶液(120%)各3份。按色譜條件進樣,并按外標法以峰面積計算回收率,結果奧美沙坦酯平均回收率為99.8%,RSD為0.59%(n=9);氫氯噻嗪平均回收率為99.5%,RSD為0.68%(n=9)。
2.4 精密度試驗
取奧美沙坦酯氫氯噻嗪片1批(自制),于同1日內及不同日內分別按上述方法測定含量5次,日內奧美沙坦酯的平均含量為99.8%,RSD為0.35%,氫氯噻嗪的平均含量為99.6%,RSD為0.30%;日間奧美沙坦酯的平均含量為99.6%,RSD為0.46%,氫氯噻嗪的平均含量為99.5%,RSD為0.58%。
2.5 溶液的穩定性和重現性試驗
取含量測定項下的溶液,分別在 0、1、2、4 h進樣,測得奧美沙坦酯峰面積的RSD值為0.55%,氫氯噻嗪峰面積的RSD值為0.52%。表明本品4 h內穩定,進樣重現性良好。
3有關物質研究[3]
3.1 色譜條件
檢測波長為225 nm;其他色譜條件同含量測定項。
3.2 實驗方法
取本品20片,研細,精密稱取適量(約含奧美沙坦酯20 mg),置100 mL量瓶中,用稀釋液超聲溶解并稀釋至刻度,振搖均勻,用0.45μm微孔濾膜濾過,續濾液作為供試品溶液。取供試品溶液用稀釋液稀釋100倍作為對照溶液;量取對照溶液20μL注入液相色譜儀,調節檢測靈敏度,使氫氯噻嗪峰高約為滿量程刻度的20%;再精密量取供試品溶液和對照溶液各20μL,分別注入液相色譜儀。供試品溶液如顯雜質峰,扣除空白溶劑峰,在氫氯噻嗪主峰相對保留時間0.86處的雜質不得大于對照溶液中氫氯噻嗪主峰面積(1.0%),在奧美沙坦酯主峰相對保留時間0.92處的雜質不得大于對照溶液中奧美沙坦酯主峰面積(1.0%),其他單個雜質不得大于對照溶液中奧美沙坦酯和氫氯噻嗪兩主峰面積和的50%(0.5%),總雜質不得大于對照溶液中奧美沙坦酯和氫氯噻嗪兩主峰面積和的1.0倍(1.0%)。檢測結果見圖2。
3.3 溶液穩定性考察
按要求配制供試液和對照液,于 0、1、2、3 h分別注入液相色譜儀,證明本品溶液放置2 h,相對奧美沙坦酯0.92處的雜質峰明顯增加。

圖2 奧美沙坦酯氫氯噻嗪片有關物質的HPLC圖A供試品 B陰性對照
3.4 專屬性考察
高溫破壞試驗(120℃放置 2 h),光照破壞試驗(4 500 lx放置10 d),強酸破壞試驗(加1 mol/L HCl溶液 5 mL,于 60℃水浴放置 0.5 h),強堿破壞試驗(加 1 mol/L NaOH溶液 5 mL,于 60℃水浴放置0.5 h)和氧化破壞試驗(加6%雙氧水溶液 5 mL,于60℃水浴放置 1 h),上述條件下均有新雜質產生,主成份峰有不同程度的降解,總雜質明顯增大,主峰與雜質峰能夠完全分離。
4 討論
有關物質檢查溶液穩定性考察表明,溶液放置2 h,雜質奧美沙坦酯酸峰明顯增大,故本品應臨用新配。
經反復試驗選定色譜條件,該條件下,氫氯噻嗪主峰相對保留時間0.86處的雜質為氯噻嗪,二者分離度為3.0;奧美沙坦酯主峰相對保留時間0.92處的雜質為奧美沙坦酸,二者分離度為5.5,主峰和雜質峰能夠很好的分離。測定方法研究結果表明,該方法精密度高,重現性好,可用于奧美沙坦酯氫氯噻嗪片的含量和有關物質測定。
[1]國家藥典委員會.中華人民共和國藥典(二部)[M].北京:中國醫藥科技出版社,2010:附錄194.
[2]陳敏,周斌,魏大鵬.HPLC法測定復方奧美沙坦氫氯噻嗪片的含量[J].中國新藥雜志,2006,15(23):2050-2052.
[3]張玉琥.仿制藥有關物質研究的特點及研究思路[J].中國執業藥師,2009,6 (6):31-34.

