RRM1和ERCC1在非小細胞肺癌中的表達及意義
(石家莊市第一醫院,石家莊050011)
肺癌是我國目前發病率和病死率最高的惡性腫瘤。化療是晚期非小細胞肺癌(NSCLC)主要的治療手段,而NSCLC對藥物的反應率僅為20% ~30%。尋找合適化療方案和保證較高的藥物敏感性是腫瘤治療的當務之急。根據生物靶標選擇某藥物的化療優勢人群即個體化化療是當今一大研究熱點,近年來,隨著腫瘤分子生物學的發展,已發現核糖核苷酸還原酶M1(RRM1)、切除修復交叉互補基因1(ERCC1)、Beta-微管蛋白、乳腺癌易感基因BRCA 1及胸苷酸合成酶的表達水平與化療藥物療效及預后密切相關,并有可能成為預測療效進行個體化化療的重要因素。本研究采用免疫組化方法檢測DNA修復基因RRM1、ERCC1在NSCLC腫瘤組織中的表達,探討兩者與NSCLC病理特征的關系、兩者的相關性及吉西他濱+順鉑聯合化療對患者預后的影響。
1 資料與方法
1.1 臨床資料 收集石家莊市第一醫院2006~2009年收治、病理學診斷明確的ⅢB期及以上的NSCLC初次化療患者30例,男20例、女10例,年齡44~73歲,中位年齡58歲。取患者手術或穿刺標本,經甲醛固定,石蠟包埋備用。病理類型:鱗癌14例,腺癌8例,其他8例。按照國際抗癌聯盟1997年修訂的肺癌分期標準,ⅢB期19例,Ⅳ期11例。有吸煙史21例,無吸煙史9例。患者自發病時起均隨訪2年。
1.2 檢測方法 山羊抗人RRM1單克隆抗體購自武漢三鷹生物技術有限公司,鼠抗人ERCC-1單克隆抗體購自福建邁新生物技術有限公司。采用免疫組化染色PV-9000二步法檢測肺癌組織中RRM1和ERCC1蛋白的表達,試劑盒購自北京中山金橋生物技術有限公司,按說明書操作。用PBS代替一抗作陰性對照。每個病例隨機選擇2個高倍視野計數200個細胞,按照陽性細胞數占同類細胞數的比例進行等級劃分。陽性細胞數<25%為(-)、25% ~50%為(+)、51% ~75%為(++)、>75%為(+++)。
1.3 統計學方法 使用SPSS16.0統計軟件進行數據處理,應用χ2檢驗及Fisher's確切概率法進行率的比較,用Pearson法行相關性分析。預后的判斷采用Kaplan-Meier生存分析、Log-rank時序檢驗分析方法。P≤0.05為差異有統計學意義。
2 結果
2.1 RRM1、ERCC1蛋白表達與NSCLC患者臨床病理因素的關系 RRM1染色大多定位于細胞質,ERCC染色大多定位于細胞核。二者與臨床病理因素的關系見表1。
2.2 RRM1和RECC蛋白表達的相關性 經Pearson相關分析,NSCLC腫瘤組織中RRM1與ERCC陽性表達呈正相關(r=0.439,P=0.027)。見表2。
2.3 ERCC和RRM1蛋白表達與患者的預后 30例患者中,死亡26例(86.67%),中位總生存期10.33個月,中位無進展生存期 5.74個月。在RRM1陽性的17例患者中,中位總生存期8.14個月,中位無進展生存期4.94個月;而RRM1陰性的13例患者中,中位總生存期12.96個月,中位無進展生存期6.74個月,RRM1陰性患者中位總生存期明顯長于 RRM1 陽性者(χ2=14.018,P=0.000),而RRM1陰性患者中位無進展生存期明顯長于RRM1 陽性者(χ2=5.696,P=0.017)。
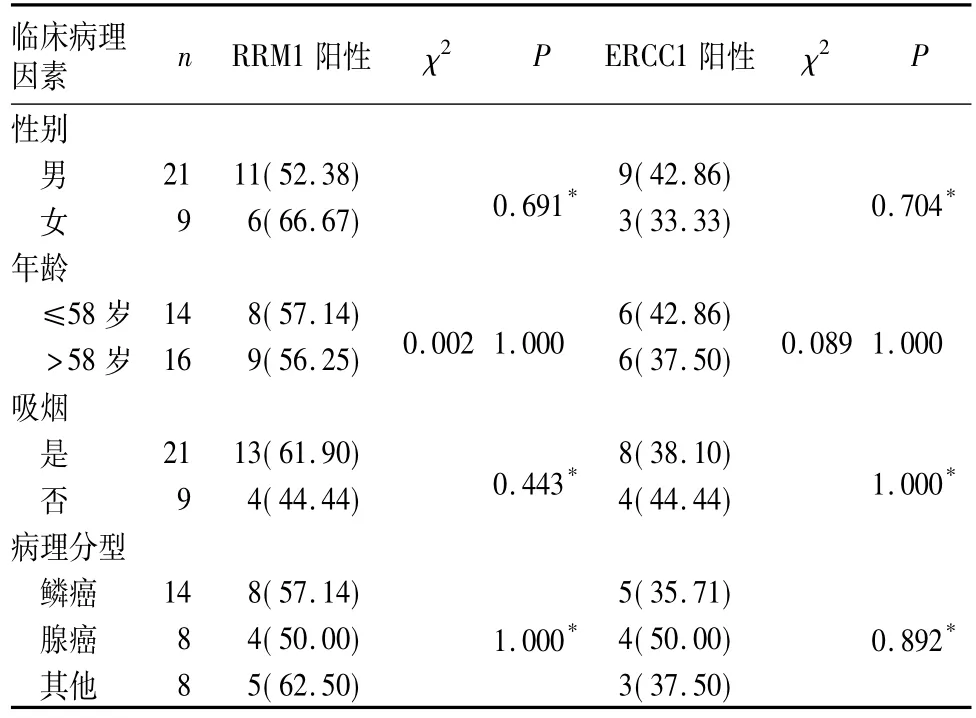
表1 RRM 1、ERCC蛋白表達與NSCLC患者臨床病理因素的關系[例(%)]
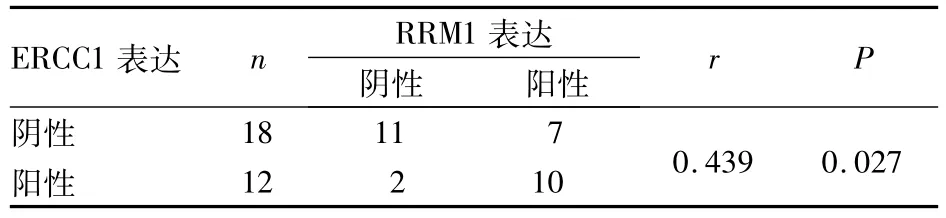
表2 RRM 1和RECC1蛋白表達NSCLC腫瘤組織中的相關性
在ERCC陽性的13例患者中,中位總生存期8.65個月,中位無進展生存期4.96個月;而ERCC1陰性的13例患者中,中位總生存期11.70個月,中位無進展生存期6.40個月。ERCC1陰性患者中位總生存期明顯長于ERCC1陽性者(χ2=5.105,P=0.024),而RRM1陰性患者無進展生存期明顯長于RRM1 陽性者(χ2=4.275,P=0.039)。
3 討論
核苷酸切除修復系統(NER)是DNA損傷修復的重要途徑,是多種酶參與的復雜體系。在人類腫瘤細胞中,化療藥物引起的DNA損傷主要由NER途徑修復,ERCC1、RRM1都是NER家族重要的成員。ERCC1定位于19號染色體上,在NER系統中起著識別損傷DNA和核酸內切酶的雙重功能。順鉑主要通過與DNA雙鏈耦合形成加合物,影響DNA的復制與轉錄,從而導致DNA損傷,進而誘導腫瘤細胞凋亡[1]。機體正是通過NER途徑將順鉑-DNA加合物的損傷修復,從而形成對順鉑的耐藥。研究表明,ERCC1基因或蛋白高表達的患者對鉑類耐藥,可作為腫瘤細胞中順鉑-DNA加合物修復能力的檢測標志物[2,3]。同時 ERCC1基因或者蛋白高表達常出現在對吉西他濱/順鉑耐藥的腫瘤患者中[4]。
RRM1是核苷酸還原酶(RR)調節M1亞單位。RR是DNA合成通路中的限速酶,它能使二磷酸核苷酸轉化為二磷酸脫氧核苷酸,后者是DNA合成和修復必不可少的原料,因此RR是DNA合成和修復的限速酶[5]。RR包括 RRM1和 RRM2兩個亞單位,RRM1是核苷酸結合位點,控制底物的特異性和整個酶的活性,同時也是核苷類似物的化療藥物吉西他濱的結合位點,通過抑制核苷酸還原酶來抑制脫氧核苷酸的生成,抑制DNA的合成和修復,達到殺傷腫瘤細胞的目的,因此RRM1是吉西他濱重要的分子靶點。Rosell等[6]研究認為,RRM1高表達與吉西他濱/順鉑方案化療耐藥相關。陳芹等[7]采用實時熒光定量PCR對NSCLC患者(Ⅰ~Ⅲ期)瘤內ERCC1、RRM1和BRCA1 mRNA相對于管家基因的表達水平進行檢測,結果顯示RRM1高表達組的總生存時間明顯長于低表達組。ERCC1高表達組生存曲線有較低表達組延長的趨勢。Simon等[8]發現,在可切除的NSCLC患者中,ERCC1高表達組的中位生存時間顯著長于低表達組,但在晚期NSCLC患者(Ⅲ~Ⅳ期)中,ERCC高表達往往導致腫瘤對鉑類化療耐藥,使化療失敗。本研究顯示,30例晚期NSCLC患者中,ERCC1低表達組的總生存期和無疾病進展生存期均較ERCC1高表達組延長。可見ERCC1表達對患者生存的影響在早期NSCLC和晚期NSCLC起不同作用:早期NSCLC患者術后ERCC1高表達往往預示術后生存期較長,但晚期NSCLC患者術后高表達提示機體對吉西他濱+順鉑的耐藥性增加,故晚期NSCLC患者ERCC1低表達者預后更好。
Rosell等[9]采用RT-PCR方法對晚期NSCLC患者的病理標本進行檢測,發現在 mRNA水平上,RRM1低表達組較高表達組的中位生存期明顯延長(13.7 個月 vs 3.6 個月,95%CI=9.6 ~17.8,P=0.009)。Ceppi等[10]用類似的方法對晚期 NSCLC患者進行檢測,證實RRM1低表達組中位生存期明顯延長(13.9 個月 vs 10.9 個月,P=0.039)。本研究采用免疫組化方法對30例中晚期NSCLC患者進行檢測,結果顯示,在蛋白水平上RRM1低表達組較高表達組患者的中位生存期、無疾病進展期均明顯延長,與上述結論一致。
Rosell等[9]發現,RRM1 與 ERCC1 均低表達組的中位生存期明顯長于兩種基因均高表達組。Ceppi等[10]發現,RRM1和ERCC1表達水平有高度相關性,兩者均低者預后較好。林莉等[11]通過實時熒光定量PCR技術檢測6株肺癌細胞系中RRM1和ERCC1基因的表達情況,發現ERCC1和RRM1的表達具有相關性。本研究從蛋白表達水平印證兩者的相關性,與文獻報道相符。ERCC1和RRM1是DNA修復過程中不可或缺而又緊密聯系的重要因子,當ERCC1與XPD、XPG、XPA等修復基因將DNA鏈中受損的部分切除后,DNA鏈上留下的空缺就由RRM1提供的核苷酸來填補[12]。聯合檢測腫瘤組織中RRM1和ERCC1蛋白的表達對預測NSCLC患者應用吉西他濱/順鉑方案的療效有重要意義。
綜上所述,RRM1和ERCC1具有一定的相關性,其具體機制需要進一步探討。在晚期NSCLC患者治療中,檢測兩者的表達對評估吉西他濱+順鉑耐藥、指導臨床化療方案及預測患者預后具有重要意義。
[1]Martin LP,Hamilton TC,Schilder RJ.Platinum resistance:the role of DNA repair pathways[J].Clin Cancer Res,2008,14(5):1291-1295.
[2]LIQ,Yu JJ,Mu C,etal.Association between the level of ERCC1 expression and there pair of cisplatin-induced DNA damage inhuman ovarian caneer cells[J].Anticaneer Res,2000,20(2A):645-652.
[3]Gossage L,Madhusudan S.Current status of excision repair cross complementing-group 1(ERCC1)in cancer[J].Cancer Treat Rev,2007,33(6):565-577.
[4]Zhou W,Liu G,Park S,et al.Gene smoking interaction associations for the ERCC1 polymorphism in the risk of lung cancer[J].Cancer Epidermal Biomarkers Prev,2005,14(2):491-496.
[5]Rosell R,Crino L,Danenberg K.Targeted therapy in combination with gemcitabine in non-small cell lung cancer[J].Semin Oncol,2003,4(Suppl 10):19-25.
[6]Rosell R,Felip E,Taron M,et al.Gene expression as a predictive marker of outcome in stageⅡB-ⅢA-ⅢB non-small cell lung cancer after induction gemcitabine-based chemotherapy followed by resectional surgery[J].Clin Cancer Res,2004,10(12):4215-4219.
[7]陳芹,周彩存,張碩,等.ERCC1、RRM1和 BRCA1在 NSCLC中的表達及預后意義[J].腫瘤,2007,27(9):719-722.
[8]Simon GR,Sharma S,Cantor A,etal.ERCC1 expression is a predictor of survival in resected patientswith non-small cell lung cancer[J].Chest,2005,127(3):978-983.
[9]Rosell R,Danenberg KD,Alberola V,et al.Ribonucleotide reduc-Tasemessenger RNA expression and survival in gemcitabine/cis-platin-treated advanced non-small cell lung cancer patients[J].Clin Cancer Res,2004,10(4):1318-1325.
[10]Ceppi P,VolanteM,Novello S,etal.ERCC1 and RRM1 gene expression but not EGFR are predictive of shorter survival in advanced non-small cell lung cancer treated with cisplatin and gemcitabine[J].Ann Oncol,2006,17(2):1818-1825.
[11]林莉,劉曉晴,王偉霞,等.實時熒光定量-PCR法檢測6種肺癌細胞系中吉西他濱耐藥相關基因的表達[J].腫瘤,2008,28(3):228-231.
[12]Rosell R,Cobo M,Isla D,et al.Pharmacogenomics and gemcitabine[J].Ann Oncol,2006,17(Suppl 5):v13-v16.

