椎旁肌力量失衡與雙足鼠脊柱側凸模型的建立
沈曉龍,周許輝,劉 洋,田 野,東 人,袁 文
建立理想的脊柱側凸動物模型是探索其發病機制、治療方法的重要步驟,同時為特發性脊柱側凸的深入研究提供參考。A型肉毒毒素(botulinum toxin A,BTX-A)能阻礙突觸前膜乙酰膽堿的釋放,使神經肌肉接頭傳導受阻,從而導致肌肉松弛,甚至癱瘓[1]。本研究組前期研究發現BTX-A注射至雙足鼠一側椎旁肌,致椎旁肌力量失衡,可成功建立脊柱側凸模型。然而,BTX-A肌肉注射作用維持時間有限,一般注射后2~5 d起效,4周后肌肉可發生短暫顫動,13周后神經肌肉接頭功能基本恢復,肌肉可正常收縮[2]。隨著BTX-A的作用消失,雙足鼠脊柱側凸角度該如何變化,追加注射側凸狀態是否能夠復現,本研究將就這些問題做進一步探討。
1 材料和方法
1.1 雙足鼠模型制備
30只4周齡雌性 SD大鼠(SPF級),體重(94.8±5.4)g,由第二軍醫大學動物中心提供。采用10%水合氯醛,按照3 mL/kg的劑量對大鼠行腹腔注射麻醉。取雙側上肢環形切口,分離肌肉筋膜,結扎大血管,肩關節處截除上肢,止血后縫扎切口。所有大鼠術后即刻行高籠喂養,將飼料槽及飲水瓶懸高,根據大鼠身長情況,動態調整懸吊高度(見圖1)。雙足鼠模型建立1周后注射BTX-A。
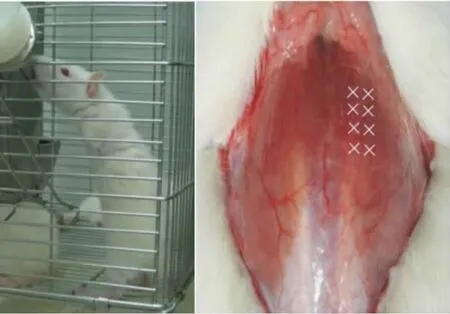
圖1 雙足鼠站立取水 圖2 右側椎旁肌注射BTX-A,“×”為注射點Fig.1 Rats were able to stand immediately after the amputations of forelimbs Fig.2 BTX-A was injected at the 8 sites pointed by“ × ”within paraspinal muscle(5 mm apart)
1.2 模型分組
大鼠隨機分為3組,每組10只。BTX-A(蘭州生物制品研究所生產),白色干粉,每支100U,注射前臨時配制。腹腔注射麻醉下,于胸腰段后凸頂點向下切開皮膚1 cm,向上切開皮膚2 cm,分離筋膜,充分顯露右側椎旁肌,于大鼠胸椎后凸頂點上下各1 cm處多點注射(見圖2),A、B組雙足鼠胸椎右側肌肉多點注射 6.25 U/100 g的 BTX-A,0.5 mL;C組雙足鼠右側椎旁肌多點注射0.9%的生理鹽0.5 mL。注射完畢縫扎切口,普通籠喂養,3 d后轉入高籠喂養。B組雙足鼠于首次注射6周后追加注射6.25 U/100 g的BTX-A 1次A組及C組注射等量生理鹽水。注射完畢縫扎切口,普通籠喂養,3 d后轉入高籠喂養。
1.3 X 線檢查
首次BTX-A注射2周、4周、6周、8周、12周后分別行X線檢查。腹腔麻醉下將大鼠放置特制盒內,保持大鼠正中直立狀態,避免骨盆及雙肩傾斜,拍攝正側位X線片。
1.4 統計分析
相關數據輸入 SPSS 16.0軟件(SPSS Inc.,美國),計量資料用(±s)表示,采用一般線性模型實現重復測量資料的方差分析,用Multivariate實現組間兩兩比較,P<0.05表示差異有統計學意義。
2 結 果
2.1 雙足鼠模型
大鼠雙側上肢截除手術時間為(12.3±1.6)min。大鼠麻醉完全蘇醒后可雙足行走、站立。雙足鼠模型建立1周后體重為(97.8±6.6)g。
2.2 X線檢查結果
注射BTX-A 2周、4周、6周、8周、12周后分別行X線檢查,X線片提示雙足鼠出現脊柱側凸,且凸向注射側(見圖3),C組未發現明顯脊柱側凸,各組側凸Cobb角測量結果見表1。
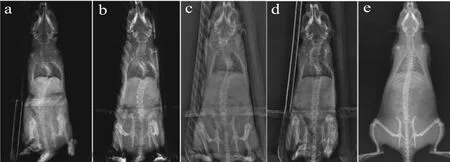
圖3 注射BTX-A后X線檢查結果(右側為注射側)Fig.3 X-ray results of spine curveafter injection of BTX-A(The right were injection sites)
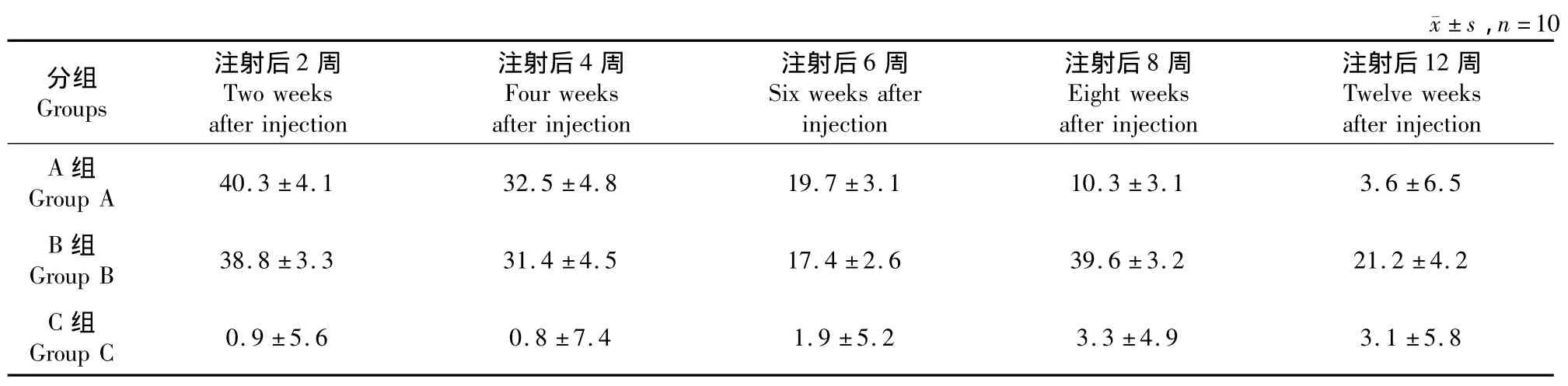
表1 雙足鼠脊柱側凸角度變化Tab.1 Mean Cobb’s angles at different times
重復測量數據滿足 Huynh-Feldt條件(P=0.556),接受“球形假設”。方差分析提示A、B組與C組測量結果差異有統計學意義(F=473.996,P<0.05),且不同時間的側凸角度差異有統計學意義(multivariate tests,F=51.968,P<0.05),組間與組內因素存在交互作用(F=38.453,P<0.05)。
各時間點兩兩比較用多元方差分析,P<0.05為差異有統計學意義。A、B組在注射后2周、4周、6周側凸角度差異無統計學意義(P>0.05);8周及12周時A組側凸角度與B組差異有統計學意義(P<0.05);A組12周后側凸角度與C組相比差異無統計學意義(P>0.05,見表2)。
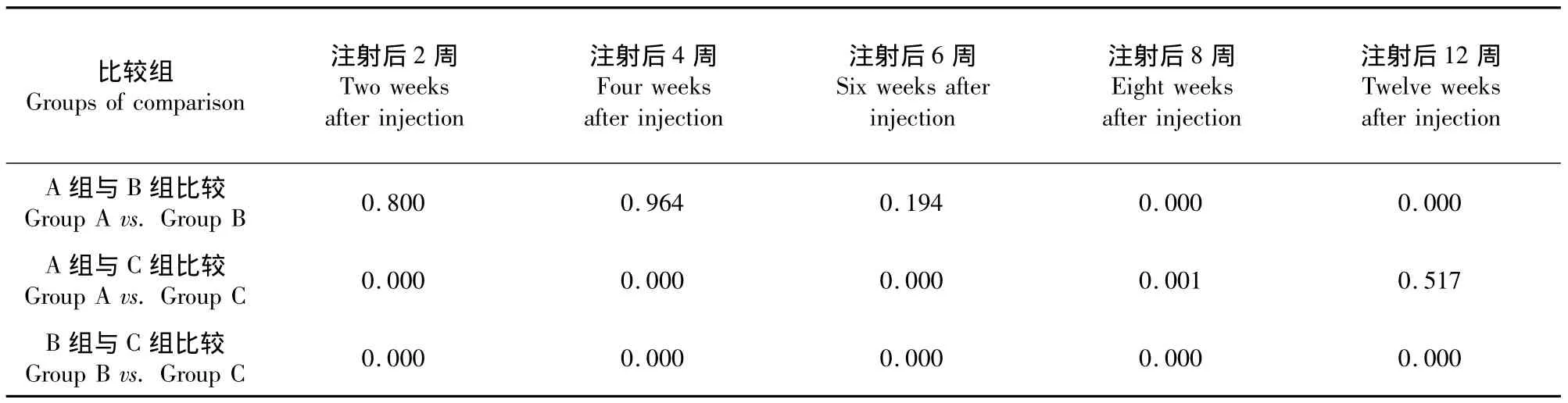
表2 各時間點X線檢查結果組間比較的P值Tab.2 Comparison(P value)of mean Cobb’s angles among groups
B組大鼠的側凸角度趨勢分析提示首次注射后隨時間的推移,側凸角度逐漸下降;追加注射,側凸角度可增大;隨后角度再次逐漸減小(見圖4)。
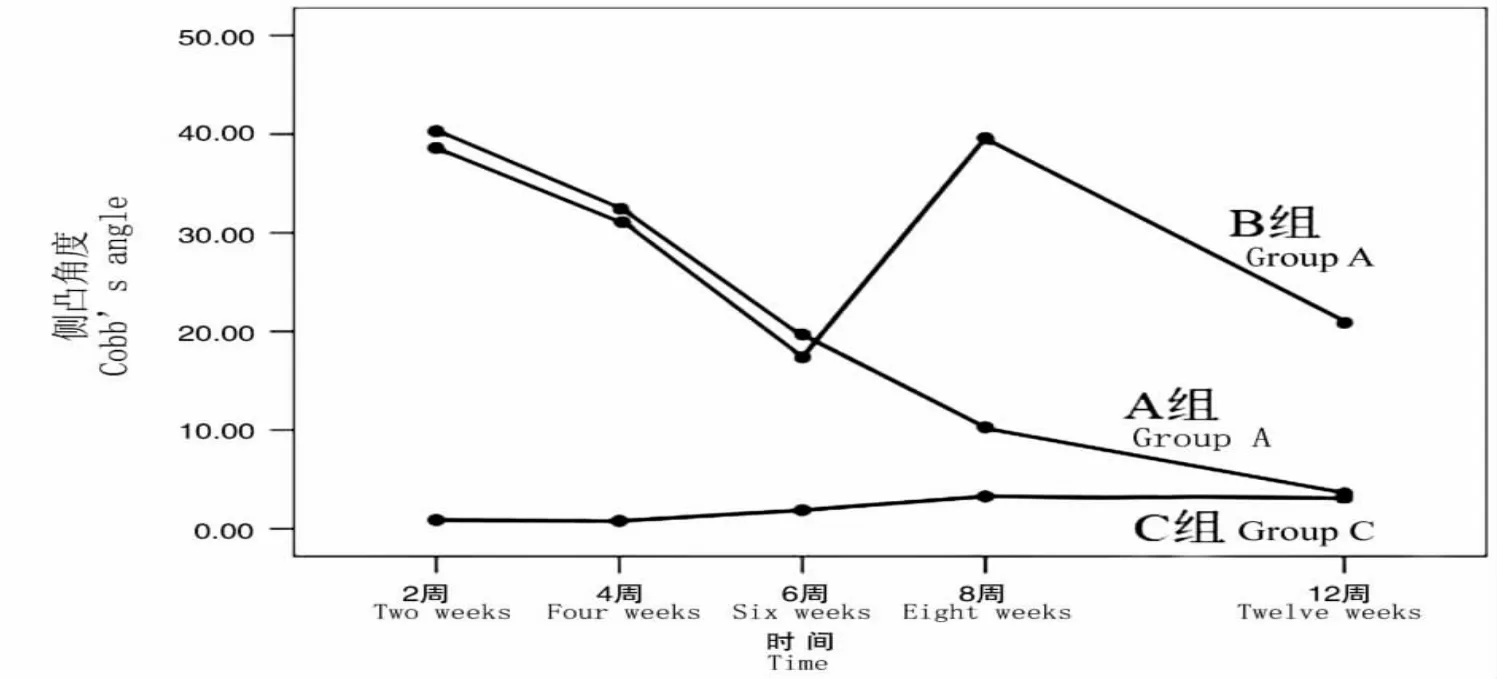
圖4 不同時間點各組大鼠側凸角度的趨勢分析Fig.4 Trend analysis of mean Cobb’s angles at different time points among groups
3 討 論
3.1 大鼠側凸模型的建立
大鼠脊柱側凸模型的研究一直是學者們關注的熱點。Sarwark等[3]報道利用絲線栓系大鼠肩胛骨下角及同側骨盆制造側凸模型,研究發現至少栓系6周才能出現結構性脊柱側凸。Joe[4]最先通過電刺激大鼠一側椎旁肌的方法建立脊柱側凸模型,研究發現凸側位于非刺激側,側凸角度隨著時間的累積而不斷加大,3周時側凸角度平均為18.6°,停止電刺激后側凸角度沒有明顯丟失。日本學者Machida等[5-6]通過截除雙上肢建立直立的雙足鼠模型,發現松果體切除(阻斷褪黑素分泌)的雙足鼠出現脊柱側凸,而松果體切除的四足鼠和保留松果體的雙足鼠并未發生脊柱側凸。這與Oyama等[7]的實驗結果類似,其認為褪黑素缺乏及直立姿勢是鼠類模型脊柱側凸發生、發展的重要條件。Smith等[8]報道通過栓系兔T4~10的一側椎板,制造出緩慢進展的結構性側凸動物模型。此后,通過栓系等純機械外力的造模方式不斷被研究者采用。Newton等[9]報道了經右側胸腔入路鋼絲栓系小牛的T6,7或T7,8椎體前外側,12周后發現小牛出現12°的胸椎側凸。Braun等[10-11]通過對山羊 T5~L1脊柱左后方栓系聯合左側肋骨捆綁及右側肋骨切除建立動物模型,由于此模型有椎體及椎間盤楔形變、椎體旋轉及側凸進展等表現,能很好的模擬特發性脊柱側凸的特點,此方法建模為今后研究特發性脊柱側凸提供了實驗基礎。國內不少學者通過栓系雙足鼠肋骨或肩胛骨與髂骨建立脊柱側凸模型[12-14]。
目前文獻報道的造模方法存在明顯不足,如模型動物與人類種屬差異太大、不能模擬人類直立姿勢、模型椎體無明顯旋轉、通過栓系等外力牽拉作用限制了脊柱的活動范圍、模型側凸范圍過大等[15]。
本研究組通過對雙足鼠一側椎旁肌注射BTX-A建立脊柱側凸模型,該模型具有以下優點:①雙足鼠模擬人類直立姿勢;②大鼠局部脊柱椎旁肌注射不累及整個脊柱;③大鼠脊柱活動性完好,脊柱各方向活動不受外力影響;④側凸伴有椎體旋轉;⑤相對于栓系等方法創傷更小。
3.2 BTX-A 特性
BTX-A通過阻斷膽堿能神經末端的鈣離子通道,進而阻止突觸前膜乙酰膽堿的釋放,阻斷神經沖動的傳遞,起到了化學去神經作用,最終造成肌肉無法收縮,出現局部肌肉麻痹無力[16]。目前已上市的醫用 BTX-A有 Botox(Allergan,美國)、Dysport(Ipsen、Medicis,法國、美國)及衡力(蘭州生物制品研究,中國)。Botox注射后一般2~5 d起效,2周左右注射區域出現軸突出芽現象,4周后可傳遞神經沖動,肌肉僅可發生短暫顫動,9周后軸突停止出芽,13周后神經肌肉接頭功能基本恢復,肌肉可正常收縮[2]。
本實驗組發現BTX-A椎旁肌注射2周時側凸最嚴重,隨后側凸角度逐漸減輕,至注射后12周側凸基本完全消失,側凸角度隨時間推移呈線性關系減小。追加注射BTX-A側凸可加重,提示BTX-A注射導致大鼠椎旁肌力量失衡進而導致的脊柱側凸是非結構性的,當BTX-A作用消失,雙足鼠兩側椎旁肌力量逐漸平衡,側凸將逐漸減小直至消失,追加注射BTX-A后椎旁肌力量再次失衡,脊柱側凸明顯加重。該實驗有力地證明了椎旁肌力量失衡可導致脊柱側凸的發生。
研究椎旁肌力量與脊柱側凸的關系,可能為脊柱側凸患者,特別是特發性脊柱側凸患者的病因學研究及治療提供參考。本實驗尚存在一些不足之處,如觀察時間間隔較大,未能明確BTX-A注射后側凸角度精確的變化趨勢;如反復追加注射BTX-A,大鼠側凸能否繼續維持,是否能轉變為結構性側凸。本實驗僅是課題研究的一部分,上述問題與注射BTX-A后椎旁肌的顯微結構變化、相關蛋白表達分析將在今后的實驗做進一步研究。
雙足鼠椎旁肌力量失衡可導致脊柱側凸的發生。一側椎旁肌注射BTX-A,雙足鼠可出現脊柱側凸,隨時間推移側凸逐漸減輕,追加注射BTX-A側凸可加重。
[1] Jankovic J.Botulinum toxin in clinical practice[J].J Neurol Neurosurg Psychiatry,2004,75(7):951-957.
[2] Dolly JO,Aoki KR.The structure and mode of action of different botulinum toxins[J].Eur J Neurol,2006,13(Suppl 4):1-9.
[3] Sarwark JF,Dabney KW,Salzman SK,et al.Experimental scoliosis in the rat.I.Methodology,anatomic features and neurologic characterization[J].Spine(Phila Pa 1976),1988,13(5):466-471.
[4] Joe T.Studies of experimental scoliosis produced by electrical stimulation.With special reference to the histochemical properties of the muscle[J].Nihon Ika Daigaku Zasshi,1990,57(5):416-426.
[5] Machida M,Murai I,Miyashita Y,et al.Pathogenesis of idiopathic scoliosis.Experimental study in rats[J].Spine(Phila Pa 1976),1999,24(19):1985-1989.
[6] Machida M,Saito M,Dubousset J,et al.Pathological mechanism of idiopathic scoliosis:experimental scoliosis in pinealectomized rats[J].Eur Spine J,2005,14(9):843-848.
[7] Oyama J,Murai I,Kanazawa K,et al.Bipedal ambulation induces experimental scoliosis in C57BL/6J mice with reduced plasma and pineal melatonin levels[J].J Pineal Res,2006,40(3):219-224.
[8] Smith RM,Dickson RA.Experimental structural scoliosis[J].J Bone Joint Surg Br,1987,69(4):576-581.
[9] Newton PO,Fricka KB,Lee SS,et al.Asymmetrical flexible tethering of spine growth in an immature bovine model[J].Spine(Phila Pa 1976),2002,27(7):689-693.
[10] Braun JT,Ogilvie JW,Akyuz E,et al.Experimental scoliosis in an immature goat model:a method that creates idiopathic-type deformity with minimal violation of the spinal elements along the curve[J].Spine(Phila Pa 1976),2003,28(19):2198-2203.
[11] Braun JT,Hines JL,Akyuz E,et al.Relative versus absolute modulation of growth in the fusionless treatment of experimental scoliosis[J].Spine(Phila Pa 1976),2006,31(16):1776-1782.
[12] 劉立峰,朱悅,韓秀鑫,等.雙足鼠對側拴系脊柱側凸模型的建立[J].中華骨科雜志,2010,30(10):985-990.
[13] Liu L,Zhu Y,Han X,et al.The creation of scoliosis by scapula-to-contralateral ilium tethering procedure in bipedal rats:a kyphoscoliosis model[J].Spine(Phila Pa 1976),2011,36(17):1340-1349.
[14] 王儲,郝東升,段圓慧,等.雙足鼠脊柱側凸模型手術方法改良[J].中華實驗外科雜志,2009,26(12):1732-1733.
[15] Janssen MM,de Wilde RF,Kouwenhoven JW,et al.Experimental animal models in scoliosis research:a review of the literature[J].Spine J,2011,11(4):347-358.
[16] Brin MF.Botulinum toxin:chemistry,pharmacology,toxicity,and immunology[J].Muscle Nerve Suppl,1997,6:S146-168.

