不同質量濃度氟對大鼠切牙成釉細胞轉化生長因子-β1表達的影響
張雪莉 張穎 席淑華 程廣巖 郭曉英
(1.中國醫科大學口腔醫學院 口腔預防教研室,沈陽110002;2.中國醫科大學公共衛生學院 地球化學性疾病研究室,沈陽110001)
牙胚發育是由牙源性上皮與顱神經嵴來源的外胚間充質之間相互誘導、相互作用的復雜過程。研究[1-2]表明:轉化生長因子-β1(transforming growth factor-β1,TGF-β1)在這一過程中起著重要作用。氟斑牙是牙齒在發育過程中,機體攝入過量的氟而造成的釉質發育和礦化異常,其病因雖已明確,也有一些治療措施[3],但發病機制尚不清楚。本實驗通過建立大鼠氟斑牙模型,觀察不同質量濃度的氟對大鼠切牙成釉細胞中TGF-β1表達的影響,為進一步探討氟斑牙形成的機制提供依據。
1 材料和方法
1.1 材料
1.1.1 實驗動物 4周齡Wistar大鼠40只(中國醫科大學實驗動物中心提供),體重60~70 g,雌雄各半。
1.1.2 主要試劑及設備 TGF-β1多克隆抗體、SABC免疫組織化學試劑盒及DAB顯色劑(武漢博士德生物工程有限公司);YG-180B1型冷凍包埋機、YG-280KX型攤片烤片機(南昌陽光神奇醫療器械有限公司),Leitz 1512型切片機(Leitz公司,德國)。
1.2 方法
1.2.1 大鼠氟斑牙動物模型的建立 將40只Wistar大鼠應用隨機數字表法隨機分為3組:對照組(14只)、低劑量氟組(13只)和高劑量氟組(13只)。對照組大鼠自由飲用蒸餾水,低劑量氟組自由飲用由蒸餾水配制的氟化鈉溶液(F-質量濃度60 mg·L-1),高劑量氟組自由飲用由蒸餾水配制的氟化鈉溶液(F-質量濃度120 mg·L-1)。飼養室溫度保持在22~25 ℃,各組均給予常規飼料飼養,自由飲食,喂養10周。
1.2.2 標本處理 喂養10周后,乙醚麻醉處死動物,完整剝離雙側下頜骨,修整組織,余留部分為下頜切牙及包繞在切牙周圍的部分頜骨。標本用0.01%的PBS溶液沖洗后,置入4%的多聚甲醛溶液中,4 ℃固定30 h;然后置于10%的乙二胺四乙酸二鈉溶液中脫鈣,4 ℃保存,每3 d更換1次脫鈣液。6周后,制作切片。梯度乙醇脫水,二甲苯透明,石蠟定向包埋,沿牙體縱向長軸做近遠中向連續切片,片厚6 μm,以多聚賴氨酸處理的載玻片撈片,65 ℃烤片3 h,標記備用。
1.2.3 蘇木精-伊紅(hematoxylin-eosin,HE)染色 常規HE染色,光鏡下觀察大鼠切牙發育中成釉細胞的形態。
1.2.4 免疫組織化學染色 采用常規免疫組織化學染色。室溫下石蠟切片脫蠟和水化后,蒸餾水洗3次,每次2 min。3%過氧化氫室溫孵育10 min,以消除內源性過氧化物酶的活性,蒸餾水沖洗3次,每次2 min。采用枸櫞酸緩沖液微波修復抗原,冷卻至室溫,PBS沖洗2次,每次3 min。滴加正常小牛血清封閉液,室溫孵育20 min,甩去多余液體。滴加一抗,4 ℃過夜。PBS沖洗3次,每次2 min,滴加生物素化二抗,37 ℃溫箱孵育25 min,PBS沖洗3次,每次2 min。滴加SABC試劑,37 ℃溫箱孵育25 min,PBS沖洗4次,每次5 min。DAB鏡下控制顯色,蒸餾水沖洗,蘇木精復染2 min,1%鹽酸乙醇分化,返藍,脫水、透明、中性樹膠封片。以PBS代替一抗工作液作為空白對照,陽性反應呈棕黃色顆粒。
1.3 統計學分析
采用MetaMorph顯微圖像分析系統對免疫組織化學染色結果進行圖像采集,將陽性表達的強度轉化為數字信號,對陽性區域的染色強度進行半定量分析。每張切片隨機選擇同一層細胞不重疊的5個視野進行TGF-β1陽性表達分析,通過染色強弱對比進行相對評價。檢測染色陽性細胞的平均光密度(optical density,OD)值。OD值越小,組織中TGF-β1含量越少;OD值越大,組織中含量越多。采用SPSS 12.0統計軟件進行統計分析,統計方法采用方差分析,檢驗水準為雙側α=0.05。
2 結果
2.1 一般狀態觀察
3組動物的一般狀態見圖1。

圖1 對照組與實驗組大鼠切牙的肉眼觀察Fig 1 Overview of control and experimental groups
由圖1可見:對照組大鼠切牙發育良好,牙面為棕黃色,表面光滑,半透明;低劑量氟組切牙的牙面有部分不透光區,牙面略顯粗糙,釉質表面有規則、細小的棕白色相間橫紋;高劑量氟組的牙面粗糙明顯,有白堊色改變,棕白相間條紋更加明顯。后兩組均呈現典型氟斑牙癥狀,未見明顯的實質性缺損。
2.2 HE染色結果
HE染色結果見圖2。對照組:成釉細胞排列均勻,形態正常,細胞核遠離基底膜,釉基質釉柱結構清晰可見。低劑量氟組:成釉細胞呈不規則排列,原有高柱狀結構變矮,少量細胞發生扭曲,成釉細胞之間可見有空泡性變。高劑量氟組:成釉細胞排列紊亂,呈灶性堆積,細胞排列成多層。

圖2 對照組和實驗組的組織學觀察 HE×400Fig 2 Histological observation of control and experimental groups HE×400
2.3 免疫組織化學染色結果
免疫組織化學染色結果見圖3:TGF-β1在星網狀層、中間層均為陽性表達,在分泌期和成熟期成釉細胞均為強陽性表達,在新形成的釉基質中呈陽性表達。TGF-β1在3組的表達強度見表1:TGF-β1在低劑量氟組和高劑量氟組成釉細胞中的表達強度均明顯低于對照組(P<0.01),但低劑量氟組和高劑量氟組之間的差異無統計學意義(P>0.05)。
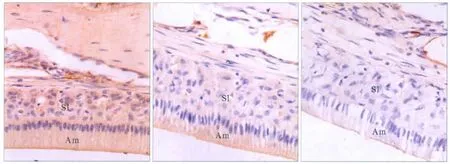
圖3 TGF-β1在大鼠切牙成釉細胞的表達 SABC×400Fig 3 The expression of TGF-β1 in incisor ameloblasts of rats SABC×400

表1 TGF-β1在大鼠切牙成釉細胞的表達強度Tab 1 The expression intensity of TGF-β1 in incisor ameloblasts of rats
3 討論
大鼠切牙為無根牙,可終身不斷地產生釉質,故可以在同一時間觀察到不同發育階段成釉細胞的形態,因此大鼠是研究牙齒發育的理想的動物模型。鼠類能耐受的氟的質量濃度約為人類的20倍以上。對大鼠來說,25~30 mg·L-1氟相當于人類適宜的飲水氟的質量濃度(1 mg·L-1),在此范圍內不出現氟斑牙;給予50~60 mg·L-1氟的大鼠飼養30 d多數會出現氟斑牙[4]。本文選用F-質量濃度60、120 mg·L-1的氟化鈉水溶液研究不同質量濃度氟對大鼠切牙成釉細胞的影響。
轉化生長因子-β(transforming growth factor-β,TGF-β)家族是一族具有多種生物學功能的細胞因子,在細胞的形態發生、增殖和分化,細胞外基質的形成,胚胎發育,骨的形成和重建等方面起著重要作用[5],同時也參與了牙胚的發生、發展和成熟的過程[6]。TGF-β家族成員通過與Ⅰ型和Ⅱ型絲氨酸/蘇氨酸激酶型受體結合而發揮作用。TGF-β與細胞膜表面的Ⅱ型絲氨酸/蘇氨酸激酶型受體結合,磷酸化并激活Ⅰ型受體,活化后的Ⅰ型受體作用于下游信號分子smad2、smad3使其活化,隨后smad2、smad3與smad4結合形成異源寡聚物由細胞質轉導進入細胞核內,與其他轉錄因子共同調節相關基因的表達[7]。
牙胚發育中,成釉細胞和成牙本質細胞的分化以及牙齒硬組織的形成是一個典型的由上皮—外胚間充質相互誘導、相互作用的過程。TGF-β家族成員作為信號分子,在這一過程中起重要作用。Bègue-Kirn等[8]研究發現:TGF-β1能促進牙胚成釉細胞合成細胞外基質,并誘導細胞分化。Coin等[9]將分離的成釉器在體外進行單獨培養,未觀察到前成釉細胞的極化和功能性成釉細胞的特性,加入TGF-β1后成釉細胞才發生了功能性分化。有研究[10]證實:在大鼠牙齒發育的鐘狀期,TGF-β與堿性磷酸酶、纖維結合素、Ⅰ型及Ⅱ型膠原等與基質形成有關的蛋白質的表達位置一致,提示TGF-β與基質合成有關。Zhu等[11]用原位雜交法分析TGF-β1 mRNA在鼠牙齒發育過程中的時空表達及定位,發現其表達呈時空依賴性,在蕾狀期、帽狀期牙齒上皮中局部有表達,在鐘狀期成釉細胞層和牙乳頭細胞中大量表達,隨著成牙本質細胞層和成釉細胞層細胞的分化,TGFβ1的表達增加;因此認為TGF-β1在牙生成過程中可能起重要作用,并且是通過旁分泌和自分泌方式起作用的。Fan等[12]也發現中間層細胞可以合成TGFβ1,可能是以旁分泌方式調控成釉細胞分化的開始。王大勇等[13]通過研究鼠氟斑牙動物模型發現:在鐘狀期,TGF-β1主要分布在中間層細胞、星網狀層細胞及成釉細胞層,牙乳頭及成牙本質細胞也有表達。由此推測,TGF-β1通過旁分泌和自分泌方式參與了成釉細胞的終末分化。張瑩等[14]從受體水平上亦證明了TGF-β參與了牙胚發育的過程。
本實驗觀察到:TGF-β1在大鼠切牙星網狀層細胞、中間層細胞均為陽性表達,表明TGF-β1在牙胚發育早期參與了牙齒早期形態的形成與細胞分化;在分泌期及成熟期成釉細胞均為強陽性表達,在新形成的釉基質中呈陽性表達,說明TGF-β1可能與成釉細胞及成牙本質細胞的分化及基質的形成有密切關系。這與蘇凌云等[15]觀察到的結果相一致。程敏等[16]研究顯示:TGF-β1在鐘狀早期,內釉細胞、釉結、中間層及牙板中呈強陽性表達,在外釉細胞呈陽性表達;在鐘狀期,前成釉細胞、成釉細胞、前牙本質細胞、成牙本質細胞中呈強陽性表達。Tsuchiya等[17]研究發現:在成熟期成釉器中,TGF-β1的表達明顯高于早期成釉器,TGF-β1表達增高使早期成釉器中相應的應激反應因子表達也增加,抑制凋亡的細胞因子表達減少,從而認為TGF-β1可能在釉質發育成熟期的成釉細胞凋亡過程中起著重要作用。
氟能抑制成釉細胞的分化、基質合成及分泌,但對其作用機制尚缺乏進一步研究。TGF-β1在誘導成釉細胞、成牙本質細胞的分化,以及細胞外基質合成等方面具有重要作用。那么,在氟斑牙的形成過程中,過量氟是否通過影響TGF-β1進而導致其形成呢? 王穎等[18]通過研究發現:低質量濃度(F-質量濃度20 mg·L-1)和中質量濃度(F-質量濃度50 mg·L-1)的氟顯著抑制TGF-β1的表達。王大勇等[13]發現:慢性氟中毒條件下,小鼠切牙成釉器中TGF-β1的表達受到抑制。本實驗通過免疫組織化學方法研究氟對大鼠切牙成釉細胞TGF-β1表達的影響,來探討氟斑牙的發生機制,結果發現:實驗組TGF-β1的表達明顯低于對照組。TGF-β1的表達減弱,說明給氟后TGFβ1的表達受抑制,提示氟可能通過抑制TGF-β1的表達而干擾了成釉細胞的分化和基質分泌,造成釉質發育障礙。
[1]Ruch JV,Lesot H,Bègue-Kirn C.Odontoblast differentiation[J].Int J Dev Biol,1995,39(1):51-68.
[2]Thesleff I,Vaahtokari A,Kettunen P,et al.Epithelial-mesenchymal signaling during tooth development[J].Connect Tissue Res,1995,32(1/2/3/4):9-15.
[3]陳暉,康媛媛,張英.Beyond冷光美白結合祛氟劑治療氟斑牙臨床療效觀察[J].中國實用口腔科雜志,2009,2(1):39-41.
Chen Hui,Kang Yuanyuan,Zhang Ying.The effect of Beyond cold light whitening combined with fluoride-removing material on bleaching dental fluorosis[J].Chin J Pract Stomatol,2009,2(1):39-41.
[4]鄧轉云,黃瑞哲,郭永利.誘導大鼠下切牙氟斑牙模型所需飲水氟濃度及時間的篩選[J].實驗動物科學,2008,25(4):12-15.
Deng Zhuanyun,Huang Ruizhe,Guo Yongli.Different doses of sodium fluoride in drinking water induced dental fluorosis oflower incisors in SD rats[J].Laboratory Animal Science,2008,25(4):12-15.
[5]孫玉鵬,胡蘊玉.β轉化生長因子研究進展[J].中華骨科雜志,1994,14(8):505-507.
Su Yupeng,Hu Yunyu.Progress of transforming growth factor β[J].Chin J Orthopaedics,1994,14(8):505-507.
[6]Martín A,Unda FJ,Bègue-Kirn C,et al.Effects of aFGF,bFGF,TGFbeta1 and IGF-Ⅰon odontoblast differentiation in vitro[J].Eur J Oral Sci,1998,106(Suppl 1):117-121.
[7]Shi Y,Massagué J.Mechanisms of TGF-beta signaling from cell membrane to the nucleus[J].Cell,2003,113(6):685-700.
[8]Bègue-Kirn C,Smith AJ,Ruch JV,et al.Effects of dentin proteins,transforming growth factor beta 1(TGF beta 1)and bone morphogenetic protein 2(BMP2)on the differentiation of odontoblast in vitro[J].Int J Dev Biol,1992,36(4):491-503.
[9]Coin R,Ha?kel Y,Ruch JV.Effects of apatite,transforming growth factor beta-1,bone morphogenetic protein-2 and interleukin-7 on ameloblast differentiation in vitro[J].Eur J Oral Sci,1999,107(6):487-495.
[10]Smith AJ,Matthews JB,Hall RC.Transforming growth factor-beta1(TGF-beta1)in dentine matrix.Ligand activation and receptor expression[J].Eur J Oral Sci,1998,106(Suppl 1):179-184.
[11]Zhu Q,Fan M,Bian Z,et al.In situ hybridization analysis of transforming growth factor-beta 1 RNA expression during mouse tooth development[J].Chin J Dent Res,2000,3(2):21-25.
[12]Fan MW,Bian Z,Gao YG.Immunohistochemistry and in situ hybridization investigation of transforming growth factor-beta:During odontoblast and ameloblast differentiation[J].Chin J Dent Res,1998,1(2):17-21.
[13]王大勇,侯鐵舟,王強,等.慢性氟中毒對小鼠切牙胚內釉上皮TGF-beta1表達的影響[J].陜西醫學雜志,2004,33(11):963-964,979.
Wang Dayong,Hou Tiezhou,Wang Qiang,et al.Influence of chronic fluorine poisoning on the expression of TGF-beta1 in inner enamel epithelium of mouse incisor[J].Shanxi Medical J,2004,33(11):963-964,979.
[14]張瑩,張郁,金巖.轉化生長因子β受體在牙胚發育過程中的表達和意義[J].牙體牙髓牙周病學雜志,1999,9(1):11-13.
Zhang Ying,Zhang Yu,Jin Yan.The expression and effect of TGF-β receptors in tooth development[J].Chin J Conserv Dent,1999,9(1):11-13.
[15]蘇凌云,吳補領,史俊南.TGF-β1、TGF-β2、TGF-β3蛋白在人牙胚表達的免疫組化研究[J].牙體牙髓牙周病學雜志,2000,10(6):307-309.
Su Lingyun,Wu Buling,Shi Junnan.Immunohistochemical study of TGF-β1,TGF-β2and TGF-β3protein expressions in human tooth germs[J].Chin J Conserv Dent,2000,10(6):307-309.
[16]程敏,苗雷英,劉玉艷,等.轉化生長因子β1和E-鈣黏附分子在人牙胚發育過程中的表達及意義[J].吉林大學學報:醫學版,2007,33(6):1054-1057.
Cheng Min,Miao Leiying,Liu Yuyan,et al.Expressions of TGFβ1 and E-cadherin in human tooth germ development and their significances[J].J Jilin University:Medicine Edition,2007,33(6):1054-1057.
[17]Tsuchiya M,Sharma R,Tye CE,et al.Transforming growth factorbeta1 expression is up-regulated in maturation-stage enamel organ and may induce ameloblast apoptosis[J].Eur J Oral Sci,2009,117(2):105-112.
[18]王穎,張安波,陳暉.氟對體外培養人牙胚TGF-β1表達影響的實驗研究[J].口腔醫學,2009,29(11):572-575.
Wang Ying,Zhang Anbo,Chen Hui.Experimental study of effects of fluoride on expression of TGF-β1 of human tooth germ cultured in vitro[J].Stomatology,2009,29(11):572-575.

