甲醛固定石蠟包埋子宮內膜癌變組織中microRNA-29b表達及其臨床意義
張海鳳,王黎明,孫雙雙,劉世國,孫顯璐
(青島大學醫學院附屬醫院,山東青島266003)
microRNA是一類非編碼小分子RNA,它在轉錄和翻譯水平調節基因表達,參與生命過程中一系列重要進程,包括早期胚胎發育,細胞增殖、分化、凋亡,脂肪代謝及基因表達調控等。近年研究表明,很多microRNA(如microRNA-29)在腫瘤的發生、分化和發展中起重要作用。已有研究證明,microRNA-29b在多種人類腫瘤如肺癌、肝細胞癌、前列腺癌中表達下調[1,2]。microRNA-29有3種亞基,分別為microRNA-29a、microRNA-29b、microRNA-29c。本研究采用甲醛固定石蠟包埋組織為材料、以SYBR green實時熒光定量PCR方法檢測microRNA-29b在子宮內膜癌變組織中的表達,并探討其臨床意義。
1 資料與方法
1.1 臨床資料 選擇2007年1月~2008年7月在青島大學醫學院附屬醫院婦產科行手術治療的96例患者的甲醛固定石蠟包埋處理組織,其中正常子宮內膜16例(增生期10例、分泌期6例)、不典型增生內膜20例、子宮內膜癌60例(子宮內膜樣腺癌50例、腺鱗癌4例、透明細胞癌2例、漿液性乳頭狀腺癌4例)。三種子宮內膜組織患者的年齡及中位年齡分別為(30~48歲、39歲,42~59歲、51歲,45~72歲、58歲),術前均未行放療、化療及內分泌治療,術后均經病理檢查確診。
1.2 方法
1.2.1 引物設計 依據Primer5.0軟件基于Gen Bank和microRNA BASE(http://microrna.sanger.ac.uk/sequences)數據庫中人的U6和 microRNA-29b的序列,設計其帶有莖環結構的特異性反轉錄引物和PCR擴增引物。microRNA-29b的特異性反轉錄引物為5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAACACTGATT-3';PCR擴增上游引物為5'-GCGCGCTAGCACCATTTG-3';下游引物為5'-CAGTGCAGGGTCCGAGGT-3'。內參U6的特異性反轉錄引物為 5'-AACGCTTCACGAATTTGCGT-3';PCR擴增上游引物為5'-CTCGCTTCGGCAGCACA-3',下 游 引 物 為 5'-AACGCTTCACGAATTTGCGT-3'。以上引物均由上海生工公司合成。
1.2.2 總RNA提取 取厚10 μm的切片4張,放入1.5 mL的無菌離心管中,加入1 mL二甲苯顛倒混勻,50℃ 3 min徹底干燥后,按照Trizol總RNA提取試劑盒說明提取總RNA。純化后的RNA分別用30 μL和60 μL的1‰ DEPC水溶解。分裝20 μL用于檢測RNA質量和反轉錄,其余置于-80℃保存備用。
1.2.3 RNA的純度及質量鑒定 紫外分光光度計檢測吸光度(OD值),A260/A280比值1.8~2.1為高純度RNA。采用1%瓊脂糖變性凝膠電泳檢測RNA的完整性。
1.2.4 microRNA-29b和內參U6的SYBR green實時熒光定量PCR檢測 以RNA為模板,分別以microRNA-29b和U6的莖環結構反轉錄引物行逆轉錄反應,反轉錄條件為70℃ 5 min,42℃ 50 min,95℃5 min,獲得組織的microRNA-29b和U6的cDNA。分別以microRNA-29b和U6的cDNA為模板,以microRNA-29b和U6的特異性PCR擴增引物行實時熒光定量PCR,反應參數為95℃ 3 min預變性,95℃15 s,60℃30 s,熒光檢測1次,共40個循環。記錄每個反應管中熒光信號到達設定域值時所經歷的循環數,即Ct值。反應結束后,根據熔解曲線分析產物特異性,每組設3個復孔。
1.2.5 子宮內膜組織中microRNA-29b表達檢測采用microRNA-29b SYBR green實時熒光定量PCR方法檢測96例子宮內膜組織中的microRNA-29b表達。以2-ΔΔCt法計算正常及病變子宮內膜組織中的microRNA-29b表達量,U6作為內參照,各組織均與正常內膜microRNA-29b表達的均值進行比較,其中ΔΔCt=(CtmicroRNA-29b-CtU6)各組織-(CtmicroRNA-29b-CtU6)正常內膜均值。
1.2.6 統計學方法 采用SPSS17.0統計軟件,microRNA-29b表達數據用s表示。microRNA-29b表達水平與病變子宮內膜和子宮內膜癌臨床病理特征的關系采用t檢驗或方差分析。P≤0.05為差異有統計學意義。
2 結果
2.1 三種子宮內膜組織中microRNA-29b、U6的Ct值及microRNA-29b表達 三種子宮內膜組織中U6的Ct值基本相近,而microRNA-29b的Ct值依次升高。兩兩比較,正常內膜與不典型增生內膜相比,P =0.248;正常內膜與子宮內膜癌相比,P=0.002;不典型增生內膜與子宮內膜癌相比,P=0.024。見表1。
表1 三種子宮內膜組織中microRNA-29b、U6的Ct值及microRNA-29b表達(s)

表1 三種子宮內膜組織中microRNA-29b、U6的Ct值及microRNA-29b表達(s)
注:與不典型增生內膜比較,aP<0.05;與正常內膜比較,bP<0.05
正常內膜16 22.155±1.011 21.373±0.961 1.013±0.160不典型增生內膜 20 22.576±0.789 21.697±0.762 0.949±0.163子宮內膜癌 60 23.118±0.889ab 22.004±0.684 0.825±0.222
2.2 microRNA-29b表達與子宮內膜癌臨床病理特征的關系 子宮內膜癌組織中microRNA-29b表達與病理分期有關,Ⅲ﹢Ⅳ期患者表達明顯低于I﹢Ⅱ期患者(P<0.05);在子宮內膜癌組織中microRNA-29b表達與有無淋巴結轉移有關,有轉移的患者表達明顯低于無轉移的患者(P<0.05);與組織學分級、肌層浸潤、是否絕經、雌激素受體表達、孕激素受體表達無明顯統計學意義(P均>0.05)。見表2。
3 討論
現已證明,在多種腫瘤的發生、發展過程中存在microRNA的異常表達或缺失,microRNA與某些癌基因、抑癌基因、凋亡相關基因相互作用,參與腫瘤的生成、發展及侵襲轉移[3]。microRNA也可扮演癌基因或抑癌基因的角色[4],參與腫瘤發展的某個階段,如結腸癌演變中microRNA-29在不典型增生到腺瘤這一階段起主要作用。microRNA在婦科腫瘤如上皮性卵巢癌中的表達研究雖然處于初級階段,但已證明其確實存在microRNA-29異常表達,且microRNA表達具有組織特異性;其為microRNA-29在婦科腫瘤(如子宮內膜癌)中異常表達研究的可行性提供了可能。
表2 microRNA-29b表達與子宮內膜癌臨床病理特征的關系(s)
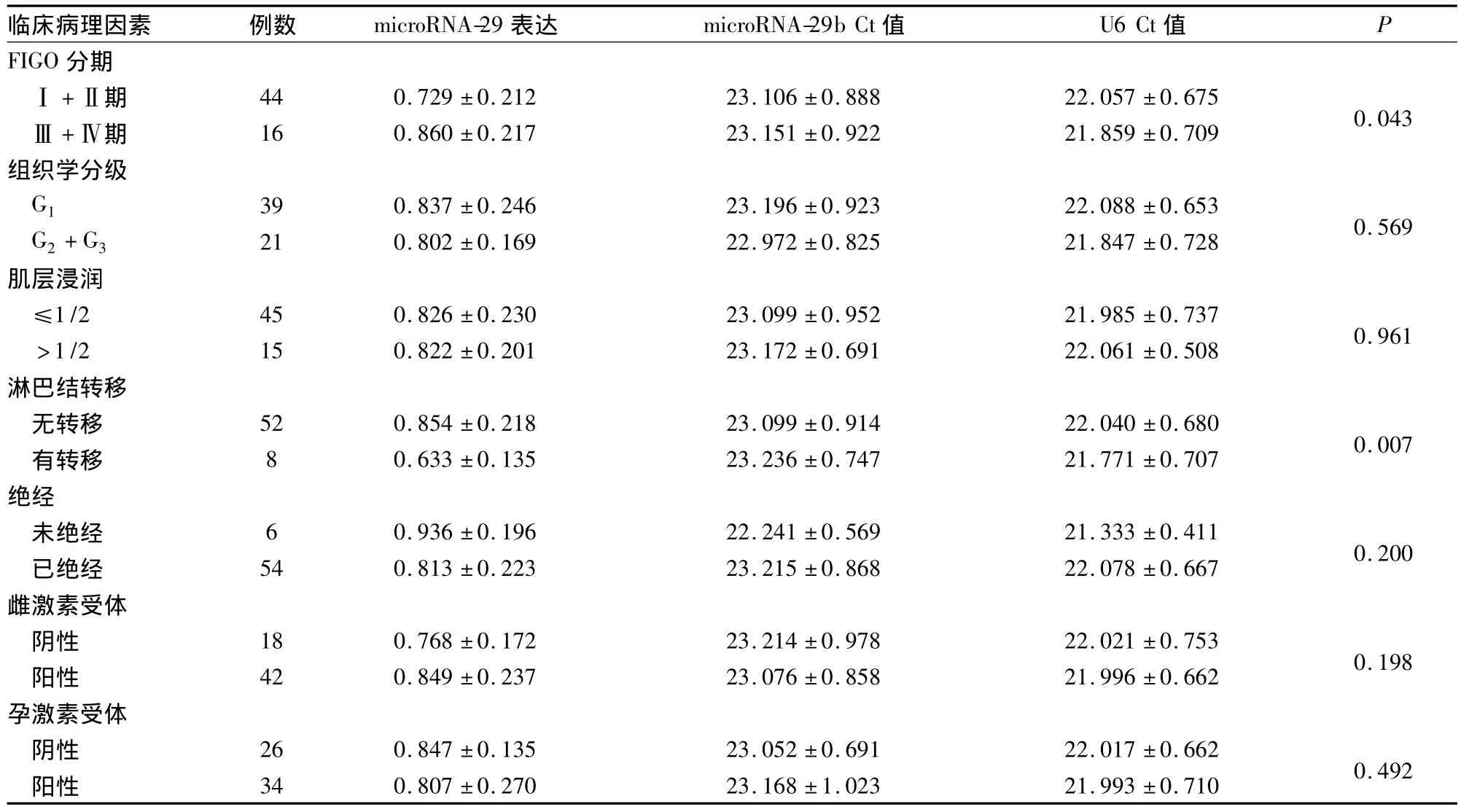
表2 microRNA-29b表達與子宮內膜癌臨床病理特征的關系(s)
臨床病理因素 例數 microRNA-29表達 microRNA-29b Ct值 U6 Ct值P FIGO 分期Ⅰ+Ⅱ期 44 0.729±0.212 23.106±0.888 22.057±0.675 0.043Ⅲ+Ⅳ期 16 0.860±0.217 23.151±0.922 21.859±0.709組織學分級G1 39 0.837±0.246 23.196±0.923 22.088±0.653 0.569 G2+G3 21 0.802±0.169 22.972±0.825 21.847±0.728肌層浸潤≤1/2 45 0.826±0.230 23.099±0.952 21.985±0.737 0.961>1/2 15 0.822±0.201 23.172±0.691 22.061±0.508淋巴結轉移無轉移 52 0.854±0.218 23.099±0.914 22.040±0.680 0.007有轉移 8 0.633±0.135 23.236±0.747 21.771±0.707絕經未絕經 6 0.936±0.196 22.241±0.569 21.333±0.411 0.200已絕經 54 0.813±0.223 23.215±0.868 22.078±0.667雌激素受體陰性 18 0.768±0.172 23.214±0.978 22.021±0.753 0.198陽性 42 0.849±0.237 23.076±0.858 21.996±0.662孕激素受體陰性 26 0.847±0.135 23.052±0.691 22.017±0.662 0.492陽性34 0.807±0.270 23.168±1.023 21.993±0.710
實時熒光定量PCR法已成為基因表達定量檢測[5]的強有力工具,特別在定量低豐度的microRNA研究領域有很大的優越性。利用其研究microRNA在新鮮冰凍組織中的表達已經取得較多成果,然而自2006年關于甲醛固定石蠟包埋組織中microRNA表達變化的研究[6]問世以來,類似的報道仍然很少。其原因可能為RNA在固定和包埋過程中會降解、斷裂成很多片段[7]或者發生嚴重的交聯,從而限制了對甲醛固定石蠟包埋組織的使用。由于microRNA分子小且非常穩定,在甲醛固定石蠟包埋組織中的交聯經過適當處理容易恢復,Jin等[8]通過組織蠟塊進行microRNA檢測大宗病例回顧性研究,認為甲醛固定石蠟包埋組織可用于針對microRNA的分析研究。基于其研究的可行性,本實驗以SYBR green實時熒光定量PCR方法檢測甲醛固定石蠟包埋組織中microRNA-29b的表達。
Iorio等[9]用SYBR green實時熒光定量PCR檢測出microRNA-29b在乳腺癌中表達下調。婦科腫瘤研究表明,子宮肌瘤眾多基因失調可造成microRNA異常表達,其中差異表達較顯著的為microRNA-29b。最近剛公布了一些卵巢癌中具有標記意義的microRNA表達譜[10];而Resnick等[11]還得出與已經公布的卵巢癌microRNA表達譜不一致的結果,即microRNA-29a呈過度表達。這些研究均表明,microRNA-29b在腫瘤組織中異常表達,其對腫瘤的發生、發展可能有一定影響。本實驗結果顯示,microRNA-29b在正常子宮內膜、不典型增生內膜及子宮內膜癌中的表達逐漸下調,且從正常內膜組織到癌組織的差異有統計學意義,說明microRNA-29b可能參與子宮內膜癌的發生過程,對子宮內膜癌的診斷可能具有一定價值,有望成為一個新的腫瘤標志物,但其可行性仍需要在血清學方面進一步研究。實驗還顯示,從不典型增生內膜到子宮內膜癌均出現microRNA-29b明顯低表達,進一步表明microRNA-29b可能參與子宮內膜癌形成的早期事件,可能成為子宮內膜癌的早期診斷指標。MicroRNA-29b表達與子宮內膜癌臨床病理特征的關系顯示,FIGOⅢ﹢Ⅳ期患者microRNA-29b表達明顯低于Ⅰ+Ⅱ期,有轉移淋巴結患者的microRNA-29b表達明顯低于無轉移者,說明隨著臨床病理分期升高,microRNA-29b表達下降;表明microRNA-29b在子宮內膜癌的發展過程中可能起重要的作用,其對子宮內膜癌患者的預后評估可能有一定的指導意義。當然,這種預后評估價值仍需大量相關方面的研究及長期的臨床觀察證實。
總之,本實驗證實microRNA-29b在子宮內膜癌變過程中表達下調,其表達差異可能與子宮內膜癌的發生、發展有關,但microRNA-29b在癌變發生、發展過程中的作用及其作用機制仍待于進一步研究。
[1]Yanaihara N,Caplen N,Bowman E,et al.MicroRNA molecular profiles in lung cancer diagnosis and prognosis[J].Cancer Cell,2006,9(3):189-198.
[2]Porkka KP,Pfeiffer MJ,Waltering KK,et al.MicroRNA expression profiling in prostate cancer[J].Cancer Res,2007,67(13):6130-6135.
[3]Bartel-DP.Micro-RNAs-genomics-biogenesis-mechanism,and-function[J].Cell,2004,116(2):281-297.
[4]Walker NJ.Real-time and quantitative PCR:applications to mechanism-based toxicology[J].J Biochem Mol Toxicol,2001,15(3): 121-127.
[5]Pfaffl MW,Horgon GW,Dempfle L,et al.Relative expression software tool(REST)for group-wise comparison and statistical analysis of relative expression results in real-time PCR[J].Nucleic Acids Res,2002,30(9):36.
[6]Nelson PT,Baldwin DA,Kloosterman WP,et al.RAKE and LNALSH reveal microRNA expression and localization in archival human brain[J].RNA,2006,12(2):187-191.
[7]Cronin M,Dutta D.Measurement of gene expression in archival paraffin-embedded tissues[J].America Journal of Pathology,2004,164(5):35-42.
[8]Jin J,Majerns J.Detection of fasion gene transcrips in fresh-frozen and formalin-fixed paraffin-embedded tissuesections of soft-tissue sarcomas after laser capture microdissection and RT-PCR[J].Diagn Mol Pathlo,2003,14(4):224.
[9]Iorio MV,Ferracin M,Liu CG,et al.MicroRNA gene expression deregulation in human breast cancer[J].Cancer Res,2005,65 (16):7065-7070.
[10]Zhang L,Volinia S,Bonome T,et al.Genomic and epigenetic alterations deregulate microRNA expression in human epithelial ovartan cancer[J].Proc Natl Acad Sci U S A,2008,105(19): 7004-7009.
[11]Resnick KE,Alder H,Hagan JP,et al.The detection of differentially expressed microRNAs from the serum of ovarian cancer patients using a novel real-time PCR platform[J].Gynecol Oncol,2009,112(1):55-59.