α-硫辛酸對糖尿病大鼠下丘腦組織氧化應激及TRX-1、TXNIP的影響
張樹杰,班 博,李艷英,耿厚法
(1天津醫科大學研究生院,天津300070;2濟寧醫學院附屬醫院)
2型糖尿病(T2DM)以葡萄糖和脂類代謝異常為主要特征,氧化應激在DM及其并發癥中發揮重要作用。硫氧化還原蛋白(TRX)系統是分布廣泛的小分子多功能蛋白,作為體內重要的還原系統有多種功能。硫氧還蛋白結合蛋白-2又稱硫氧還蛋白相互作用蛋白(TXNIP),是氧化應激的介導因子,它可與TRX結合并抑制TRX活性[1]。2010年,我們觀察了α-硫辛酸(LA)對DM大鼠下丘腦組織氧化應激及TRX-1、TXNIP影響。現報告如下。
1 材料與方法
1.1 材料 健康雄性Wistar大鼠30只,體質量180~200 g(山東省新華魯抗動物實驗中心)。722型分光光度計(上海分析儀器廠),DYY-8C型凝膠電泳儀(北京六一儀器廠);鏈脲佐菌素(STZ,美國Sigma公司),LA(德國 STADA公司),丙二醛(MDA)及總抗氧化能力(T-AOC)試劑盒(南京建成生物研究所)。
1.2 方法
1.2.1 動物分組及建模 將大鼠用普通飼料喂養1周后,隨機分為正常對照組10只、實驗組20只。對照組用普通飼料喂養,實驗組用高脂飼料(在60%的基礎飼料中加5%蛋黃粉、20%蔗糖、15%豬油混合)喂養。實驗組飼養4周后,禁食12 h,將STZ溶于0.1 mol/L枸櫞酸—枸櫞酸鈉緩沖液(pH 4.2)中,配成濃度1%的溶液,一次腹腔注射30 mg/ kg。72 h后取尾靜脈血檢測血糖,血糖 >16.7 mmol/L為DM建模成功。實驗組20只均建模成功,繼續高脂飲食4周后,隨機分為LA組、DM對照組(DC組)各10只;LA組給予LA 120 mg/(kg· d)、干預4周,DC組給予生理鹽水2 ml/d。實驗期間,大鼠自由攝食、飲水,每周測血糖、體質量一次。對照組用等量枸櫞酸—枸櫞酸鈉緩沖液腹腔注射。
1.2.2 MDA、T-AOC檢測 LA干預4周后,各組均禁食12 h,用戊巴比妥鈉腹腔麻醉后,取下丘腦,將整個下丘腦取出置液氮凍存,再轉入-80℃冰箱凍存。采用RT-PCR法、南京建成生物研究所提供的試劑盒檢測MDA、T-AOC。
1.2.3 TRX、TXNIP mRNA檢測 根據Trizol說明書,從各組下丘腦組織中提取總RNA,用核酸蛋白測定儀測定RNA濃度。在25 μL反應體系中,將1.5 μg的RNA逆轉錄得到cDNA。在20 μL體積的cDNA反應體系中,取1 μL用于擴增。用GADPH作內部參考對照,TRX-1、TXNIP及GADPH基因引物序列及PCR條件見表1。反應條件:94℃5 min,94℃30 s,60℃ 30 s,72℃ 30 s,72℃7 min。PCR產物經2%瓊脂糖凝膠電泳后,與DNA標準分子量進行比較,用Biometra凝膠成像系統進行成像和圖像分析,TRX、TXNIP mRNA表達用目的基因條帶與GAPDH條帶灰度值之比表示。
1.2.4 統計學方法 采用SPSS13.0統計軟件,數據以s表示,兩組間比較用獨立樣本t檢驗,多組間比較用單因素方差分析。P≤0.05為差異有統計學意義。

表1 TRX-1、TXNIP及GADPH基因引物序列及PCR反應條件
2 結果
2.1 各組下丘腦組織TRX-1、TXNIP mRNA表達比較 見表2。
2.2 各組下丘腦組織MDA、T-AOC比較 見表3。
3 討論
近年研究證實[2],氧化應激在DM及其慢性并發癥的發生、發展中起重要作用。DM時通過多種途徑導致氧自由基生成增多,從而影響組織細胞的代謝和功能,促進胰島素抵抗發生,導致組織細胞結構和功能損傷。Brownlee[2]認為,DM慢性并發癥如DM大血管病變(心血管、腦血管及下肢血管)、微血管病變(腎臟、神經及視網膜)都有一個共同的發病機制,即氧化應激。
表2 各組下丘腦組織TRX-1、TXNIP mRNA表達比較(相對灰度值,s)
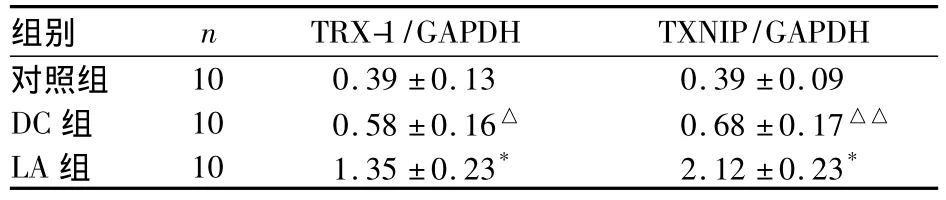
表2 各組下丘腦組織TRX-1、TXNIP mRNA表達比較(相對灰度值,s)
注:與對照組比較,△P<0.05,△△P<0.01;與DC組比較,*P<0.01
組別 n TRX-1/GAPDH TXNIP/GAPDH對照組10 0.39±0.13 0.39±0.09 DC組 10 0.58±0.16△ 0.68±0.17△△LA組 10 1.35±0.23* 2.12±0.23*
表3 各組下丘腦組織MDA、T-AOC比較(s)
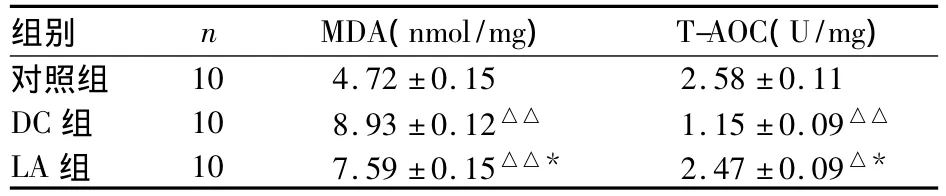
表3 各組下丘腦組織MDA、T-AOC比較(s)
注:與對照組比較,△P<0.05,△△P<0.01;與DC組比較,*P<0.01
組別 n MDA(nmol/mg) T-AOC(U/mg)對照組10 4.72±0.15 2.58±0.11 DC組 10 8.93±0.12△△ 1.15±0.09△△LA組 10 7.59±0.15△△* 2.47±0.09△*
LA是線粒體脫氫酶的重要輔助因子,其可清除氧自由基和活性氧,發揮抗氧化作用,被稱為“萬能抗氧化劑”。動物及臨床研究證實,LA可改善DM氧化應激狀態,對DM慢性并發癥有確切療效。另外,LA也是重要的巰基化合物調節劑,現已證明,其可增加多種組織(包括大腦組織)中的谷胱甘肽和其他內源性抗氧化劑水平[3]。本研究顯示,DM狀態下,大鼠下丘腦組織MDA升高,T-AOC降低;提示DM大鼠的抗氧化能力明顯下降,氧化應激水平明顯升高,與Brownlee[2]研究結果一致。本研究還顯示,LA組下丘腦組織MDA明顯下降,T-AOC明顯升高;提示LA能明顯增強DM大鼠的抗氧化能力,改善其氧化應激能力。
TRX系統是機體重要的抗氧化防御系統,TRX-1是該系統的重要組成部分,是維持細胞內抗氧化防御蛋白還原狀態的重要巰基還原酶,發揮多數巰基還原酶的抗氧化作用[4]。在DM所致的氧化應激增加狀態下,TRX可還原并維持許多蛋白的作用,其抗氧化作用表現在兩個方面[5]:①直接或作為某些過氧化物酶的電子供體清除氧自由基。②作為細胞內巰基還原酶,還原多種蛋白質的二硫鍵,使其恢復生理功能。TXNIP是TRX功能和表達的負性調節因子,通過結合TRX抑制其功能,發揮介導氧化應激的作用[1]。TXNIP是TRX-1的內源性抑制因子,可誘導氧化應激,改變細胞內氧化還原狀態,與DM發生相關[6]。TXNIP與糖代謝和DM發生有密切關系,它可調節糖脂代謝途徑中一些代謝轉錄程序的操縱基因,如PGC-1α、Foxo1、MondoA:Mix復合體[7],與這些轉錄因子相互作用而調節葡萄糖代謝。研究表明,TXNIP高表達可致胰島β細胞丟失、血糖升高;抑制TXNIP可減少糖毒性引起的胰島β細胞丟失和死亡,延緩DM發生[8]。Lappalainen等[9]研究顯示,DM大鼠下丘腦組織TRX、TXNIP基因轉錄水平明顯升高,但其蛋白水平無明顯變化。本研究發現,DM大鼠用LA干預4周后,其下丘腦組織TRX、TXNIP mRNA表達明顯升高,與文獻報道[9]結果一致。TRX系統是機體抗氧化防御系統的主要部分,是維持細胞內氧化還原穩態的第一線還原系統。因此我們推測,LA改善DM大鼠下丘腦組織氧化應激的作用至少部分是通過誘導DM機體TXNIP轉錄在細胞內平衡中發揮一定的負性作用實現的。
總之,本研究顯示LA可改善DM狀態下的下丘腦氧化應激狀態,其部分機制可能是通過誘導DM機體TXNIP轉錄在細胞內平衡中發揮一定的負性作用實現的。然而,大劑量LA可誘導DM機體TXNIP轉錄,破壞TRX系統平衡,在細胞氧化還原中發揮一定的負性作用。因此,尋找合適的LA治療劑量是下一步研究的重點。
[1]Nishiyama A,Matsui M,Iwata S,et al.Identification of thioredoxin-binding protein-2/vitamin D(3)up-regulated protein 1 as a negative regulator of thioredoxin function and expression[J].J Biol Chem,1999,274(31):21645-21650.
[2]Brownlee M.The pathobiology of diabetic complicationgs:a unifying mechanism[J].Diabetes,2005,54(6):1615-1625.
[3]Bilska A,Dubiel M,Sokolowska-Jezewicz M,et al.Alpha-lipoic acid differently affects the reserpine-induced oxidative stress in the striatum and prefrontal cortex of rat brain[J].Neuroscience,2007,146(4):1758-1771.
[4]Lillig CH,Holmgren A.Thioredoxin and related molecules-from biology to health and disease[J].Antioxid Redox Signal,2007,9 (1):25-47.
[5]Koháryová M,Kolárová M.Oxidative stress and thioredoxin system[J].Gen Physiol Biophys,2008,27(2):71-84.
[6]Masson E,Koren S,Razik F,et al.High beta-cell mass prevents streptozotocin-induced diabetes in thioredoxin-interacting protein-deficient mice[J].Am J Physiol Endocrinol Metab,2009,296(6): 1251-1261.
[7]Kaadige MR,Looper RE,Kamalanaadhan S,et al.Glutamine-dependent anapleurosis dictates glucose uptake and cell growth by regulating MondoA transcriptional activity[J].Proc Natl Acad Sci USA,2009,106(35):14878-14883.
[8]Chen J,Saxena G,Munqrue IN,et al.Thioredoxin-interacting protein:a critical link between glucose toxicity and beta-cell apoptosis[J].Diabetes,2008,57(4):938-944.
[9]Lappalainen Z,Lappalainen J,Laaksonen DE,et al.Acute exercise and thioredoxin-1 in rat brain,and alpha-lipoic acid and thioredoxin-interacting protein response,in diabetes[J].Int J Sport Nutr Exerc Metab,2010,20(3):206-215.