人乳頭狀瘤病毒16型E6E7基因與MCA、TPA協同誘導細胞惡性轉化的實驗研究
武 雙,李勁濤,鐘儒剛,曾 毅
(北京工業大學生命科學與生物工程學院,北京100124)
人乳頭狀瘤病毒(HPV)是一種DNA腫瘤病毒,能引起皮膚和黏膜鱗狀上皮增殖。高危型HPV感染,特別是HPV16型感染與宮頸癌、口腔癌等多種惡性腫瘤的發生和發展密切相關[1]。HPV16 E6和E7蛋白是導致HPV16相關宮頸癌產生的主要因素之一[2],它們通過破壞細胞正常的增殖、分化及凋亡,誘導細胞永生化及惡性轉化。流行病學、分子生物學及臨床醫學的許多研究均證實,單純HPV感染不足以導致宮頸癌,一些環境因子,如電離輻射、香煙、飲食、藥物以及其他病原微生物等,在腫瘤的形成過程中發揮重要的作用[3]。因此,高危型HPV16與化學物質間的協同致癌作用對腫瘤病因學研究與腫瘤防治具有重要作用。2011年4月~2012年1月,本研究構建了含HPV16 E6、E7基因的重組質粒載體pcDNA E6E7,將其轉染Balb/c 3T3細胞,應用細胞轉化實驗、軟瓊脂克隆形成實驗及SCID小鼠致瘤實驗,對HPV16 E6E7基因與化學致癌物MCA和TPA間的協同致癌作用進行了探討。現報告如下。
1 材料與方法
1.1 材料 Balb/c 3T3細胞、含HPV16全基因組序列的質粒均由中國疾病預防控制中心病毒病預防控制所腫瘤室提供;pcDNA3.1(+)質粒、限制性內切酶等購自TaKaRa公司;質粒提取試劑盒與凝膠回收試劑盒購自Qiagen公司;TRIzol Reagent購自Invitrogen公司;FuGENE HD轉染試劑購自 Roche公司;DMEM、DMEM/F12(1∶1)、胎牛血清(FBS)購自Hyclone公司;MCA、TPA、DMSO購自Sigma公司;SCID小鼠購自中國協和醫科大學實驗動物所。
1.2 方法
1.2.1 含HPV16 E6、E7基因的pcDNA E6E7重組質粒構建 根據HPV16全基因組序列,用Oligo 7引物分析軟件輔助設計,分別在E6上游與E7下游增加酶切位點,引物由北京擎科新業生物技術有限公司合成,引物序列:F:5'-CGGGATCCGCCACCATGCACCAAAAGAGAACTG-3',R:5'-CCGGAATTCTTATGGTTTCTGAGAACAGATG-3'。使用引物F(包含BamHⅠ酶切位點和Kozak序列)和R(包含EcoRⅠ酶切位點)擴增HPV16 E6E7基因。擴增產物純化后與pMD19-T載體連接,經測序鑒定后進行雙酶切,回收酶切產物;再與質粒載體pcDNA 3.1(+)相連構建重組質粒pcDNA E6E7,進行測序鑒定。
1.2.2 細胞培養及重組質粒轉染 Balb/c 3T3細胞培養于含10%FBS的DMEM培養基中,在37℃、5% CO2飽和濕度培養箱中培養。使用FuGENE HD轉染試劑,分別將pcDNA3.1(+)與重組質粒pcDNA E6E7轉染Balb/c 3T3細胞,待細胞達亞匯合狀態時,進行HPV16 E6E7基因檢測和細胞轉化實驗。
1.2.3 采用RT-PCR技術檢測HPV16 E6E7基因表達 收集細胞,提取RNA,經逆轉錄后,以cDNA為模板擴增HPV16 E6E7片段。收集細胞,提取細胞蛋白,采用Western blot技術檢測HPV16 E6E7蛋白表達。
1.2.4 細胞轉化實驗 取對數生長期的正常細胞和轉染細胞,以1×104個/瓶接種后培養24 h,加入0.2 μg/mL MCA,于第 4天換成含 2%FBS的DMEM/F12(1∶1)培養基培養,每周換液2次,于第7、10、14天加入0.1 μg/mL TPA,共培養4周左右,細胞經甲醇固定、Giemsa染色,計數轉化灶。實驗分為對照組、MCA組、TPA組和MCA+TPA組,每組設立6個平行實驗。
1.2.5 軟瓊脂克隆實驗 取1.2%瓊脂糖溶液與等體積雙倍DMEM培養液制備底層膠,室溫凝固。將Hela細胞、正常細胞與轉化細胞制成單細胞懸液,分別取1×103個加入0.7%的瓊脂糖溶液與等體積雙倍DMEM培養液,混勻,鋪在底層膠上,置于37℃、5%CO2孵箱中培養2周左右,在顯微鏡下觀察細胞集落形成情況。
1.2.6 SCID小鼠致瘤實驗 分別將正常細胞、轉染HPV16 E6E7基因的轉化細胞和未轉染組的轉化細胞制成單細胞懸液,接種1×107個細胞于SCID雄性5周齡小鼠前肢皮下,每組3只,定期觀察小鼠腫瘤生長情況。
1.2.7 統計學方法 采用SPSS13.0統計軟件,數據以s表示,組間比較采用配對t檢驗。P≤0.01為差異有統計學意義。
2 結果
2.1 重組質粒pcDNA E6E7的構建及酶切鑒定結果 pcDNA E6E7重組質粒經BamHⅠ與EcoRⅠ雙酶切后,可得到770 bp左右的目的條帶,與預期結果相同。經序列比對后發現E6E7基因完整、讀框正確,說明重組質粒pcDNA E6E7構建成功。
2.2 HPV16 E6E7基因、蛋白表達 RT-PCR檢測顯示,轉染組可得到大小為770 bp左右的擴增產物,見圖1。說明HPV16 E6E7基因在Balb/c 3T3細胞中表達。Western blot檢測顯示,轉染組可見11、19 kD的目的條帶,見圖2。說明HPV16 E6和E7蛋白可在Balb/c 3T3細胞中表達。
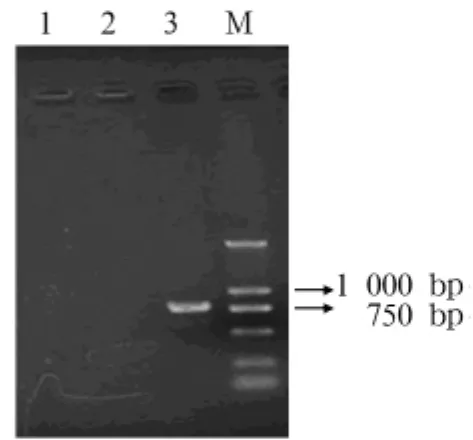
圖1 HPV16 E6E7基因表達

圖2 HPV16 E6E7蛋白表達
2.3 細胞轉化實驗結果 轉染組細胞在3周內形成清晰的轉化灶,可明顯縮短實驗時間。轉化細胞表現為嗜堿深染、致密多層、喪失接觸抑制、排列紊亂、轉化灶邊緣細胞自由定向生長、向周圍單層細胞侵襲生長等惡性特征。各組細胞在MCA和TPA誘導下形成的轉化灶數見表1。
表1 各組細胞在MCA和TPA誘導下形成的轉化灶數(s)
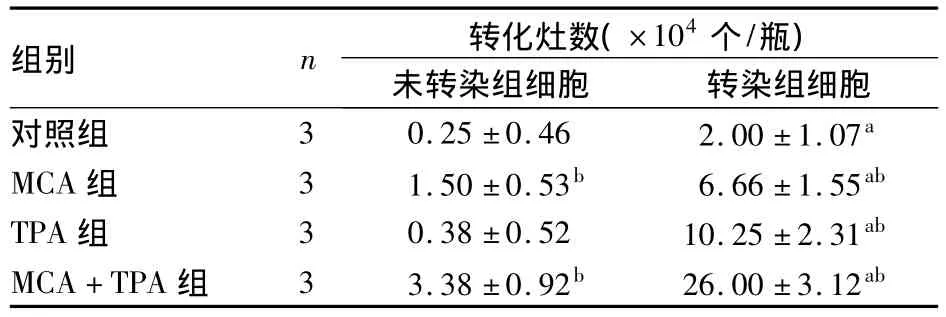
表1 各組細胞在MCA和TPA誘導下形成的轉化灶數(s)
注:與未轉染組細胞比較,aP<0.01;與對照組比較,bP<0.01
組別 n 轉化灶數(×104個/瓶)未轉染組細胞 轉染組細胞對照組 3 0.25±0.46 2.00±1.07a MCA組 3 1.50±0.53b 6.66±1.55ab TPA組 3 0.38±0.52 10.25±2.31ab MCA+TPA組 3 3.38±0.92b 26.00±3.12ab
2.4 軟瓊脂克隆實驗結果 正常Balb/c 3T3細胞不能形成克隆,陽性對照Hela細胞、轉染組的轉化細胞與未轉染組的轉化細胞均能形成克隆。以形成克隆個數多少、生長快慢和直徑大小排序,其順序為Hela細胞、轉染組的轉化細胞、未轉染組的轉化細胞,其克隆形成率分別為58.2%、22.8%和7.3%。
2.5 SCID小鼠致瘤實驗結果 正常Balb/c 3T3細胞未能在小鼠體內形成腫瘤;接種兩種轉化細胞的小鼠最終均形成腫瘤,成瘤率為100%。4周時,轉染組與未轉染組接種轉化細胞的小鼠腫瘤直徑分別為(1.8±0.4)、(1.3±0.3)cm。
3 討論
癌癥的發生是一個多階段、多步驟的過程,是多種因素長期共同作用的結果。人類癌癥產生的主要原因有物理、化學和生物因素。WHO曾指出80%以上的人類癌癥與化學因素有關。化學致癌物可與細胞內的大分子和DNA形成加合物或對其進行修飾,引發DNA結構改變(如DNA鏈交聯、鏈斷裂)和染色體畸變(染色體重排、缺失和數目變化)等,這是腫瘤發生的前提條件和首要因素。Balb/c 3T3細胞轉化實驗具有較高的一致性、敏感性和特異性,被國際癌癥研究所認定為一種有效評價化學物致癌性及促癌性的方法[4]。MCA、TPA均為化學致癌物,本研究顯示,在MCA與TPA的誘導下,轉染HPV16 E6E7基因的Balb/c 3T3細胞與未轉染的Balb/c 3T3細胞均可發生形態轉變,形成清晰的轉化灶。轉染組細胞形成轉化灶的個數可增加4~25倍,且實驗時間明顯縮短,其轉化細胞在軟瓊脂上形成集落的能力及對SCID小鼠的致瘤能力更強。上述結果表明,腫瘤的形成是一個多因素、多階段、多步驟的過程,HPV16 E6E7基因對誘導細胞惡性轉化非常重要,尤其是經化學致癌物的進一步誘導,可加速細胞的癌變進程,最終導致腫瘤形成。
總之,本研究顯示,HPV16 E6和E7蛋白可能是導致細胞惡性轉化及相關腫瘤發生的主要原因之一。HPV16 E6E7基因與化學致癌物MCA和TPA之間具有協同致癌作用。E6蛋白通過結合和降解p53蛋白,破壞正常的細胞周期調控;E7蛋白則通過與過磷酸化的 pRb結合使 pRb喪失抑癌活性[2,5]。本研究為HPV、環境化學因素與腫瘤病因學的關系提供了證據,對環境化學物、病毒等危險因子評估和腫瘤預防具有一定意義。
[1]Maucort-Boulch D,Franceschi S,Plummer M.International correlation between human papillomavirus prevalence and cervical cancer incidence[J].Cancer Epidemiol Biomarkers Prev,2008,17(3): 717-720.
[2]zur Hausen H.Papillomaviruses in the causation of human cancers-a brief historical account[J].Virology,2009,384(2):260-265.
[3]Madkan VK,Cook-Norris RH,Steadman MC,et al.Theoncogenic potential of human papillomaviruses:a review onthe role of host genetics and environmental cofactors[J].Br J Dermatol,2007,157 (2):228-241.
[4]IARC/NCI/EPA Working Group.Cellular and molecular mechanisms of cell transformation and standardization of transformation assays of established cell lines for the prediction of carcinogenic chemicals:overview and recommended protocol[J].Cancer Res,1985,45(5):2395-2399.
[5]Hebner CM,Laimins LA.Human papillomaviruses:basic mechanisms of pathogenesis and oncogenicity[J].Rev Med Virol,2006,16(2):83-97.