惡性淋巴瘤的生物治療策略
劉 彬, 張秀華, 平 濤, 曹榮月
(中國藥科大學生物化學教研室,江蘇南京210009)
惡性淋巴瘤原發于淋巴結或結外淋巴組織,是多種淋巴造血系統惡性腫瘤的總稱,主要分為霍奇金淋巴瘤(Hodgkin lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)兩大類,而根據病變部位和范圍的不同,又可細分為80個亞型。目前,淋巴瘤中約90%為NHL,其發生率在西方國家達11/100 000~18/100 000,略高于各類白血病發病率總和。淋巴瘤發生率在我國也呈快速增長態勢,每年新發病例已超過25 000例。淋巴瘤發病原因至今仍不明確,流行病學調查結果認為其發病與免疫缺陷、遺傳和感染有關;此外,人口老齡化、HIV的傳播和環境污染的加劇,也都促進了淋巴瘤發生率的增長[1]。
淋巴瘤常規治療方法主要為手術、放療、化療和造血干細胞移植等,多數方法療效有限,治愈率低且常伴有較嚴重的毒副作用。在20世紀70年代確立的標準化療方案中,CHOP療法(環磷酰胺、多柔比星、長春新堿和潑尼松的聯合用藥)和ABVD療法(阿霉素、博萊霉素、長春新堿和氮烯咪胺的聯合用藥)分別被作為治療NHL和HL的標準療法。雖然近年來科研人員不斷研發出新型化療藥物,并確立了新的化療方案,但惡性淋巴瘤的治愈率仍然很低,給患者的生命帶來極大威脅。近年來,隨著生物技術的興起和免疫學的快速發展,研究人員將生物治療策略引入淋巴瘤治療方案中,與化療等傳統治療方案聯合運用,以期提高療效,減少不良反應,提高患者遠期生存率,并通過相關研究證實生物療法在治療淋巴瘤方面功效卓著。本文對淋巴瘤免疫治療和靶向治療已取得的成果和正在進行的相關研究作一綜述。
1 免疫治療
1.1 主動免疫治療
主動免疫治療指通過加入免疫佐劑等手段增強腫瘤抗原的免疫原性,制備成各種腫瘤疫苗,刺激機體以引發特異性免疫應答,從而克服腫瘤免疫抑制狀態,實現對腫瘤細胞特異性殺傷的療法。相關研究目前多數尚處在實驗室或臨床研究階段,即使進入臨床使用,也僅用于輔助治療以延長患者生存期[2]。其中,腫瘤特異性疫苗、多肽疫苗、核酸疫苗(也稱基因疫苗,包括DNA疫苗和RNA疫苗)和以樹突狀細胞(dendritic cells,DC)為基礎的腫瘤疫苗等開發較早,臨床研究較多,受到了廣泛的關注[3]。
1.1.1 腫瘤特異性疫苗 腫瘤特異性疫苗指利用腫瘤細胞表面獨特型抗原的自身免疫原性制備而成的一種可主動刺激機體,從而激發免疫系統對腫瘤細胞進行特異性殺傷的疫苗。早在1992年,美國FDA便批準了將獨特型疫苗-鑰孔血藍蛋白(Id-KLH)用于治療B細胞淋巴瘤的臨床試驗,結果令人鼓舞。此后一些淋巴瘤獨特型疫苗的臨床研究一直未中斷,其中9項臨床研究結果已經公布,相關研究情況見表 1[4]。
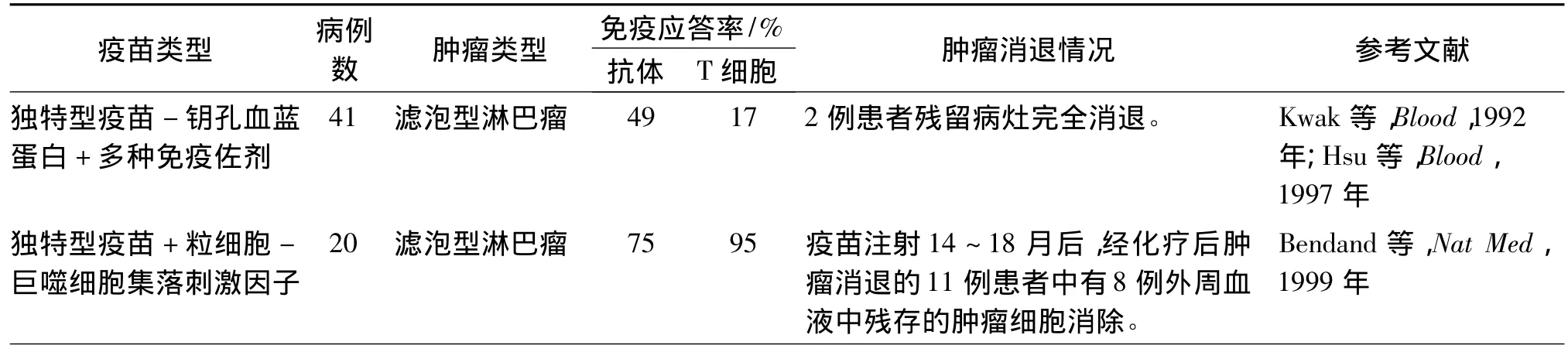
表1 已公布的淋巴瘤獨特型疫苗Ⅰ/Ⅱ期臨床試驗結果Table 1 The published results of phase I/II clinical trials for idiotype vaccination against lymphoma
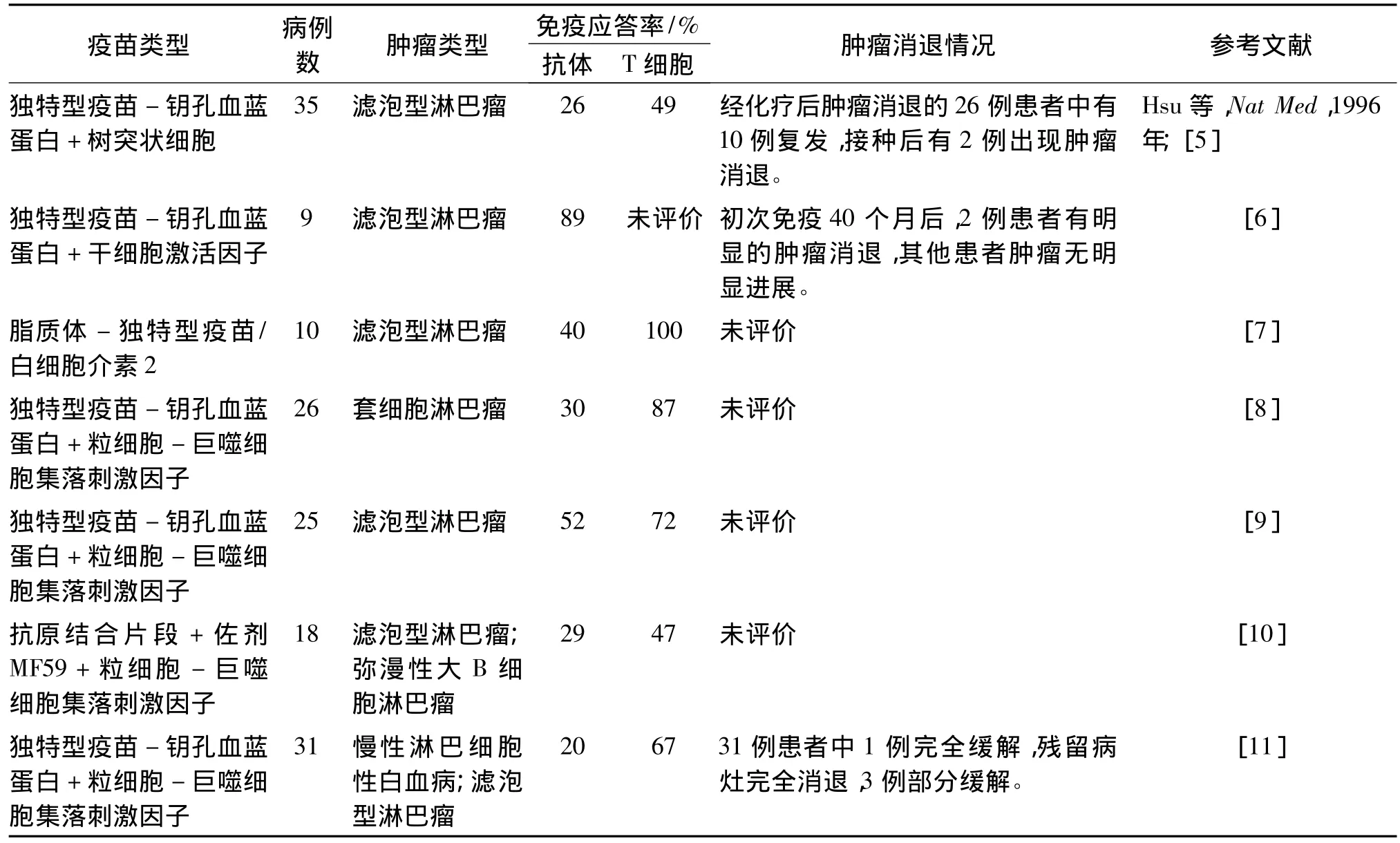
續表1
1.1.2 其他疫苗 根據作用方式不同主要分為3類。
1)增強抗原免疫原性的疫苗 該類疫苗包括DNA疫苗和脂質體疫苗。DNA疫苗是指將編碼某種蛋白質抗原的重組真核表達載體直接注射到動物體內,使外源基因在活體內表達出相關的多肽和蛋白,從而誘導特異性體液免疫和細胞免疫應答的疫苗。目前DNA疫苗主要以質粒作為載體,其因制備簡單、花費少、使用安全以及具有較強的可行性和開發潛力而受到廣泛關注。例如,Timmerman等[12]給12名濾泡型淋巴瘤患者肌肉注射不同劑量的含獨特型基因序列的DNA疫苗,結果有7名患者產生了免疫應答,其中1名患者體內檢測到針對腫瘤抗原的體液和細胞免疫反應,分別有4名和3名患者體內檢測到體液和細胞免疫反應,且隨其劑量的增加,抗體的滴度增加,體液免疫反應增強,未發現此疫苗有明顯的毒副作用。
脂質體疫苗是將自體腫瘤細胞中提取的獨特型抗原或細胞膜蛋白與免疫刺激劑一同載入脂質體中而制得。該疫苗可快速制備并能裝載不同的腫瘤相關抗原,抗原與免疫刺激劑結合后產生的抗體能通過胞內體和細胞溶質2條途徑遞呈,激發CD4+和CD8+T細胞反應。Neelapu等[13]將淋巴結細胞膜蛋白和IL-2載入脂質體中制備了疫苗Oncoquest-L,并給11名濾泡型淋巴瘤患者分別皮下接種于胳膊和腿部2個點,每個點接種0.5 mL,共接種5次,每次間隔1個月。結果,除1例患者完全緩解,1例無效外,其余患者的腫瘤進展時間中位數約為8個月,有較大的腫瘤負荷,其中,5例出現顯著的體液免疫和細胞免疫反應。
2)增強抗原遞呈的疫苗 DC為機體內功能最強的一種專職抗原遞呈細胞(antigen-presenting cell,APC),在初級免疫應答中發揮著極其重要的作用。此外,其還具有獨特的遷移功能,可負載腫瘤抗原遷移至腫瘤發生組織,激活抗腫瘤免疫反應。目前,以DC為基礎的腫瘤疫苗已在動物模型中取得了較好的抗腫瘤效果,部分疫苗已應用于臨床,并在腎癌、前列腺癌和惡性黑色素瘤等實體瘤患者體內的臨床試驗中取得了明顯的療效[14],但尚未見有用于治療淋巴瘤的臨床報道。Gatza等[15]將從C57BL/6小鼠骨髓細胞中獲得、用淋巴瘤細胞株胞內溶解產物刺激之后的DC制備成疫苗,通過皮下注射的方式給藥,2周1次,每次給藥量為1×106個DC,共3次,并以直接輸注獨特型蛋白疫苗的小鼠為對照。結果顯示:DC疫苗組小鼠生存率顯著高于獨特型蛋白疫苗對照組小鼠(100%vs 40%,P<0.05),提示在該實驗中淋巴瘤抗原刺激的DC能發揮更強的抗腫瘤作用。
凋亡抑制因子survivin是凋亡抑制蛋白家族的成員,其在健康細胞上極少表達,而僅表達于腫瘤和胚胎組織,且與腫瘤細胞的分化增殖及浸潤轉移密切相關,因此,其可作為腫瘤免疫治療的理想靶分子。Zeis等[16]用survivin mRNA體外轉染后的人類DC于體外刺激人脾細胞產生細胞毒性T細胞(CTL),將其分別與2種B細胞淋巴瘤Karpas422和IM-9細胞共孵育,用51Cr進行標記,并以未經轉染的DC刺激產生的CTL為對照,孵育4 h后檢測2種細胞株的51Cr同位素釋放量,以計算細胞凋亡率。結果顯示:與轉染survivin mRNA的DC刺激產生的CTL共孵育的Karpas422和IM-9細胞的凋亡率分別為30%和25%,而與未經轉染的DC刺激產生的CTL共孵育的2種細胞則未檢測到明顯的凋亡。Nagaraj等[17]將載有survivin基因的腺病毒轉染的DC疫苗給16只荷瘤小鼠接種(sc,每次注射細胞數5×105個),1周1次,連續3周。結果顯示:該疫苗能夠促進CD8+淋巴細胞的產生,并對EL-4淋巴瘤有一定的抑制作用。Hus等[18]將腫瘤細胞裂解物于體外刺激健康捐贈者骨髓中獲得的DC制備成疫苗,給早期B細胞淋巴瘤患者皮內注射,結果表明該疫苗安全性良好,部分患者僅有輕微的局部皮膚反應。
Toll樣受體9(TLR-9)的配體CpG在體內外均能刺激免疫細胞分泌多種細胞因子,產生特異性免疫應答[19]。Brody等[20]報道了一項利用 CpG 疫苗治療B細胞淋巴瘤的Ⅱ期臨床研究結果。該研究中,對15名低度惡性B細胞淋巴瘤患者腫瘤部位進行低劑量放射治療后在相同部位瘤內注射CpG疫苗,結果顯示:該疫苗在患者體內可誘導明顯的免疫應答,有7例患者腫瘤完全消退,6例部分消退,2例病情穩定,患者對該疫苗耐受性良好,未出現明顯毒副作用,提示腫瘤部位原位接種 CpG疫苗安全可行。
3)增強T細胞抗腫瘤作用的疫苗 目前大多數有關提高淋巴瘤疫苗功效的研究重點集中在增強抗原遞呈方面。然而,研究發現一些病人體內雖會產生抗腫瘤體液免疫或細胞免疫反應,但腫瘤卻未能消退,推測其原因可能是效應階段腫瘤出現的耐受和免疫抑制導致殺傷效果降低所致,因此,闡明并克服這些耐受機制和(或)提高效應階段T細胞或NK細胞對腫瘤細胞的殺傷能力可能成為提高淋巴瘤疫苗功效的一個重要方法[4]。Neelapu 等[13]將免疫刺激因子IL-2整合入脂質體疫苗(IL-2的質量濃度為464 mg·L-1)中,并給11名濾泡型淋巴瘤患者皮下注射(胳膊和腿部,每個位點0.5 mL),每月1次,共5次,結果有5例患者體內被檢測到體液免疫和細胞免疫反應,表明該方法可增加效應T細胞的生成。
1.2 被動免疫治療
被動免疫是指機體被動接受抗體、致敏淋巴細胞或其產物后獲得特異性免疫能力的療法,其特點是效應快,無潛伏期,一經輸入即可獲得免疫力。常見的淋巴瘤被動免疫治療藥物或方法包括以下兩類。
1.2.1 單克隆抗體 人鼠嵌合型抗CD20抗體利妥昔單抗(rituximab,商品名:美羅華)于1997年被美國FDA批準用于CD20陽性的復發性或難治性低度惡性B細胞淋巴瘤的治療,是世界上首個用于治療淋巴瘤的單克隆抗體。研究顯示:95%以上的淋巴瘤B細胞表達CD20,利妥昔單抗與B淋巴細胞表面CD20抗原結合后,通過補體依賴性細胞毒性 (complement-dependent cellular cytotoxicity,CDCC)和抗體依賴性細胞毒性(antibody-dependent cellular cytotoxicity,ADCC)作用清除腫瘤細胞。
目前,治療彌漫性大B細胞淋巴瘤(DLBCL)的一線療法系將利妥昔單抗等與傳統化療方案CHOP聯用,即R-CHOP療法。Foran等(J Clin Oncol,2000年)的研究表明:與傳統CHOP療法相比,R-CHOP療法能有效清除NHL患者體內微小殘留病灶,提高療效而不增加毒性,使患者的生存率進一步提高。除聯合用藥直接治療淋巴瘤外,在化療后使用利妥昔單抗也是一種很好的維持治療方案。Vidal等[21]對近年來采用利妥昔單抗維持治療方案的5項隨機、對照臨床試驗結果進行了分析。試驗共有985名淋巴瘤(主要包括濾泡型和彌漫性大B細胞淋巴瘤)患者參加,利妥昔單抗給藥劑量均為375 mg·m-2·d-1。給藥方案如下:在其中 3 項實驗中,每4周1個療程,持續6個療程;另2項實驗中,每2~3個月給藥1次,分別持續8~9個月和2年。結果顯示:上述各項試驗中,利妥昔單抗維持治療組患者總生存率明顯高于單獨CHOP化療組[死亡風險比(HR)=0.60,95%置信區間為 0.45 ~0.79],提示在實施標準治療方案后采用利妥昔單抗維持治療方案是延長患者生存期的有效方法。
整合膜蛋白CD74主要表達于惡性B淋巴瘤細胞,有促進細胞生長的作用,而在正常組織細胞中很少表達,這一特點使其成為治療淋巴瘤很有吸引力的靶點。例如,人源抗CD74抗體milatuzumab目前已進入治療多發性骨髓瘤、NHL及慢性淋巴細胞性白血病的Ⅰ期臨床研究。臨床前研究發現,該藥無論單獨用藥還是與利妥昔單抗聯合用藥,均能明顯增加6種不同套細胞淋巴瘤細胞株的死亡率。一項體內實驗將30只雌性SCID小鼠隨機平均分為3組,分別灌胃給予 milatuzumab(15 mg·kg-1)、利妥昔單抗(15 mg·kg-1)或二者聯合給藥(ip,15 mg·kg-1),每3 d給藥1次。結果顯示:與milatuzumab組和利妥昔單抗組相比,聯合用藥組小鼠的生存時間中位數明顯延長(44.5 vs 33.5,38 d,P <0.05)[22]。
CD52在濾泡型淋巴瘤、套細胞淋巴瘤和邊緣區B細胞淋巴瘤等腫瘤細胞表面表達量很高。阿侖珠單抗(alemtuzumab)即為一種人源抗CD52抗體,其體外作用機制與利妥昔單抗相似。該藥于2001年被FDA批準用于治療B細胞慢性淋巴細胞白血病。目前,除上述抗體外,尚有多種單抗用于淋巴瘤的臨床研究,其主要研究進展見表2[23]。
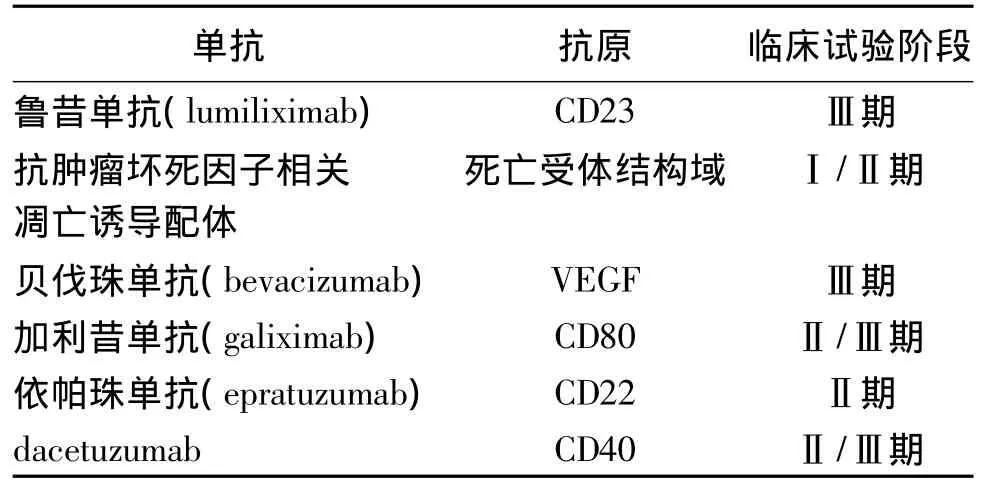
表2 用于治療惡性B細胞淋巴瘤的單克隆抗體Table 2 The monoclonal antibodies for the treatment of B-cell malignancy
1.2.2 放射免疫治療 放射免疫治療(radioimmunotherapy,RIT)是用放射性核素對單抗進行標記,利用單抗的靶向性使放射性核素聚集于靶細胞,實現殺傷腫瘤細胞的目的的療法。與單獨使用單抗相比,RIT結合了免疫治療和放射治療的優點,其射線可穿透多個細胞直徑的距離,殺傷位于腫瘤深部、抗體難以到達的細胞,對復發性、難治性、低度惡性濾泡型、轉化型B細胞淋巴瘤均具有良好的療效;與單純放射治療相比,RIT則極大減少了放射性核素在血液中的停留時間,從而降低了對血液系統的毒副作用,并提高了療效[24]。
目前已成功使用的放射性免疫治療藥物主要有釔[90Y]標記的替伊莫單抗(90Y-ibritumomab tiuxetan,商品名:Zevalin?)、依帕珠單抗(90Y-epratuzumab)及碘[131I]標記的托西莫單抗(131I-tositumomab,商品名:Bexxar?)。其中,以 CD20抗原為靶標的 Zevalin?和 Bexxar?分別于2002年和2003年被美國FDA批準上市,Zevalin?在歐美被用于治療復發性、難治性的濾泡型淋巴瘤。人源抗CD22抗體90Y-epratuzumab則為一種免疫調節劑,目前在臨床上較多地用于NHL治療;此外,其與利妥昔單抗聯合用藥,還可增加治療淋巴瘤的療效[25]。
1.3 過繼免疫治療
過繼免疫治療(adoptive immunotherapy)是把具有特異免疫力的致敏淋巴細胞或致敏淋巴細胞產物在體外活化增生后再輸送給腫瘤患者,以扭轉患者細胞免疫功能低下的狀態,促進宿主抗腫瘤免疫功能,從而發揮抗腫瘤作用。根據輸注細胞的抗原特異性,可將過繼免疫治療分為:1)非特異性過繼性細胞治療,如利用淋巴因子活化的殺傷細胞(LAK)、細胞因子誘導的殺傷細胞(CIK)和自然殺傷T細胞的治療;2)特異性過繼性細胞治療,主要指利用CTL的治療。
Lucas等[26]將6名 EB 病毒(EBV)陽性的 HL病人分為兩組(每組各3名),給組1患者靜脈輸注EBV CTL(每次5.0×106個·kg-1,共注射 3 次);組2 患者先接受化療藥物氟達拉濱(30 mg·m-2·d-1,iv),連續3 d后再外周靜脈輸注1次 EBV CTL(1.5×107個·kg-1)。結果顯示:組1中3位患者病情均有所緩解,且其中1名患者注射后22個月內未被檢測到新病灶;組2中3位患者病情同樣有所緩解,其中1名患者病情持續7個月無進展。表明過繼免疫治療對EBV陽性的HL有效。
2 靶向治療
淋巴瘤靶向治療藥物可優先作用于腫瘤細胞而較少作用于正常細胞,其短期或長期毒副作用較傳統化療藥物明顯減少。隨著與腫瘤生長密切相關的基因和蛋白等靶點越來越多地被發現,針對這些位點的靶向治療策略也為淋巴瘤患者帶來了新的希望。目前研究較多的腫瘤作用靶點主要包括bcl-2、蛋白酶體(proteasome)、組蛋白去乙酰化酶(histone deacetylase,HDAC)、蛋白酪氨酸激酶(protein tyrosine kinase,PTK)和蛋白激酶 C(protein kinase C,PKC)等。
2.1 反義寡核苷酸
反義寡核苷酸(antisense oligodeoxyribonucleotide,ASODN)是與靶DNA或RNA堿基互補,并能與之結合的DNA或RNA片段。對其的研究最早開展于1978年,目前有關ASODN治療淋巴瘤的研究主要集中在對原癌基因bcl-2進行靶向結合方面,該基因在許多套細胞淋巴瘤中呈高表達,可抑制淋巴瘤細胞凋亡。
單鏈寡聚脫氧核苷酸oblimersen可與人類bcl-2基因閱讀框前6個密碼子互補,從而可靶向結合并下調bcl-2基因的表達,進而抑制Bcl-2蛋白的合成,促進腫瘤細胞凋亡。一項有42名淋巴瘤患者參加的Ⅱ期臨床試驗考察了oblimersen鈉鹽與利妥昔單抗聯用的療效和安全性,該實驗為期6周,于第1、3、5周給所有患者靜脈滴注oblimersen鈉鹽(3 mg·kg-1·d-1),同時,每周1 次,連續6 周靜脈滴注利妥昔單抗(375 mg·m-2)。結果顯示:該實驗整體應答率達42%,分別有10名和8名患者獲得完全和部分緩解,并有12名患者病情穩定;其中濾泡型淋巴瘤患者的總體應答率達60%(8名完全緩解,4名部分緩解),所有產生應答的患者應答持續時間中位數為12個月,多數毒性反應較輕微且具有可逆性。該實驗證實oblimersen鈉鹽與利妥昔單抗聯合用藥安全有效,并對濾泡型淋巴瘤有較好的治療效果[27]。
2.2 蛋白抑制劑
2.2.1 蛋白酶體抑制劑 泛素-蛋白酶體通路(UPP)在正常細胞和病變細胞的蛋白降解中起著十分重要的作用。在腫瘤的發生發展中,該通路與腫瘤細胞周期失控和自噬等方面有著緊密的內在聯系[28]。蛋白酶體抑制劑可通過抑制UPP調節細胞周期,促進細胞凋亡。其主要代表藥物為硼替佐米(bortezomib),該藥能特異性抑制哺乳動物細胞內26S蛋白酶體的類胰凝乳蛋白酶活性,干擾胞內多種信號轉導通路,從而誘導腫瘤細胞死亡,已被FDA批準作為復發性、難治性套細胞淋巴瘤的一線治療藥物。體外實驗證明:硼替佐米對多種類型的癌細胞均具有細胞毒性,其主要通過影響細胞周期調控蛋白及NF-κB活性,發揮抗腫瘤作用。在一項Ⅱ期臨床試驗中,給26名淋巴瘤患者(包括10例濾泡型淋巴瘤、11例套細胞淋巴瘤、3例小淋巴細胞性淋巴瘤和2例邊緣區淋巴瘤)每周靜脈滴注硼替佐米(1.5 kg·m-2)2次。結果顯示:其總緩解率(OR)為58%,腫瘤進展時間中位數為3~24個月不等。其中,濾泡型淋巴瘤患者中分別有1人和4人完全和部分緩解;套細胞淋巴瘤患者中,4人部分緩解,4人病情穩定,1人被證實完全緩解,1人的腫瘤進展時間中位數達19個月;邊緣區淋巴瘤的2名患者均部分緩解,腫瘤進展時間中位數分別大于8和11個月,小淋巴細胞性淋巴瘤患者未產生應答[29]。
2.2.2 組蛋白去乙酰化酶抑制劑 HDAC是一組通過誘導組蛋白去乙酰化來調控轉錄、細胞周期、細胞分化和細胞凋亡等生物學效應的酶。組蛋白的乙酰化和去乙酰化作用的平衡在基因轉錄的調控過程中起著重要作用,癌細胞中HDAC過度表達可導致組蛋白去乙酰化作用增強,不利于腫瘤抑制基因表達從而促進腫瘤細胞增生。目前HDAC抑制劑的抗腫瘤作用機制尚不明確,有學者認為,組蛋白乙酰化作用的增強可激活腫瘤生長抑制因子基因的轉錄,從而抑制腫瘤細胞的生長(Vanint等,Gene Expr,1996年),HDAC抑制劑則能增強組蛋白乙酰化作用,實現抑制腫瘤生長的作用;也有人認為HDAC抑制劑可調控細胞分化,促進相關蛋白凋亡,誘導腫瘤細胞周期停滯、分化和凋亡,除直接抑制和糾正腫瘤細胞增殖過度和逃逸凋亡外,其還可通過抑制血管內皮生長因子(VEGF)活性抑制腫瘤血管形成,并可增強腫瘤對放化療的敏感性,與其他抗癌藥物聯用還可改善化療中常見的耐藥問題[30-31]。
目前至少有12種HDAC抑制劑進入臨床試驗,其中辛二酰苯胺異羥肟酸(suberoylanilide hydroxamic acid,SAHA)是首個被FDA批準的用于治療向表皮性皮膚T細胞淋巴瘤的藥物。在一項有33名難治性表皮淋巴瘤患者參加的Ⅱ期臨床試驗中,患者口服 SAHA(400 mg·d-1),結果8 名患者部分緩解,14名患者皮膚瘙癢癥狀有所減輕[32]。國產藥西達本胺則于2006年獲得中國食品藥品監督管理局(SFDA)簽發的臨床批件,并已在國內13個臨床研發基地啟動將其用于NHL的Ⅱ/Ⅲ臨床研究。
2.2.3 小分子酪氨酸激酶抑制劑 PTK是一類催化蛋白酪氨酸殘基磷酸化的激酶,在細胞生長、增殖、分化及多種生命信號通路中起關鍵作用。多數原癌基因和癌基因產物表現出PTK活性,其異常表達將導致細胞增殖調節紊亂,從而促進腫瘤的發生和發展。目前已研制出多個酪氨酸蛋白抑制劑,如靶向bcr-abl基因(abl原癌基因與bcr基因相互易位形成的融合基因)的伊馬替尼(imatinib)和靶向原癌基因c-erbB1的表達產物表皮生長因子受體(epidermal growth factor receptor,EGFR)的 ZD1839。
多靶點酪氨酸激酶抑制劑舒尼替尼(sunitinib)則對血管內皮細胞生長因子受體、血小板源性生長因子受體和干細胞因子受體(C-KIT)均有抑制作用。該藥于2006年1月獲得FDA批準用于治療胃腸基質細胞癌和進展期腎細胞癌。此外,一項將該藥用于19名復發性、難治性DLBCL患者的Ⅱ期臨床試驗結果也已公布,但結果并不樂觀:受試者連續4周口服舒尼替尼(37.5 g·d-1)后,多數患者病情無明顯緩解,僅有9人病情穩定;3/4級中性粒細胞減少癥和血小板減少癥發生率分別為29%和35%,研究小組認為該藥對復發性、難治性DLBCL幾乎無作用,且導致血液學毒性明顯增加,該項試驗因此而被迫停止[33]。不過,舒尼替尼對其他亞型淋巴瘤療效的相關研究仍在進行中。
2.2.4 蛋白激酶抑制劑 PKC是能夠催化蛋白磷酸化的一組酶的總稱,為一類多功能絲氨酸和蘇氨酸激酶,其作用于細胞核中的轉錄因子,在基因表達調控中起著關鍵作用。PKC的過度表達與多種癌癥相關,其中PKC β與VEGF誘導的腫瘤血管生成密切相關[34]。Enzastaurin(代號:LY17615)即為禮來公司開發的口服絲氨酸-蘇氨酸蛋白激酶抑制劑,其能選擇性地抑制PKC β,通過降低細胞復制能力、促進腫瘤細胞凋亡及切斷腫瘤血液供應等多種機制,抑制腫瘤生長[35]。目前該藥主要用于NHL患者以維持病情穩定,防止復發。2006年,一項將其用于經R-CHOP療法治療緩解后的DLBCL患者進行維持治療的Ⅲ期臨床研究獲FDA批準,此后,SFDA也于2008年批準在中國開展該項研究。
3 結語
淋巴瘤的分類眾多,且各亞型間臨床表征不同,故對其治療需根據WHO分類亞型的不同而采取針對性的治療,并應根據患者病情、預后等情況進行個體化治療。目前,淋巴瘤治療正向多學科綜合治療模式轉變。雖然淋巴瘤的生物治療仍處于輔助治療地位,但不可否認的是,隨著惡性淋巴瘤的基礎和臨床研究的進展以及生物診療技術的進步,免疫治療藥物和靶向治療藥物在淋巴瘤治療和改善預后方面將發揮更加積極有效的作用。
近年來,研究發現熱休克蛋白HSP70能誘導Th1型極化反應,增強CD40L誘導的DC成熟,刺激B細胞增殖和分化,促進IL-6和TNF-α等細胞因子的分泌,促進記憶細胞的形成,提高抗原遞呈效率,激發機體細胞免疫[36]。筆者所在課題組將T輔助表位mHSP70407-426(簡稱M)串聯重復后與DNA疫苗聯合使用,考察其對前列腺癌移植瘤模型小鼠的抑瘤效果,結果表明串聯重復的M能明顯增強DNA疫苗的抗腫瘤作用[37-39]。鑒于上述研究,本課題組使用串聯重復2次的mHSP70407-426片段(簡稱M2)作為免疫增強劑制備鼠源肝癌H22腫瘤全細胞疫苗,并通過預防性免疫和治療性免疫,對其抗H22作用進行考察,發現該疫苗能顯著抑制H22生長,提示M2的引入確能顯著增強疫苗的抗H22作用,上調體液免疫和細胞免疫,增強對腫瘤細胞的殺傷作用[40]。目前本課題組采用相關的技術對M2進行了純化,并將純化后的M2與鼠源淋巴瘤A20全細胞裂解物偶聯制備鼠源淋巴瘤全細胞疫苗,在BALB/c小鼠中考察該疫苗抗淋巴瘤效果,相關研究結果將另文發表。
[1] 孫琦,陳輝樹.惡性淋巴瘤的病因學研究進展[J].國際輸血及血液學雜志,2006,29(5):398-402.
[2] Juweid M E,Stroobants S,Hoekstra O S,et al.Use of positron emission tomography for response assessment of lymphoma:consensus of the imaging subcommittee of the international harmonization project in lymphoma[J].J Clin Oncol,2007,25(5):571-578.
[3] Briones J.Therapeutic vaccines for non-Hodgkin B-cell lymphoma[J].Clin Transl Oncol,2008,10(9):543-551.
[4] Houot R,Levy R.Vaccines for lymphomas:idiotype vaccines and beyond[J].Blood Rev,2009,23(3):137-142.
[5] Timmerman J M,Czerwinski D K,Davis T A,et al.Idiotype-pulsed dendritic cell vaccination for B-cell lymphoma:clinical and immune responses in 35 patients[J].Blood,2002,99(5):1517-1526.
[6] Barrios Y,Cabrera R,Yanez R,et al.Anti-idiotypic vaccination in the treatment of low grade B-cell lymphoma[J].Haematologica,2002,87(4):400-407.
[7] Neelapu S S,Baskar S,Gause B L,et al.Human autologous tumor-specific T-cell responses induced by liposomal delivery of a lymphoma antigen[J].Clin Cancer Res,2004,10(24):8309-8317.
[8] Neelapu S S,Kwak L W,Kobrin C B,et al.Vaccineinduced tumor-specific immunity despite severe B-cell depletion in mantle cell lymphoma[J].Nat Med,2005,11(9):986-991.
[9] Inoges S,Rodriguez C M,Zabalegui N,et al.Clinical benefit associated with idiotypic vaccination in patients with follicular lymphoma[J].J Natl Cancer Inst,2006,98(18):1292-1301.
[10] Bertinetti C,Zirlik K,Heining M K,et al.Phase I trial of a novel intradermal idiotype vaccine in patients with advanced B-cell lymphoma:specific immune responses despite profound immunosuppression[J].Cancer Res,2006,66(8):4496-4502.
[11] Redfern C H,Guthrie T H,Bessudo A,et al.Phase II trial of idiotype vaccination in previously treated patients with indolent non-Hodgkin’s lymphoma resulting in durable clinical responses[J].J Clin Oncol,2006,24(19):3107-3112.
[12] Timmerman J M,Singh G,Hermanson G,et al.Immunogenicity of a plasmid DNA vaccine encoding chimeric idiotype in patients with B-cell lymphoma[J].Cancer Res,2002,62(20):5845-5852.
[13] Neelapu S S,Gause B L,Harvey L,et al.A novel proteoli posomal vaccineinducesantitumorimmunity against follicular lymphoma [J].Blood,2007,109(12):5160-5163.
[14]張新華,周敏,冉啟杰,等.非霍奇金淋巴瘤的免疫治療現狀[J].中國腫瘤臨床與康復,2009,16(6):565-567.
[15] Gatza E,Okada C Y.Tumor cell lysate-pulsed dendritic cells are more effective than TCR Id protein vaccines for active immune-therapy of T cell lymphoma[J].J Immunol,2002,169(9):5227-5235.
[16] Zeis M,Siegel S,Wagner A,et al.Generation of cytotoxic responses in mice and human individuals against hematological malignancies using survivin-RNA-transfected dendritic cells[J].J Immunol,2003,170(11):5391-5397.
[17] Nagaraj S,Pisarev V,Kinarsky L,et al.Dendritic cellbased full-length survivin vaccine in treatment of experimental tumors[J].J Immunother,2007,30(2):169-179.
[18] Hus I,Rolinski J,Tabarkiewicz J,et al.Allogeneic dendritic cells pulsed with tumor lysates or apoptotic bodies as immunotherapy for patients with early-stage B-cell chronic lymphocyticleukemia[J].Leukemia,2005,19(9):1621-1627.
[19] Schneeberger A,Wagner C,Zemann A,et al.CpG motifs are efficient adjuvants for DNA cancer vaccines[J].J Invest Dermatol,2004,123(2):371-379.
[20] Brody J D,Ai W Z,Czerwinski D K,et al.In situ vaccination with a TLR9 agonist induces systemic lymphoma regression:a phase I/II study[J].J Clin Oncol,2010,28(28):4324-4332.
[21] Vidal L,Gafter-Gvili A,Leibovici L,et al.Rituximab maintenance for the treatment of patients with follicular lymphoma:systematic review and meta-analysis of randomized trials[J].J Natl Cancer Inst,2009,101(4):248-255.
[22] Alinari L,Yu B,Christian B A,et al.Combination anti-CD74(milatuzumab)and anti-CD20(rituximab)monoclonal antibody therapy has in vitro and in vivo activity in mantle cell lymphoma[J].Blood,2011,117(17):4530-4541.
[23] Kobayashi Y.Recent advances in the treatment of follicular lymphoma[J].Int J Clin Oncol,2009,14(3):191-196.
[24]盧霞,王榮福.淋巴瘤的放射免疫治療[J].中國腫瘤影像學,2009,2(3):90-93.
[25] Mattes M J,Sharkey R M,Karacay H,et al.Therapy of advanced B-lymphoma xenografts with a combination of90Y-anti-CD22 IgG(epratuzumab)and unlabeled anti-CD20 IgG(veltuzumab)[J].Clin Cancer Res,2008,14(19):6154-6160.
[26] Lucas K G,Salzman D,Garcia A,et al.Adoptive immunotherapy with allogeneic Epstein-Barr virus(EBV)-specific cytotoxic T-lymphocytes for recurrent,EBV-positive Hodgkin disease[J].Cancer,2004,100(9):1892-1901.
[27] Pro B,Leber B,Smith M,et al.Phase II multicenter study of oblimersen sodium,a Bcl-2 antisense oligonucleotide,in combination with rituximab in patients with recurrent B-cell non-Hodgkin lymphoma[J].Br J Haematol,2008,143(3):355-360.
[28]白勇,孫安盛,顧振綸,等.泛素-蛋白酶體通路在細胞生存和腫瘤發生中的作用[J].中國藥理學通報,2008,24(20):1268-1271.
[29] O'Connor O A,Wright J,Moskowitz C,et al.Phase II clinical experience with the novel proteasome inhibitor bortezomib in patients with indolent non-Hodgkin's lymphoma and mantle cell lymphoma[J].J Clin Oncol,2005,23(4):676-684.
[30] Sasakawa Y,Naoe Y,Noto T,et al.Antitumor efficacy of FK228,a novel histone deacetylase inhibitor,depends on the effect on expression of anogenesis factors[J].Biochem Pharmacol,2003,66(6):897-906.
[31] Chinnaiyan P,Vallabhaneni G,Armstrong E,et al.Modulation of radiation response by histone deacetylase inhibition[J].Int J Radiat Oncol Biol Phys,2005,62(1):223-229.
[32] Dokmanovic M,Clarke C,Marks P A.Histone deacetylase inhibitors:overview and perspectives[J].Mol Cancer Res,2007,5(10):981-989.
[33] Buckstein R,Kuruvilla J,Chua N,et al.Sunitinib in relapsed or refractory diffuse large B-cell lymphoma:a clinical and pharmacodynamic phase II multicenter study of the NCIC Clinical Trials Group[J].Leuk Lymphoma,2011,52(5):833-841.
[34] 楊臻崢.抗癌藥 Enzastaurin[J].藥學進展,2008,32(10):474-476.
[35] Verdell D,Nobili L,Todoerti K,et al.Molecular targeting of the PKC-β inhibitor enzastaurin(LY317615)in multiple myeloma involves a coordinated downregulation of MYC and IRF4 expression[J].Hematol Oncol,2009,27(1):23-30.
[36] Wang Y,Whittall T,McGowan E,et al.Identification of stimulating and inhibitory epitopes within the heat shock protein 70 molecule that modulate cytokine production and maturation of dendritic cells[J].J Immunol,2005,174(6):3306-3316.
[37] Lu Y,Mekoo D J,Ouyang K,et al.Strong humoral response elicited by a DNA vaccine targeting gastrinreleasing peptide with optimized adjuvants inhibits murine prostate carcinoma growth in vivo[J].Endocr Relat Cancer,2009,16(4):1171-1184.
[38] Lu Y,Ouyang K,Fang J,et al.Improved efficacy of DNA vaccination against prostate carcinoma by boosting with recombinant protein vaccine and by introduction of a novel adjuvant epitope[J].Vaccine,2009,27(39):5411-5418.
[39] Fang J,Lu Y,Ouyang K,et al.Specific antibodies elicited by a novelDNA vaccine targeting gastrin-releasing peptide inhibit murine melanoma growth in vivo[J].Clin Vaccine Immunol,2009,16(7):1033-1039.
[40]劉景晶,胡向兵,范豪.一種新型的抗腫瘤細胞疫苗及其制備方法:中國,101954073[P].2011-01-26.

