天山雪蓮UDP葡萄糖-類黃酮-3-O-葡萄糖基轉移酶基因的克隆及功能分析
唐亞萍,原慧,覃建兵
新疆師范大學分子生物學與生物信息研究室,新疆 烏魯木齊 830053
黃酮類化合物是植物次生代謝過程中主要的產物之一,在植物的生理和形態學方面發揮著各種各樣的功能。黃酮類化合物能夠幫助植物抗紫外線、抵抗病原微生物的侵害、抗蟲害并在植物生殖過程中擔當信使[1]。黃酮類化合物也是人類和動物的重要營養物質之一,尤其在人類的營養和醫藥方面,黃酮類化合物具有抗輻射、抗氧化、抗癌及心血管疾病等方面發揮著重要的作用。
糖基轉移酶廣泛存在于植物中,催化植物次生代謝產物的合成,是植物次生代謝過程中的重要部分,是天山雪蓮藥用化學成分花青素的生物合成的關鍵酶。UDP葡萄糖-類黃酮-3-O-葡萄糖基轉移酶 (3GT) 催化UDP葡萄糖的糖基取代花色素的3-OH集團,催化不穩定的花色素糖苷形成各種穩定的花色苷[2],對花色素進行糖基化修飾,以增加其穩定性和水溶性。Kho等[3]1978年首次對3GT基因的遺傳調控和酶活性進行報道,3GT基因是1984年采用轉座子標簽技術從玉米中分離而來[4],隨后控制3GT基因活性的遺傳位點An1、An2和An3也在矮牽牛中被分離出來[5]。
天山雪蓮為新疆特有的珍惜名貴中藥,為國家三級保護漸危植物[6],特殊的生長環境造就了其獨特的藥用價值。黃酮類化合物是天山雪蓮的主要藥用成分,在水母雪蓮Saussurea medusa、天山雪蓮 Saussurea involucrate和雪兔子Saussurea gossypiphora野生植株中,天山雪蓮總黃酮的抗氧化活性最高[7]。天山雪蓮花青素屬黃酮類化合物,具有抗氧化、抗輻射、抗癌等作用。由于人類對天山雪蓮自然資源的掠奪性開采,使得該物種瀕臨滅絕,目前有關天山雪蓮分子生物學的研究較少。本研究從天山雪蓮中克隆了3GT基因,運用生物信息軟件對3GT基因的蛋白質序列進行分析,構建了該蛋白的系統進化樹,通過農桿菌介導的同源轉化,經篩選得到轉基因天山雪蓮愈傷組織,其總黃酮含量明顯高于非轉基因的愈傷組織。初步鑒定了天山雪蓮3GT基因在黃酮代謝途徑中的作用,為提高天山雪蓮中藥用化學成分黃酮類物質及實現天山雪蓮花青素的人工生物合成的研究奠定基礎,為解決天山雪蓮資源匱乏提供參考。
1 材料與方法
1.1 天山雪蓮材料及實驗試劑
野生天山雪蓮種子采集于天山“一號冰川”,挑選籽粒飽滿的種子50粒,經滅菌后接入1/2 MS培養基內[8],待種子發芽長出真葉4~5片后使用。
大腸桿菌DH5α感受態、LA Taq酶、3′-Full RACE Core Set Ver.2.0、限制性內切酶 (TaKaRa公司);TRIzol試劑、PCR 2.1 vector、PCR Super Mix、T4 DNA 連接酶 (Invitorgen公司);RevertAid First Stand cDNA Synthesis Kit (Fermentas公司);SMARTer RACE cDNA Amplification Kit (Clontech公司);乙酰丁香酮(Sigma公司);潮霉素 B (Roche Diagnostics GmbH,Germany)。
1.2 天山雪蓮總RNA提取及cDNA第一鏈合成
采用液氮研磨法用 TRIzol試劑提取天山雪蓮葉片、莖、根及愈傷組織總 RNA。按照RevertAid First Stand cDNA Synthesis Kit說明書合成cDNA第一鏈。按照SMARTer RACE cDNA Amplification Kit及 3′-Full RACE Core Set Ver.2.0試劑盒說明書合成5′端及3′端完整的天山雪蓮葉片cDNA第一鏈。
1.3 天山雪蓮cDNA片段的同源克隆
根據3GT基因的同源序列利用Primer5.0及Oligo6.0設計基因特異引物FGT和RGT (表1),以cDNA第一鏈為模板擴增天山雪蓮3GT基因的保守區域,反應條件為:94 ℃ 5 min ;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,30個循環;72 ℃延伸10 min。擴增的PCR產物經Axygen的凝膠回收試劑盒回收目的條帶后連接到PCR2.1載體中,經酶切鑒定送華大基因有限公司測序。
1.4 天山雪蓮 3GT基因的 3′ RACE和5′ RACE
根據測序獲得的cDNA片段,用生物信息軟件設計基因特異引物 (表1),以cDNA第一鏈為模板,3′ RACE outer Primer、3′ RACE inner Primer、GTF1和GTF2為引物,進行Nested PCR,反應條件為:94 ℃ 5 min;94 ℃ 30 s,65 ℃~ 50℃30 s,72 ℃ 1 min ,30個循環 (每個循環降低0.5 ℃);72 ℃延伸10 min。5′ RACE 以GTR1和GTR2為引物,按照SMARTer RACE cDNA Amplification Kit說明書進行PCR擴增,反應條件與3′ RACE反應條件相同。擴增產物經連接轉化,PCR及酶切鑒定后測序。
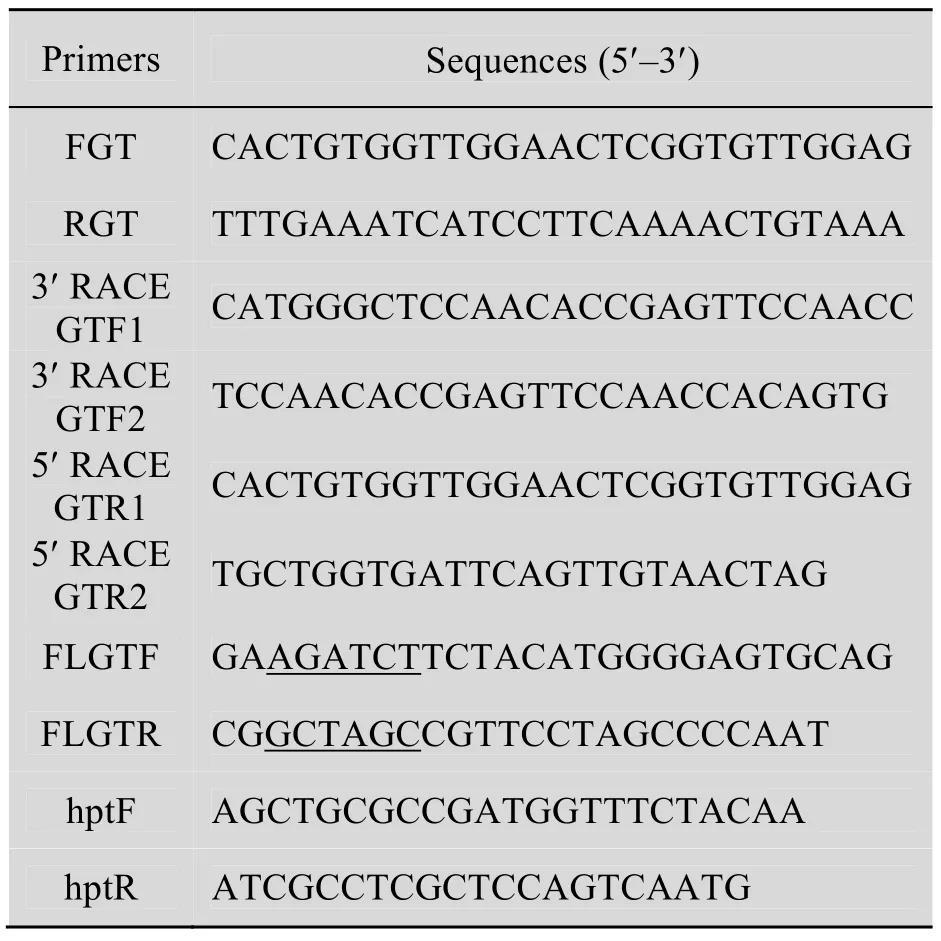
表1 文中所用引物序列Table 1 Primer used in this study
1.5 cDNA全長擴增
依據 cDNA拼接序列,以基因特異引物FLGTF和 FLGTR,引物中劃線部分為 BglⅡ和NheⅠ酶切位點,對cDNA序列進行全長擴增,反應條件為:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min ,30個循環;72 ℃延伸10 min,并對擴增產物測序。
1.6 天山雪蓮3GT基因cDNA序列及其編碼蛋白氨基酸的序列分析
在 NCBI (www.ncbi.nlm.nih.gov/) 和DNAMAN中進行基因序列的同源比較,在NCBI中的ORF Finding進行開放閱讀框的預測,用軟件DNAMEN對基因cDNA進行核苷酸序列分析,在網站Clustal W2 (www.ebi.ac.uk/clustalw/)進行氨基酸序列的同源序列比對并構建系統進化樹。
1.7 3GT基因的轉錄模式
用3GT基因的全長引物及用軟件Primer5.0及Oligo6.0設計,對3GT基因組織器官表達模式進行分析。內參基因為β-actin基因特異引物。
1.8 3GT基因的表達載體的構建及農桿菌轉化
將已獲得的 3GT基因全長及表達載體pCAMBIA1305.1同時用內切酶BglⅡ和NheⅠ在恒溫水浴鍋中37 ℃雙酶切2 h以上。酶切產物經回收純化后連接轉化入大腸桿菌Escherchia coli DH5α,提取大腸桿菌質粒,篩選陽性克隆,用電擊轉化法轉化進入根癌農桿菌 Agrobacterium tumefaciens菌株EHA105中,用3GT全長基因特異引物進行 PCR檢測轉化的農桿菌菌株,將檢測到的菌株命名為pS3GT。
1.9 3GT基因葉盤轉化及轉基因愈傷組織的篩選
天山雪蓮葉片切成0.5 cm×0.5 cm大小的葉盤,將該葉盤置于天山雪蓮愈傷組織誘導培養基中暗培養 2 d,葉盤浸泡在含有pS3GT菌株及100 μmol/L乙酰丁香酮,OD600=0.5的MS液體培養基中10 min[9-10]。將共培養2 d的葉盤轉入含有8 mg/L潮霉素 (Hygromycin,hyg) 的天山雪蓮愈傷組織誘導培養基內進行轉基因愈傷組織的篩選[11],45 d后,提取在抗性培養基上生長的愈傷組織的 DNA,用潮霉素基因的特異引物hptF和hptR (表1) 進行轉基因愈傷組織的篩選。
1.10 轉基因愈傷組織的懸浮培養及紫外分光光度法測量總黃酮
將篩選到的轉 3GT基因的愈傷組織及非轉基因愈傷組織各0.2 g分別接入10 mL的N6液體培養基內進行懸浮培養[12],光周期為12 h,轉速110 r/min,培養溫度為25 ℃。分別培養4、8、12、16 d,試驗重復3次。將培養的愈傷組織在60 ℃烘箱內烘干,測量干重,并用80%乙醇,60 ℃浸泡過夜提取總黃酮,用紫外分光光度法測定[12],波長為 510 nm,其蘆丁標準品與其吸光度的直線方程:C=0.09344A?0.00230797,r=0.9992 (C為總黃酮含量單位是g/L,A為光的吸收變量),并測量雪蓮愈傷組織的總黃酮量。
2 結果與分析
2.1 天山雪蓮 UDP葡萄糖-類黃酮-3-O-葡萄糖基轉移酶基因cDNA片段的分析
根據雙子葉植物3GT基因同源序列,運用生物信息軟件設計的天山雪蓮 3GT基因特異引物進行擴增,純化此擴增產物并進行測序,結果獲得1個327 bp的cDNA片段 (圖1) 經生物信息軟件DNAMAN、Clustal W2及Blast分析發現該片段與菊科向日葵屬植物的葡萄糖苷轉移酶基因UGT90A7 (GenBank Accession No. EU561019)高度同源,相似性達到100%,與鳶尾屬植物的3GT (GenBank Accession No. AB161175) 基因相似性為88%,表明實驗獲得的cDNA片段為目的基因類黃酮-3-O-葡萄糖基轉移酶基因片段。
2.2 天山雪蓮 UDP葡萄糖-類黃酮-3-O-葡萄糖基轉移酶基因全長cDNA的克隆與序列分析
依據天山雪蓮中該基因cDNA片段的核苷酸序列設計特異引物,用RACE技術克隆目的基因的3′和5′cDNA末端序列進行,測序結果表明,其大小分別為570 bp和1 190 bp (圖1)。

圖1 3GT基因特異引物 RT-PCR、3′ RACE及5′ RACE擴增Fig. 1 PCR products of RT-PCR, 3′ RACE and 5′RACE. M : DNA marker; 1: product of primers FGT and RGT; 2: product of 3GT 3′ RACE; 3: product of 3GT 5′ RACE.
對已獲得的3個cDNA片段進行序列拼接,結果獲得了1個全長為1 721 bp的cDNA序列。在該 cDNA序列兩端設計基因特異引物,進行PCR擴增、測序,得到1個大小為1 698 bp的cDNA片段,將此 1 698 bp片段與目的基因的cDNA拼接序列進行比對分析,分析結果顯示兩序列一致,這表明天山雪蓮3GT基因cDNA拼接序列正確。天山雪蓮3GT基因全長含有1 548 bp的開放閱讀框,其 5′含有起始密碼子ATG,3′端含有137 bp的非編碼區,這表明天山雪蓮3GT基因的cDNA序列完整,獲得GenBank登錄號 (Accession No. JN092127)。
2.3 天山雪蓮3GT氨基酸序列分析
根據天山雪蓮3GT基因cDNA全長序列推測其編碼516個氨基酸殘基。以來自不同物種的5種類黃酮-3-O-葡萄糖基轉移酶氨基酸序列進行序列比對分析,推測天山雪蓮類黃酮-3-O-葡萄糖基轉移酶含有一個由 44個氨基酸殘基構成的糖基轉移酶的保守域PSPG[13],如圖2中劃線部分,該保守序列被認為是結合糖基供體的區域。這表明,從天山雪蓮中克隆得到的基因3GT具有類黃酮-3-O-葡萄糖基轉移酶基因家族所具有的序列特征,進一步證明其為類黃酮-3-O-葡萄糖基轉移酶基因。
2.4 天山雪蓮3GT系統進化樹分析
天山雪蓮類黃酮-3-O-葡萄糖基轉移酶與其他植物的 GT氨基酸序列的系統進化分析表明(圖 3),不同物種的類黃酮-3-O-葡萄糖基轉移酶聚為一類,天山雪蓮類黃酮-3-O-葡萄糖基轉移酶與毛楊梅的3GT基因及草莓的GT6親緣關系較近,Griesser等[14]運用原核表達,在體外獲得草莓 GT6表達的蛋白,對該蛋白的分析表明,該蛋白參與類黃酮的糖基化。

圖2 天山雪蓮和其他物種3GT氨基酸序列比對分析Fig. 2 Muti-sequence alignment of UDP-glucosyltranserases proteinases from Saussurea involucrata and other organisms. Q40284: Manihot esculenta Anthocyanidin 3-O-glucosyltransferase; ABB92748: Fragaria x ananassa GT6; AAD21086: Forsythia x intermedia 3GT. The identical and positive amino acid resdues are denmed with “﹡” and “∶”.
2.5 天山雪蓮3GT基因的轉錄模式分析
根據利用 3GT基因的保守引物擴增不同組織中的基因cDNA片段。從圖4中可以看出,天山雪蓮 3GT基因在葉和愈傷組織中的表達量比較高,在根中僅有少量的表達,在莖中幾乎不表達。
2.6 天山雪蓮3GT基因的表達載體構建及農桿菌轉化
重組質粒構建 (圖5),挑取大腸桿菌中的單菌落用 BglⅡ和 NheⅠ雙酶切重組質粒,得到預期大小1 808 bp的片段,并用3GT基因特異引物進行PCR檢測得到預期1 808 bp的片段。經電擊轉化的農桿菌轉化子的篩選與大腸桿菌重組子的篩選相同,均得到預期大小的片段。

圖4 天山雪蓮3GT基因在不同組織中的轉錄模式Fig. 4 Transcriptional pattern analysis of 3GT in different organs of S. involucrata. Transcripts were amplified using gene specific primers, with the PCR products separated using 1% agarose gel. Equal cycles for PCR reaction, different loadings for the different samples. L: leaf; C: callus; S: stem; R: root.
2.7 天山雪蓮轉3GT基因愈傷組織的篩選
經農桿菌侵染的雪蓮葉片共150片,轉入含有潮霉素的轉基因愈傷組織篩選培養基內培養20 d后開始出愈,經45 d培養后,運用CTAB法提取雪蓮愈傷組織的總 DNA。由于該遺傳轉化為同源轉化,所以對轉化子的篩選采用抗性標記基因的PCR檢測,用潮霉素基因的特異引物進行轉化子的篩選,共檢測到 14個轉化子(圖6),該基因的轉化率為9.33%。
2.8 轉天山雪蓮 3GT基因的愈傷組織干重及總黃酮含量
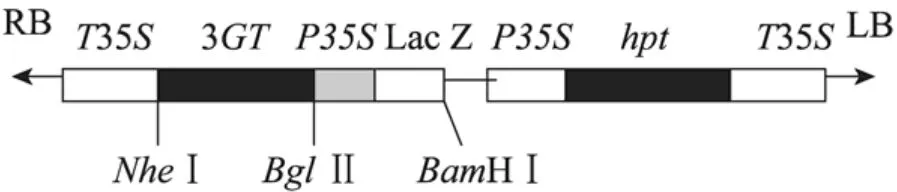
圖5 3GT表達載體的構建Fig. 5 Plasmid used in transformation of 3GT transgeneic. P35S: CaMV 35S promoter; T35S: CaMV 35S terminator; 3GT: S. involucrata UDP-glucose gene; hpt: hygromycin phosphotransferase gene.
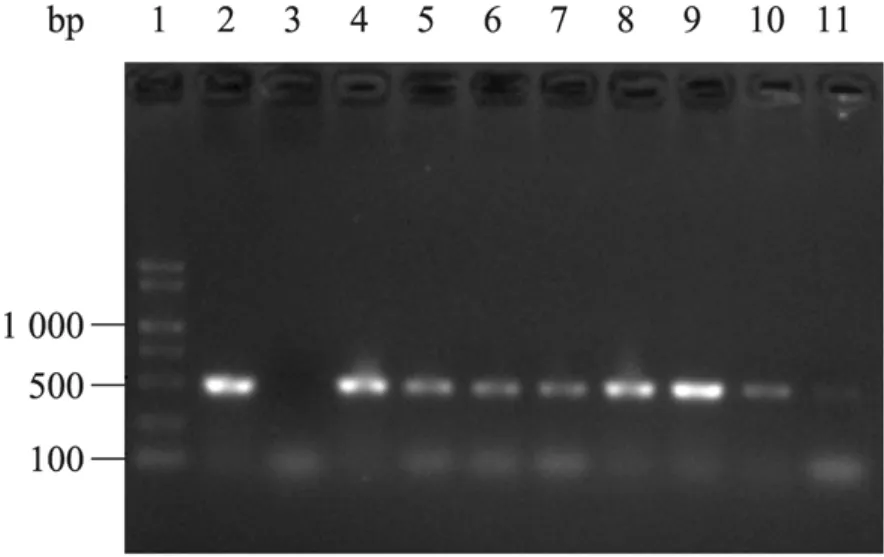
圖6 3GT基因轉基因愈傷組織的檢測Fig. 6 PCR analysis of transgenes in S. involucrata callus, hpt gene. 1: DNA marker; 2: positive control; 3: negative control; 4?11: S. involucrata callus PCR.

圖7 懸浮培養雪蓮愈傷組織干重及總黃酮含量Fig. 7 Dry weight and flavonoid content in S. involucrata callus after suspension culture. (A) The control of the S. involucrata callus. (B) 3GT gene transformated of S. involucrata callus.
取其中3個轉化子進行雪蓮愈傷組織的懸浮培養,分別測量其在4、8、12、16 d的平均干重及總黃酮含量的變化如圖7所示,隨著懸浮培養時間的增加,雪蓮愈傷組織的干重和總黃酮含量不斷增加,在第 12天左右干重及總黃酮含量的增加幅度開始變小 (圖7);其中轉基因愈傷組織的總黃酮含量是非轉基因愈傷組織總黃酮含量平均值的2.06倍。
3 討論
盡管花青素代謝途徑中的多個結構基因已經從水母雪蓮中分離出來[15-17],但是國內外未見報道天山雪蓮中花青素代謝途徑的關鍵酶基因3GT的研究,該文首次從天山雪蓮中克隆得到3GT基因。本研究通過同源克隆的方法從天山雪蓮葉片中分離得到3GT基因全長序列,根據推測的蛋白質序列分析基因的功能,運用同源轉化的方法驗證了轉基因雪蓮愈傷組織中的總黃酮含量比對照有顯著提高,這一結果與王慶菊等[18]在對紫葉稠李葉片和張劍亮等[19]在向日葵的研究 3GT基因的過表達能夠顯著提高植物中黃酮類物質的積累這一研究結果一致。
近幾年國內外研究學者對糖苷代謝的研究不斷深入。花青素糖基轉移酶 (GT) 對于植物花色和花青素的穩定性及可溶性很重要,是因為其決定了糖基化的位置。植物的次生代謝過程中糖基轉移酶具有很嚴格的糖附屬物的選擇性[20]。多數花青素的糖基化是通過葡萄糖轉移酶類的3GT實現的。目前研究報道的植物GTs多為將底物通過 C-或者 N-糖基化形成穩定的代謝產物。天山雪蓮的3GT與其他物種的3GT在C端具有相似性,能夠識別相同或相似的受體,而N端的相似性遠遠低于C端,說明天山雪蓮花青素的糖基化可能主要為C-糖基化。天山雪蓮3GT和各種植物糖基轉移酶的進化樹表明,天山雪蓮3GT與不同物種的 3GT親緣關系較近,與毛楊梅的3GT相似性較高。
3GT基因的表達具有品種和時間特異性,3GT基因僅在紅皮葡萄品種Vitis vinifera中表達[21],在龍膽Gentiana triflora中,只能在花瓣中檢測到3GT基因的表達,在白色花中很少表達[22]。當 3GT基因被抑制表達時,組織培養的葡萄細胞中花色苷的含量明顯降低[23]。天山雪蓮3GT基因在葉及愈傷組織中表達量最高,在根中表達量較少,在莖中幾乎不表達,對該方面具體機理還有待進一步研究。
目前,在GTs家族中還有95%的基因及蛋白還不知道其功能和特征,這就為研究學者們提出了極大的挑戰。對天山雪蓮3GT基因功能的初步研究中,轉基因愈傷組織中總黃酮的含量較野生天山雪蓮總苞高2.47倍,天山雪蓮3GT是雪蓮黃酮代謝途徑中的一個關鍵酶,能夠促進黃酮類物質在天山雪蓮細胞內的積累,這與前人的研究結果一致,因此,該基因在雪蓮總黃酮合成過程中起著重要的作用。運用基因工程手段將天山雪蓮自身的 3GT基因轉化進入天山雪蓮愈傷組織中能夠提高天山雪蓮總黃酮的合成能力,這將為今后對實現天山雪蓮黃酮類物質的人工合成方面的研究奠定基礎,是解決天山雪蓮資源匱乏的有效方法之一。
[1] Parr AJ, Bolwell GP. Phenols in the plant and in man. The potential for possible nutritional enhancement of the diet by modifying the phenols content or profile. J Sci Food Agric, 2000, 80(7): 985?1012.
[2] Castellarin SD, Matthews MA, Gaspero GD, et al. Water deficits accelerate ripening and induce changes in gene expression regulating flavonoid biosynthesis in grape berries. Planta, 2007, 227(1): 101?112.
[3] Kho KFF, Kamsteeg J, Brederode JV. Identification, properties and genetic control of UDG-glucose cyandin-3-O-glucosyltransferase in Petunia hybrida. Z Pflanzen Physiol, 1978, 88: 449?464.
[4] Fedoroff NV, Furtek DB, Nelson OE Jr. Cloning of the bronze locus in maize by a simple and generalizable procedure using the transposable controlling element Activator (Ac). Proc Natl Acad Sci USA, 1984, 81(12): 3825?3829.
[5] Gerats AGM, Wallroth M, Donker-Koopman W, et al. The genetic control of the enzyme UDP-glucose: 3-0-flavonoid-glucosyltransferase in flowers of Petunia hybrida. Theor Appl Genet, 1983, 65(4): 349?352.
[6] Qi XL, Jiang SG, Lü XF, et al. Effects of phytohormones on plant regeneration and production of flavonoids in transgenic Saussurea involucrata hairy roots. Chin J Biotech, 2011, 27(1): 69?75.喬獻麗, 蔣曙光, 呂曉芬, 等. 激素對轉基因雪蓮毛狀跟植株再生及類黃酮產生的影響. 生物工程學報, 2011, 27(1): 69?75.
[7] Qiu J, Xue XF, Chen FD, et al. Quality evaluation of snow lotus (Saussurea): quantitative chemical analysis and antioxidant activity assessment. Plant Cell Rep, 2010, 29(12): 1325?1337.
[8] Pang HX, Zhu CQ, Qin JB. Effects of different temperature, culture media and osmotic potentials on seeds germination of Saussurea involucrate. Seed, 2009, 28(10): 76?79.龐紅霞, 祝長青, 覃建兵. 溫度、培養基成分和滲透勢對新疆雪蓮種子萌發的影響. 種子, 2009, 28(10): 76?79.
[9] Guan YY, Ren GD, Guo XY, et al. Establishment of agrobacterium-mediated transformation system in Saussurea involucrata. Acta Agric Bor-Occident Sin, 2010, 19(7): 84?88.管巖巖, 任國棟, 郭新勇, 等. 天山雪蓮遺傳轉化體系建立. 西北林業學報, 2010, 19(7): 84?88.
[10] Cheng LM, Cao QF, Huang J, et al. Establishment of highly-efficient genetic trasformation system in Cichorium intybus. Acta Pratacul Sin, 2004, 13(6): 112?116.程林梅, 曹秋芬, 黃靜, 等. 菊苣高效遺傳轉化體系的建立. 草業學報, 2004, 13(6): 112?116.
[11] Tang YP, Qin JB, Yuan H. Study on the sensitivity of Saussurea involucrate to hygromycin during tissue culture. Seed, 2011, 30(9): 11?13.唐亞萍, 覃建兵, 原慧. 雪蓮組培過程對潮霉素敏感性的研究. 種子, 2011, 30(9): 11?13.
[12] Wu LQ, Guo SX, Xiao PG. Cell suspension culture and flavonoids production in Saussurea involucrate. Chin J Chin Mater Med, 2007, 30(13): 965?968.武利勤, 郭順星, 肖培根. 新疆雪蓮細胞懸浮系的建立和黃酮類活性成分的產生. 中國中藥雜志, 2007, 30(13): 965?968.
[13] Hughes J, Hughes MA. Multiple secondary plant product UDP-glucose glucosyltransferase genes expressed in cassava (Manihot esculenta Crantz) cotyledons. Mitochondrial DNA, 1994, 5(1): 41?49.
[14] Griesser M, Vitzthum F, Fink B, et al. Multi-substrate flavonol O-glucosyltransferases from strawberry (Fragaria×ananassa) achene and receptacle. J Exp Bot, 2008, 59(10): 2611?2625.
[15] Jin ZP, Grotewold E, Qu WQ, et al. Cloning and characterization of a flavanone 3-hydroxylase gene from Saussurea medusa. DNA Seq, 2005, 16(2): 121?129.
[16] Li FX, Jin ZP, Qu WQ, et al. Cloning of a cDNA encoding the Saussurea medusa chalcone isomerase and its expression in transgenic tobacco. Plant Physiol Biochem, 2006, 44(7/9): 455?461.
[17] Cheng LQ, Xu YJ, Grotewold E, et al. Characterization of anthocyanidin synthase (ANS) gene and anthocyanidin in rare medicinal plant-Saussurea medusa. Plant Cell Tiss Organ Cult, 2007, 89(1): 63?73.
[18] Wang QJ, Li XL, Wang L, et al. Dynamic changes of anthocyanin and the relevant biosynthesis enzymes in Padus virginiana ‘Schubert’ leaves. Sci Sil Sin, 2008, 44(3): 45?49.王慶菊, 李曉磊, 王磊, 等. 紫葉稠李葉片花色苷及其合成相關酶動態. 林業科學, 2008, 44(3): 45?49.
[19] Zhang JL, Pan DR, Zhou YF, et al. Cloning and expression of genes involved in anthocyanins synthesis in Ornamental sunflower. Acta Hortic Sin, 2009, 36(1): 73?80.張劍亮, 潘大仁, 周以飛, 等. 觀賞向日葵花青素苷合成途徑同源基因的克隆與表達. 園藝學報, 2009, 36(1): 73?80.
[20] Kramer CM, Prata RTN, Willits MG, et al. Cloning and regiospecificity studies of two flavonoid glucosyltransferases from Allium cepa. Phytochemistry, 2003, 64(6): 1069?1076.
[21] Kobayashi S, Ishimaru M, Ding CK, et a1. Comparison of UDP-glucose: flavonoid 3-O-glucosyltransferase (UFGT) gene sequences between white grapes (Vitis vinifera) and their sports with red skin. Plant Sci, 2001, 160(3): 543?550.
[22] Nakatsuka T, Nishihara M, Mishiba K, et a1. Two different mutations are involved in the formation of white-flowered gentian plants. Plant Sci, 2005, 169(5): 949?958.
[23] Afifi M, El-kdreamy A, Legrand V, et a1. Control of anthocyanin biosynthesis pathway gene expression by eutypine, a toxin from Eutypa lata, in grape cell tissue cultures. J Plant Physiol, 2003, 160(8): 971?975.