定量研究菲啶對酵母朊病毒[PSI+]的治愈作用
鐘正偉,王莉潔,謝輝,李輝,3,何劍為,3,宋有濤,3
1 遼寧大學生命科學院,遼寧 沈陽 110036
2 承德石油高等專科學校化學工程系,河北 承德 067000
3 遼寧省動物資源與疫病防治重點實驗室,遼寧 沈陽 110036
朊病毒是一類能在哺乳動物中引起瘋牛病、綿羊瘙癢癥和人克雅氏病等可傳染性海綿樣腦病的病原體,迄今為止對于朊病毒疾病仍缺乏有效的治療藥物[1-2]。近年來,利用抗朊病毒藥物篩選模型篩選抗朊病毒候選藥物是國際上的研究熱點,研究者通過構建動物模型、動物細胞模型、無細胞模型和酵母模型在抗朊病毒候選藥物的篩選方面進行了大量研究,獲得了戊聚糖多硫酸酯、剛果紅、四磺酸基酞菁、兩性霉素B和奎納克林等一系列具有抗朊病毒作用效果的候選藥物[3-9]。
由于酵母朊病毒[PSI+]具有易于檢測的遺傳表型 (紅色為正常型,白色為致病型) 及其與動物具有嚴格種間屏障的優勢,因此基于酵母細胞的抗朊病毒候選藥物篩選模型在大規模篩選上具有經濟、安全和易實現高通量篩選等特性而越來越受到關注[5-10]。利用酵母朊病毒的遺傳表型并結合蛋白水平的 SDS-PAGE/Western blotting分析,Bach等從近4 000種小分子化合物中篩選發現了菲啶 (Phenanthridine,Phen)、6-氨基菲啶(6-Aminophenanthridine) 等 11種化合物可以使酵母朊病毒的致病型白色表型轉換為正常型紅色表型,同時其淀粉樣聚集狀態可以轉換為可溶單體狀態[5]。值得注意的是,菲啶衍生物6-氨基菲啶作用酵母朊病毒[PSI+]后產生了93%的介于紅色的陽性表型與白色的陰性表型之間的粉色中間表型,該表型的朊病毒仍為聚集狀態,并在傳代實驗中遺傳不穩定,多次傳代后轉變為白色表型[5]。而在此前的研究中,鹽酸胍等化合物雖然能夠治愈[PSI+]卻不能引起酵母細胞粉色表型的出現[11]。
近年來的研究表明,朊病毒聚集體的大小較聚集狀態更能夠反映朊病毒“種子”(Seeds) 的聚集和傳播能力[12-14]。這暗示著在蛋白和細胞水平對朊病毒聚集體大小的定量分析可以更準確地評價抗朊病毒候選藥物的作用效果,尤其是對粉色中間表型而言。因此,本研究利用本實驗室構建的新型抗朊病毒藥物篩選酵母模型,即基因重組的熒光標簽 GFP插入 Sup35 (NGMC) 的[GPSI+]酵母菌株,引入熒光漂白后恢復技術(Fluorescence redistribution after photobleaching,FRAP) 和半變性瓊脂糖凝膠電泳 (Semidenaturing detergent-agarose gel electrophoresis,SDD-AGE) 技術分別在細胞水平和蛋白水平定量分析了菲啶作用后酵母細胞內朊病毒聚集體的大小變化[15-17]。另外,本研究還系統研究了菲啶作用后產生的粉色表型酵母中朊病毒的聚集狀態。這些實驗結果彌補了Bach等對菲啶等化合物的抗酵母朊病毒效果缺乏細胞和蛋白水平定量分析的缺陷。更重要的是,該研究成果為基于酵母模型的抗朊病毒藥物次級篩選也提供了一套精確的定量方法。
1 材料與方法
1.1 材料
1.1.1 菌株
野生型酵母 779-6A (NMC):MATα kar1 SUQ5 ade2-1 his3Δ202 leu2Δ1 trp1Δ63 ura3-52 sup35:: KanMX/ pJ501,[PSI+],由美國國立衛生院 (NIH) Masison DC. 博士惠贈。重組型酵母(NGMC):MATα kar1 SUQ5 ade2-1 his3Δ202 leu2Δ1 trp1Δ63 ura3-52 sup35 :: KanMX/pJ510,[GPSI+],GFP基因插入SUP35基因的第123~124位之間,由本實驗室構建。將[PSI+]或[GPSI+]細胞劃線至含有5 mmol/L鹽酸胍的1/2YPD固體平板上,培養7 d后,分離紅色單菌落得到[psi-]或[Gpsi-]細胞。
1.1.2 培養基
1/2YPD培養基:酵母浸粉0.5%,蛋白胨2%,葡萄糖2%,固體平板加入2%瓊脂。
YPAD培養基:酵母浸粉1%,蛋白胨2%,葡萄糖2%,腺嘌呤0.04%,固體平板加入2%瓊脂。
YPD培養基:酵母浸粉1%,蛋白胨2%,葡萄糖2%,固體平板加入2%瓊脂。
1.1.3 主要試劑和儀器
鹽酸胍、菲啶、刀豆球蛋白購于Sigma公司,兔抗GFP抗體與HRP標記的羊抗兔IgG購于金斯特生物科技有限公司,其他試劑均為國產分析純。瓊脂糖水平電泳槽 (DYCO-31DN,北京六一公司)、轉膜儀 (Bio-Rad公司,美國)、珠磨破碎儀 (Biospec公司,美國)、激光共聚焦顯微鏡(OLYMPUS FV1000S-SIM/IX81,中國醫科大學實驗中心)。
1.2 方法
1.2.1 遺傳表型實驗
[PSI+]和[GPSI+]酵母細胞在 30 ℃過夜活化培養后,調整菌液OD600至0.2左右,按10%接種量分別接種到含有指定化合物的1/2YPD液體培養體系,所有體系于24 ℃振蕩培養5 d,在培養時間內間隔24 h更換培養基和化合物[5]。每天取培養液稀釋后涂布于1/2YPD固體平板,平板于24 ℃培養7 d,觀察菌落顏色變化,統計不同顏色菌落的比例。
1.2.2 熒光焦點 (Foci) 和FRAP實驗
將化合物作用[GPSI+]酵母細胞1~5 d后涂布培養的1/2YPD固體平板上出現的不同顏色菌落接種到YPAD液體培養基中30 ℃培養2 d后,取少量菌液滴在干燥的覆蓋有2 g/L刀豆球蛋白溶液的潔凈載玻片上,加蓋玻片并封片,在100倍共聚焦熒光顯微鏡 (OLYMPUS-FV1000型)下觀察朊病毒在酵母活細胞內形成熒光焦點的情況。隨后利用熒光漂白后恢復技術在活細胞中分析酵母朊病毒聚集體的遷移速率。FRAP技術的原理是采用強激光在短時間內將熒光分子漂白區域的熒光淬滅,由于活細胞內分子處于流動狀態,因此隨著漂白區域外的熒光分子逐漸流入,漂白區內的熒光會逐漸恢復。通過測定漂白區域熒光恢復的速率可以獲得熒光分子遷移速率的相關信息[16,18]。FRAP實驗參考文獻的方法并作適當修正[16],激發波長為 488 nm,輸出功率為最大輸出功率的2%,針孔調整為3 μm,物鏡為40 倍,掃描整個樣品,選取漂白區 (ROI),漂白功率為100%,漂白程度為50%~80%,漂白后采集數據時間間隔設定為0.5 s,采集次數為40~50 次,漂白結束后,保存數據。按照公式FR(t)=(Ft?Fmin)/(Fi?Fmin) 計算相對熒光強度,其中Ft表示細胞漂白區在t時間的熒光強度,Fi表示t=0時間的熒光強度,Fmin表示細胞漂白后的最小熒光強度,FR(t)表示t時間細胞的相對熒光強度。以FR(t)VS t作圖得到熒光漂白后恢復曲線。
1.2.3 SDD-AGE/Western blotting實驗
將化合物作用[GPSI+]酵母細胞1~5 d后涂布培養的1/2YPD固體平板上出現的不同顏色菌落活化后接種到 YPD液體培養基中 30 ℃培養約12 h,到菌液 OD600=1.5左右時停止培養,離心收集細胞,然后加入裂解緩沖液,用珠磨儀裂解細胞,離心收集上清得到蛋白樣品;SDD-AGE/ Western blotting實驗流程參考文獻的方法并作適當調整[17],進行1.5%的瓊脂糖凝膠電泳,電泳結束后在0 ℃、100 V條件下轉膜1 h,將蛋白轉移到PVDF膜上,兔抗-GFP抗原 (1∶2 000) 孵育1 h,4 ℃過夜,HRP標記的羊抗兔IgG (1∶5 000)孵育1 h,采用ECL發光試劑盒對其進行放射自顯影檢測,獲得圖像信息。
2 結果與分析
2.1 菲啶對酵母朊病毒[PSI+]表型的影響
酵母朊病毒[PSI+]是翻譯終止因子 Sup35p的淀粉樣聚集形式[19]。在[PSI+]細胞中,Sup35p主要以聚集體形式存在導致無義突變抑制產生終止密碼子通讀現象,使ade2-1突變的[PSI+]細胞在腺嘌呤缺乏的培養基上生長為白色菌落;在被治愈的[psi-]細胞中,其Sup35p主要以可溶形式存在,非無義抑制的ade2-1突變株需要在含有腺嘌呤的培養基上生長,細胞由于累積腺嘌呤合成途徑中的紅色中間產物而形成紅色菌落,這個顏色指示系統可用來初步分析酵母朊病毒的存在狀態[13]。鑒于在Bach的研究中,菲啶治愈野生型酵母朊病毒必須存在增效劑亞治愈濃度的鹽酸胍 (0.5 mmol/L,在此濃度下鹽酸胍可以通過部分競爭性抑制 Hsp104的活性削弱[PSI+]的強度而不改變[PSI+]的性質)[5],為此我們在0.5 mmol/L鹽酸胍條件下研究菲啶對酵母朊病毒的治愈作用。如表1所示,陰性對照0.5 mmol/L鹽酸胍和陽性對照5 mmol/L鹽酸胍對酵母朊病毒[GPSI+]的5 d治愈率分別為0%和94.8%,而0.2 mmol/L菲啶在增效劑存在情況下治愈率為84.6%,與相同條件下菲啶和鹽酸胍對野生型[PSI+]的治愈率基本相似并略高。這暗示著在基于酵母的抗朊病毒藥物篩選過程中,可以用酵母朊病毒NGMC菌株代替野生型酵母朊病毒NMC菌株。

表1 酵母朊病毒[GPSI+]與[PSI+]對抗朊病毒化合物的敏感性比較Table 1 Comparison of the sensitivities to anti-prion compounds between yeast prions [GPSI+] and [PSI+]
為了深入研究菲啶對酵母朊病毒的治愈作用,我們統計了0.2 mmol/L菲啶作用于酵母菌株NGMC不同時間后的表型分布。如圖1所示,陽性對照5 mmol/L鹽酸胍作用于白色的[GPSI+]細胞2 d后紅色菌落逐漸增多,作用5 d后幾乎全為紅色菌落;0.2 mmol/L菲啶作用于[GPSI+]細胞3 d天后出現紅色菌落,作用5 d后紅色菌落的比例為84.6%,而且在菲啶作用[GPSI+]細胞1~5 d內均出現了一定數量的粉色菌落,這與Bach的研究發現基本一致[5]。從表型上看,菲啶作用后的紅色菌落初步被認為是治愈的[Gpsi-],白色菌落為未治愈的[GPSI+],粉色菌落可能是一種中間表型,但其細胞內的朊病毒是否聚集或聚集體的大小需要進一步的定量分析。
2.2 細胞水平菲啶對酵母朊病毒[GPSI+]治愈作用的定量分析

圖1 酵母朊病毒[GPSI+]在菲啶作用不同時間后的表型變化Fig. 1 Phenotype changes of [GPSI+] cells after treated by phenanthridine synergized with 0.5 mmol/L GuHCl for 1?5 days. W, P, R represent white, pink and red colonies, respectively.
插入GFP熒光標簽的[GPSI+]酵母細胞的朊病毒 (NGMC) 由于聚集而呈現明亮的熒光焦點(Foci),而[Gpsi-]細胞朊病毒是可溶的,因而其熒光呈發散狀態。如圖2A所示,0.2 mmol/L菲啶與0.5 mmol/L鹽酸胍協同作用酵母朊病毒1 d、3 d、5 d后的白色菌落呈現明亮的熒光焦點,說明其朊病毒為聚集狀態,而3 d、5 d后的紅色菌落其熒光呈發散狀態,說明其朊病毒為可溶狀態。另外,對照5 mmol/L鹽酸胍作用酵母朊病毒[GPSI+]后白色和紅色菌落的Foci實驗觀察結果與菲啶基本一致。為了進一步定量化紅色和白色菌落酵母細胞中朊病毒的聚集狀態,我們采用了更為精確的熒光漂白后恢復技術 (FRAP) 檢測菲啶作用后[GPSI+]細胞中朊病毒NGMC的聚集體大小。如圖2B所示,[Gpsi-]細胞的NGMC被漂白后,相對熒光強度迅速上升,大約6 s后趨于平穩,說明[Gpsi-]細胞的 NGMC流動速率快,分子量小;而[GPSI+]細胞的NGMC被漂白后,相對熒光強度升高緩慢,而且在20 s內一直呈上升趨勢,說明其NGMC流動速率慢,分子量大。菲啶作用[GPSI+]細胞1 d、3 d后的白色菌落的熒光蛋白光漂白恢復曲線趨勢與對照的[GPSI+]細胞類似,而且在20 s內達到的最大相對熒光強度值無顯著差異,表明菲啶作用[GPSI+]細胞 1 d、3 d后形成的白色菌落內與對照的[GPSI+]細胞相比較具有大小相當的NGMC聚集體,這說明菲啶作用1 d、3 d后的白色菌落是沒有被治愈的[GPSI+]。另一方面,菲啶作用[GPSI+]細胞后3 d、5 d后的紅色菌落的NGMC分子量大小與[Gpsi-]細胞的 NGMC分子量大小基本相同,說明這些菌落為被菲啶治愈的[Gpsi-]細胞。值得注意的是,菲啶作用[GPSI+]細胞5 d后的白色菌落的NGMC分子量略小于[GPSI+]細胞,但其朊病毒NGMC仍為聚集狀態 (圖2A),說明其雖然為[GPSI+]細胞,但其朊病毒聚集體可能發生了輕微的解聚。
2.3 蛋白水平菲啶對酵母朊病毒[GPSI+]治愈作用的定量分析

圖2 熒光焦點法和熒光漂白后恢復法定量分析菲啶對酵母朊病毒[GPSI+]的治愈作用Fig. 2 Quantitative analysis of curing effects of phenanthridine on yeast prion [GPSI+] cells with fluorescence foci and FRAP assays. W, R represent white and red phenotype cells respectively. (A) Fluorescence foci assay. (B) Fluorescence redistribution after photobleaching.
為了更為全面地分析菲啶對酵母朊病毒的作用效果,我們在蛋白水平利用半變性瓊脂糖凝膠電泳 (SDD-AGE) 結合 Western blotting技術分析化合物作用后[GPSI+]細胞內的朊病毒NGMC聚集體大小。傳統的SDS-PAGE只能定性檢測朊病毒能否發生聚集,而SDD-AGE利用NGMC聚集體大小。傳統的SDS-PAGE只能定性檢測朊病毒能否發生聚集,而SDD-AGE利用瓊脂糖凝膠的疏松網狀結構及朊病毒聚集體獨具的 SDS抗性的特點,可以檢測朊病毒聚集體的大小[12,17]。如圖3所示,[GPSI+]細胞的朊病毒NGMC主要以大分子聚集體形式存在,少量的以可溶的小分子單體形式存在,而[Gpsi-]細胞的朊病毒NGMC以可溶的小分子單體形式存在。菲啶作用[GPSI+]細胞1 d、3 d后的白色菌落的NGMC分子量與[GPSI+]細胞的基本相似 (圖 3A),說明這些白色菌落是沒有被治愈的[GPSI+];菲啶作用3 d、5 d后的紅色菌落的NGMC以單體形式存在,與[Gpsi-]細胞內 NGMC大小基本相同(圖3A),說明這些菌落已為治愈的[Gpsi-]細胞。另一方面,菲啶作用后5 d的白色菌落的NGMC仍主要為聚集狀態,但分子量較大的NGMC聚集體發生了微弱的解聚,并且可溶的NGMC量比[GPSI+]細胞有少量的增加 (圖3A),這與前面FRAP實驗所示結果也是一致的 (圖2B)。此外,對比圖3A和3B發現,鹽酸胍作用[GPSI+]細胞后形成的紅、白菌落中NGMC大小的變化與菲啶作用后的結果是基本一致的。

圖3 SDD-AGE/Western blotting定量分析菲啶對酵母朊病毒[GPSI+]的治愈作用Fig. 3 Quantitative analysis of curing effects of phenanthridine on yeast prion [GPSI+] cells with SDD-AGE/Western blotting. The migration of molecular size standards (in kilodaltons) is shown on the left. W, R represent white and red phenotype cells, respectively. (A) Phenanthridine. (B) Guanidine hydrochloride.
2.4 菲啶作用后形成粉色中間表型酵母細胞中朊病毒聚集狀態的定量分析
綜上所述,細胞和蛋白水平的定量分析結果顯示,菲啶作用[GPSI+]酵母細胞1 d、3 d、5 d后的白色菌落為非治愈狀態的[GPSI+]細胞,而3 d、5 d后的紅色菌落為被治愈的[Gpsi-]細胞。利用相同的定量研究方法,我們進一步分析了菲啶作用后形成的粉色中間表型酵母細胞中朊病毒NGMC的聚集狀態。如圖4A所示,熒光焦點實驗分析發現菲啶作用[GPSI+]細胞1 d、2 d后的粉色菌落中的NGMC呈聚集狀態,3 d、4 d、5 d后的粉色菌落中的NGMC呈可溶狀態。FRAP結果顯示菲啶作用[GPSI+]細胞5 d后的粉色菌落的NGMC大小與[Gpsi-]細胞的NGMC大小相當,1 d后的粉色菌落的NGMC大小與[GPSI+]細胞的NGMC大小相似,而2 d、3 d、4 d后的粉色菌落的NGMC大小介于兩種對照細胞之間 (圖4B)。另一方面,SDD-AGE/Western blotting結果表明菲啶作用[GPSI+]細胞3 d、4 d、5 d后的粉色菌落的NGMC主要以單體形式存在;而1 d后的粉色菌落的NGMC主要以聚集體形式存在,與[GPSI+]細胞的朊病毒聚集體大小相似;2 d后的粉色菌落的NGMC同樣主要以聚集體形式存在,但其分子量略低于[GPSI+]細胞中的NGMC聚集體,并且可溶的單體NGMC含量明顯增多 (圖 4C),這與 FRAP的結果是基本一致的。
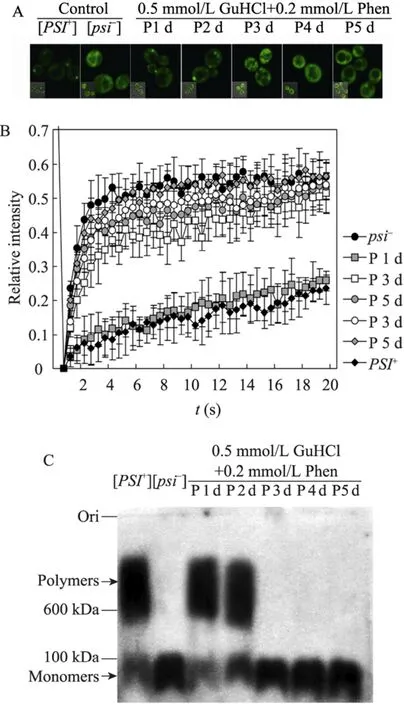
圖4 細胞和蛋白水平定量分析菲啶作用酵母朊病毒[GPSI+]后粉色表型的朊病毒聚集狀態Fig. 4 Quantitative analysis of the aggregation status of Sup35p in phenanthridine induced pink (P) phenotype cells at the cellular and protein levels. (A) Fluorescence foci. (B) Fluorescene redistribution after photobleaching. (C) SDD-AGE/Western blotting.
3 討論
我們前期研究結果顯示,5 mmol/L鹽酸胍對[GPSI+] (NGMC) 菌株的表型治愈效果與 Bach等使用的野生型酵母[PSI+] (NMC) 菌株的效果是相似的[20]。本研究進一步發現抗朊病毒化合物菲啶對酵母朊病毒[GPSI+]的表型治愈作用類似于野生型酵母[PSI+]菌株 (NMC),這暗示著可以用酵母朊病毒[GPSI+]菌株替代野生型[PSI+]菌株以便利用新的方法實現細胞及蛋白蛋白水平的定量分析。另外,Bach等研究發現,菲啶單獨存在只能治愈藥物敏感型酵母朊病毒菌株([PSI+]的強度較弱) 而不能治愈野生型菌株[5]。而藥物敏感型菌株生長非常緩慢,難于進行細胞及蛋白水平的定量研究。為此,我們借鑒了Bach等提出的使用增效劑鹽酸胍的方法提高本實驗體系中[GPSI+]菌株對藥物的靈敏度[5]。
借助本實驗室構建獨有的酵母朊病毒[GPSI+]細胞模型,我們采用 SDD-AGE/Western blotting技術和 FRAP技術在蛋白和細胞水平定量分析了菲啶對酵母朊病毒的治愈作用,從而彌補了此前研究對菲啶的抗酵母朊病毒效果缺乏蛋白和細胞水平定量分析的不足和對粉色表型沒有精確定量分析的缺陷。研究結果表明,菲啶作用酵母朊病毒[GPSI+]細胞1 d、2 d后出現的粉色菌落中朊病毒的聚集狀態與[GPSI+]相似,而3~5 d后出現的粉色菌落中朊病毒的狀態與[Gpsi-]相似,呈現出密切的時間相關性。結合前期研究中提出的酵母朊病毒的治愈是通過細胞分裂降低細胞質中朊病毒“種子”的假說[12-14],這暗示著菲啶完全治愈[PSI+]需要更多的細胞分裂周期。另外,值得注意的是,酵母朊病毒的顏色表型與其在細胞中的聚集狀態雖然總體上一致,但同時存在著細微的區別。這暗示著在統計菲啶對朊病毒的治愈率時,不能簡單地認為紅色菌落的比例代表了菲啶的治愈率,而應根據不同菌落的系統檢測結果來具體分析,因而菲啶作用酵母朊病毒[GPSI+] 1~5 d的治愈率分別為0%、0%、51.7%、87.5%和94.4% (圖1)。此外,本研究結果也顯示蛋白水平采用的 SDD-AGE/ Western blotting技術和細胞水平采用的FRAP技術在定量研究抗朊病毒候選藥物的作用效果的重要性和可行性,極大地豐富了Bach等提出的基于酵母細胞的抗朊病毒藥物篩選模型的次級篩選分析方法。
[1] Prusiner SB. Biology of prion diseases. J Acquir Immune Defic Syndr, 1993, 6(6): 663?665.
[2] Ghaemmaghami S, May BCH, Renslo AR, et al. Discovery of 2-aminothiazoles as potent antiprion compounds. J Virol, 2010, 84(7): 3408?3412.
[3] Sim VL, Caughey B. Recent advances in prion chemotherapeutics. Infect Disord Drug Targets, 2009, 9(1): 81?91.
[4] Trevitt CR, Collinge J. A systematic review of prion therapeutics in experimental models. Brain, 2006, 129(9): 2241?2265.
[5] Bach S, Talarek N, Andrieu T, et al. Isolation of drugs active against mammalian prions using a yeast-based screening assay. Nat Biotechnol, 2003, 21(9): 1075?1081.
[6] Bach S, Tribouillard D, Talarek N, et al. A yeast-based assay to isolate drugs active against mammalian prions. Methods, 2006, 39(1): 72?77.
[7] Tribouillard-Tanvier D, Béringue V, Desban N, et al. Antihypertensive drug guanabenz is active in vivo against both yeast and mammalian prions. PLoS One, 2008, 3(4): e1981.
[8] Zhong ZW, Song YT. Recent advances of research on Antiprion candidate drugs. Chin J Zoonoses, 2011, 27(9): 828?835.鐘正偉, 宋有濤. 朊病毒治療候選藥物的研究進展. 中國人獸共患病學報, 2011, 27(9): 828?835.
[9] Song YT, Wu XY, He XR. Development of the model for antiprion drug screening. J Liaoning Univ Nat Sci: Nat Sci Edi, 2009, 37(4): 289?293.宋有濤, 吳憲遠, 何星蓉. 抗朊病毒藥物篩選模型的研究進展. 遼寧大學學報: 自然科學版, 2009, 37(4): 289?293.
[10] Ishikawa T. Recent advances of research on the [PSI+] prion in Saccharomyces cerevisiae. Mycoscience, 2008, 49(4): 221?228.
[11] Tuite MF, Mundy CR, Cox BS. Agents that cause a high frequency of genetic change from [PSI+] to [psi-] in Saccharomy cescerevisiae. Genetics, 1981, 98(4): 691?711.
[12] Kryndushkin DS, Alexandrov IM, Ter-Avanesyan MD, et al. Yeast [PSI+] prion aggregates are formed by small Sup35 polymers fragmented by Hsp104. J Biol Chem, 2003, 278(49): 49636?49643.
[13] Song YT, Wu YX, Jung GM, et al. Role for Hsp70 chaperone in Saccharomyces cerevisiae prion seed replication. Eukaryot Cell, 2005, 4(2): 289?297.
[14] Song Y, Lan WJ, Wu XY, et al. Quantitative effects of magnesium chloride stress on aggregation of Sup35p in [psi-] yeast cells. Protein Pept Lett, 2010, 17(12): 1489?1494.
[15] Wu YX, Greene LE, Masison DC, et al. Curing of yeast [PSI+] prion by guanidine inactivation of Hsp104 does not require cell division. Proc Natl Acad Sci USA, 2005, 102(36): 12789?12794.
[16] Wu YX, Masison DC, Eisenberg E, et al. Application of photobleaching for measuring diffusion of prion proteins in cytosol of yeast cells. Methods, 2006, 39(1): 43?49.
[17] Halfmann R, Lindquist SL. Screening for amyloid aggregation by semi-denaturing detergent-agarose gel electrophoresis. J Vis Exp, 2008, 17(1): 1?4.
[18] Greene LE, Park YN, Masison DC, et al. Application of GFP-labeling to study prions in yeast. Protein Pept Lett, 2009, 16(6): 635?641.
[19] Wickner RB. [URE3] as an altered URE2 protein: evidence for a prion analog in Saccharomyces cerevisiae. Science, 1994, 264(5158): 566?569.
[20] Song YT, Song Y, Zhong ZW, et al. Illuminating precise quantification in yeast-based model for antiprion compounds screening. 2010 First International Conference on Cellular, Molecular Biology, Biophysics and Bioengineering. Qiqihar: Institute of Electrical and Electronics Engineers Press, 2010, 1: 296?299.