硬脂酰-輔酶A脫氫酶基因在食品級乳酸菌中的表達
王臘梅,李世麗,茍克勉,羅玉柱
1 甘肅農業大學動物科學技術學院,甘肅 蘭州 730070
2 中國農業大學生物學院 農業生物技術國家重點實驗室,北京 100193
硬脂酰-輔酶A脫氫酶 (Stearoyl-coenzyme A desaturase,SCD) 屬于?-9脫氫酶,位于內質網上,是一種膜結合蛋白。SCD是脂肪代謝過程中的關鍵酶,它催化飽和脂肪酰基輔酶A在Δ-9順式位置上脫氫,生成單不飽和脂肪酸,是脂肪酸脫氫反應的限速酶之一[1]。最早分離純化的SCD來自大鼠的肝[2]。此后,高山被孢霉M. alpine、釀酒酵母S. cervisiase、嗜熱四膜蟲Tetrahymena thermophila和莢膜組織胞漿菌 Histoplasma capsulatum 中也已分離得到了?-9脫氫酶[3-5]。SCD的主要功能是催化硬脂酰 CoA和軟脂酰CoA形成油酰CoA和棕櫚油酰CoA,生成的油酰CoA和棕櫚油酰CoA是細胞內合成甘油三酯、磷脂質和膽甾醇酯的主要來源。scd的表達還涉及對細胞增殖、細胞程序凋亡、衰老和脂質調解的細胞毒作用[6],同時,SCD也可影響膜流動性和SCD1的缺失導致身體脂肪的減少,增加胰島素的敏感性和抑制由飲食引起的肥胖[7-9]。提高scd1在骨骼肌的表達可引起脂質的不正常代謝和肥胖的加速[10]。SCD1缺失的小鼠在飲食中提供魚油可以防止動脈粥樣硬化的加速[11]。目前,scd1基因在動物模型實驗中,主要研究 scd1基因在脂質生成、肥胖和胰島素耐受性中的作用。scd基因敲除小鼠不易肥胖并且對胰島素有耐受性,以及脂質氧化的增加[6]。另外,在反芻動物瘤胃或乳腺組織中SCD可以通過其?-9脫氫酶的作用,將反式十八碳一烯酸(t11-C18∶1)轉化為c9,t11共軛亞油酸 (c9,t11-CLA)[12-13]。大鼠的scd1基因成功地在羊的乳腺細胞中得到表達[14];人的scd1基因轉入人胚腎293細胞過量表達把油酸轉化成c9t11-CLA[15]。
乳酸菌 (Lactic acid bacteria,LAB) 是一類在食品中應用最廣泛的重要工業菌株。它包括乳酸球菌、乳酸桿菌、雙歧桿菌等十幾個屬。這類菌種在防治食物腐敗、提高免疫力以及改善風味等方面有重要作用。目前,乳酸菌食品級高效表達系統的構建及應用則是該領域研究的前沿和熱點。食品級表達系統要求宿主菌、選擇標記基因和誘導物均為食品級,這為異源基因表達產物的直接應用提供了基礎[16]。在這些食品級的表達系統中乳鏈菌肽控制表達系統 (The nisin controlled expression,NICE) 是應用最廣泛的。該系統是可控制蛋白質生產的最理想的系統,同時具有良好的安全性,故可用于目的蛋白在乳酸菌中的高效表達。控制目的代謝物的生產,其工程菌及表達產物可直接制成口服制劑,可直接應用于食品、醫藥和保健品等領域[17]。
本文主要研究把 scd1基因轉入食品級的乳酸乳球菌表達系統,利用NICE控制scd1基因表達產生單不飽和脂肪,脂類中飽和脂肪酸與單不飽和脂肪酸的比例又往往影響著脂蛋白代謝、生物膜的流動性和信號傳導等,同時還與糖尿病、動脈粥樣硬化、癌癥、肥胖癥等多種疾病相關,因此,這些工程菌可直接用于食品工業,這對人類健康非常有益。
1 材料與方法
1.1 材料
Taq DNA聚合酶、dNTPs、Tris飽和酚、DNA限制性內切酶NcoⅠ和XbaⅠ及DNA標準分子量及預染蛋白標準分子量均購自寶生物工程(大連) 有限公司;普通瓊脂糖凝膠DNA回收試劑盒購自天根生化科技有限公司;M17培養基購自青島海博生物技術有限公司;引物合成和DNA測序分別由Invitrogen公司和北京六合華大基因科技股份有限公司完成;SDS、β-巰基乙醇、溶菌酶、考馬斯亮藍 G250、三氟化硼/甲醇(BF3/MeOH) 試劑和脂肪酸分析所用標準品Polyunsaturated Fatty Acid Mix No.2 購自Sigma/Aldrich公司。其余試劑均為國產分析純。
1.2 質粒、菌種和生長條件
含有人scd1的cDNA質粒pCAGGS-scd1由本實驗室保存。克隆和表達載體pNZ8149,基因克隆和表達宿主乳酸乳球菌NZ3900均購自北京拜爾迪生物技術有限公司,NZ3900是營養缺陷型菌株。食品級克隆和表達載體pNZ8149由Pnis啟動子控制表達,載體攜帶recC和recA復制子和原核生物表達所需的SD序列,以及食品級選擇標記基因lacF。
NZ3900培養在補加0.5%葡萄糖的M17培養基中,菌株在30 ℃、5% CO2的恒溫培養箱靜置培養。Elliker包含0.5%的乳糖、0.004%溴甲酚紫溶液用作乳糖利用表型 (lacF) 指示培養基[18],培養基中誘導表達劑 Nisin的濃度為50 mg/L。
1.3 PCR擴增目的基因
根據人 scd1基因的 cDNA序列 (GenBank Accession No. BC062303) 和表達載體pNZ8149的序列分析,用primer premier 5.0 設計SCD-F和SCD-R引物 (表1),向上游引物SCD-F引入NcoⅠ酶切位點,向下游引物SCD-R引入XbaⅠ酶切位點,分別用下劃線標出;SCD-F1和SCD-R1引物是在目的基因 scd1內部設計;pNZ8149-F和pNZ8149-R為菌落PCR的引物;pNZ8149-F1和pNZ8149-R1為測序引物。
酚-氯仿常規方法[19]提取質粒pCAGGS-scd1,并以其為模板進行PCR 擴增。PCR條件為:94 ℃4 min;94 ℃ 1 min ,55 ℃ 1 min,72 ℃ 90 s,30個循環;72 ℃ 10 min。PCR產物用1%的瓊脂糖凝膠電泳鑒定后進行回收和純化。
1.4 乳酸乳球菌表達載體的電擊轉化
pNZ8149用電擊轉化NZ3900,電擊條件:2.0 kV、25 μF、200 ?,使用2 mm的電轉杯,電擊時間是4.4 ms。用選擇培養基Elliker和菌落PCR選擇陽性菌落。提取陽性轉化子質粒,測序鑒定。
1.5 質粒DNA從乳酸乳球菌的分離
采用修改的堿變性法提取乳酸乳球菌的質粒pNZ8149。方法如下:5 mL培養菌液;12 000 r/min離心 2 min,收集菌液;菌液用250 μL THMS緩沖液 (30 mmol/L pH 8.0的Tris-HCl,3 mmol/L MgCl2,25%的蔗糖) 和2 g/L溶菌酶重懸,在37 ℃下孵育10 min;加500 μL0.2 mol/L NaOH 和 1%十二烷基硫酸鈉 (SDS)在冰上孵育5 min;加375 μL冰預冷pH 5.5的3 mol/L的乙酸鉀后冰上孵育5 min;離心5 min,吸取上層到新的離心管,離心管加滿異丙醇,在室溫孵育5~10 min;離心10 min,用70%乙醇洗DNA;離心2 min;棄上清,室溫下干燥DNA,加50 μL的超純水溶解DNA。
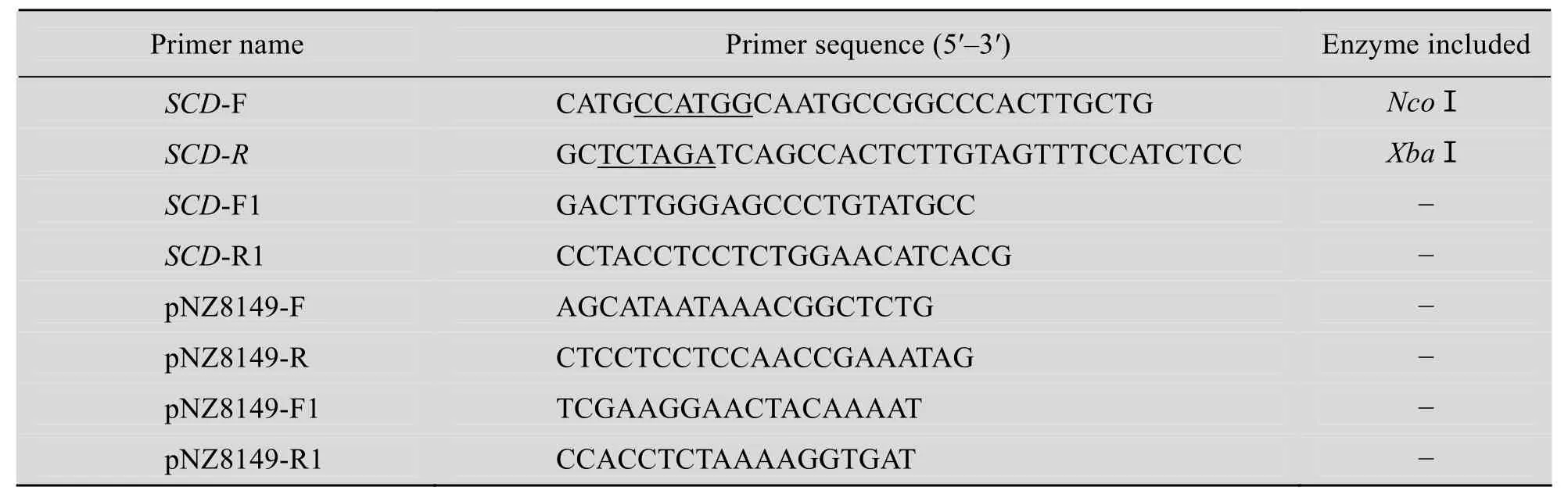
表1 本研究中使用的引物Table 1 Primers used in this study
1.6 乳酸乳球菌的轉化
回收PCR產物,用NcoⅠ和XbaⅠ對回收的PCR產物和質粒pNZ8149 分別進行雙酶切。凝膠電泳,用普通瓊脂糖凝膠DNA回收試劑盒 (天根生化科技有限公司) 回收目的片段。酶切后的目的片段和乳酸乳球菌表達質粒 pNZ8149用快速連接試劑盒 (寶生物工程 (大連) 有限公司) 16 ℃連接1 h,構建重組質粒pNZ8149-scd1。
連接液先用乙醇沉淀純化之后再做轉化,純化的連接液1 μL (濃度大約100 ng/μL) 電擊轉化乳酸乳球菌NZ3900感受態,電擊用以下條件:2 000 V、25 μF、200 ?和2 mm的電轉杯,電擊時間是4.4 ms。電擊的轉化液涂布在以溴甲酚紫為指示劑、0.5%的乳糖為唯一碳源的 Elliker培養基上,30 ℃靜置厭氧培養。一般培養1~2 d。載體pNZ8149攜帶lacF,表達宿主NZ3900缺少lacF,互補篩選陽性菌落。選擇培養基Elliker上出現黃色菌落為陽性菌。用相同的方法轉化空載體作為對照。
1.7 陽性轉化子的PCR鑒定
選擇陽性轉化子進行菌落 PCR鑒定。菌落PCR模板的制備,采用如下方法:取200 μL過夜培養的菌液,12 000 r/min離心2 min;棄上清,加50 μL鹽酸胍,沸水浴15 min;離心棄上清,用100 μL超純水洗2遍;加10 μL雙蒸水溶解,取 2 μL菌液為菌落 PCR的模板。選用載體pNZ8149通用引物進行PCR擴增。
PCR條件是:95 ℃ 10 min ;95 ℃ 30 s,58 ℃30 s,72 ℃ 2 min ,35個循環;72 ℃ 10 min。菌落PCR鑒定后的陽性轉化子,進一步用NcoⅠ和XbaⅠ雙酶切鑒定構建的重組質粒。鑒定后的陽性質粒由北京六合華大基因科技股份有限公司測序。
1.8 重組質粒pNZ8149-scd1在乳酸乳球菌中的誘導表達
選取 PCR鑒定正確的乳酸乳球菌重組子單菌落接種到5 mL M17液體培養基中,添加0.5%的乳糖。30 ℃、5% CO2的恒溫培養箱靜置培養過夜,接種1 mL培養液到10 mL相同的培養液。當OD600=0.4~0.5;10 mL的培養液添加50 ng/mL的誘導劑Nisin,誘導重組體乳酸乳球菌的表達。同時,0.5 mg/mL的反式十八碳烯酸(t11-C18∶1,Sigma V1 131)、0.1 mg/mL的Fe2+和Fe3+分別添加到10 mL培養液中,孵化48 h。菌體離心收集在20 mL的甲酯化玻璃管,抽提脂肪酸進行氣相色譜分析。
1.9 SDS-PAGE檢測硬脂酰Co-A脫氫酶的表達情況
取重組菌新鮮單克隆,分別接種于5 mL含0.5%乳糖的M17培養基,30 ℃靜置培養過夜。同時做 pNZ8149載體對照,方法同重組菌;過夜培養物5 mL,12 000 r/min室溫離心2 min,棄上清,沉淀用500 μL TES裂解液 (pH 8.0的1 mol/L Tris-HCl,1mL;pH 8.0的 0.5 mol/L EDTA,0.2 mL;蔗糖25 g;加超純水至100 mL)洗滌2次,然后用100 μL含有1.0 mg/mL溶菌酶的TES重懸菌體,加1 μL 0.2 mol/L 苯甲基磺酰氟 (PMSF),37 ℃水浴2 h。再加2×SDS-PAGE上樣緩沖液 (pH 6.8的1 mol/L Tris-HCl 1 mL;10%甘油 2 mL;10% SDS 4 mL;1%溴酚藍0.05 mL;2-β巰基乙醇1 mL;加超純水至10 mL) 100 μL,沸水浴5 min,離心后取15 μL上清進行SDS-PAGE。
1.10 脂肪酸分析確定目的片段的功能性表達
鑒定為陽性的乳酸乳球菌接種于5 mL M17的液體培養基,添加0.5%的乳糖。30 ℃、5% CO2的恒溫培養箱靜置過夜培養,接種1 mL培養液到10 mL的新鮮培養液。當OD600=0.4~0.5時,10 mL的培養液添加50 ng/mL的誘導劑Nisin,0.5 mg/mL的t11-C18∶1,0.1 mg/mL的Fe2+和Fe3+分別添加入10 mL培養液中,孵化48 h。菌液離心收集在20 mL的甲酯化玻璃管,脂肪酸抽提方法如下:孵化24 h的菌液離心,6 000 r/min離心5 min;棄上清,加200 μL的菌液重懸,移入20 mL甲酯化玻璃管;加1 mL的正己烷和1 mL的BF3到甲酯化玻璃管;甲酯化玻璃管吹1 min的N2;之后,渦旋振蕩30 s;沸水浴1 h;加1 mL的雙蒸水在沸水浴的甲酯化玻璃管;3 000 r/min離心1 min;取上清到1 mL的玻璃管,用N2吹干,加500 μL的正己烷。用全自動HP6 890氣相色譜儀定量脂肪酸甲酯。測量的結果可用氣相色譜的ChemStation軟件 (Agilent Technologies)分析。
1.11 重組菌生長曲線的測定和pH值的變化
挑取空載pNZ8149菌株和3株陽性菌株平板上的單菌落,用2 mL補加0.5%乳糖的M17液體培養基,30 ℃、5% CO2的恒溫培養箱靜置培養12 h。之后,每株菌吸取1 mL菌液在20 mL M17培養液中,平均分配培養液到2個新的培養管,每株菌做2個重復,10 mL的培養液添加50 ng/mL的誘導劑Nisin。于培養后的第0、3、6、10、12、15 h,分別用無菌培養管從各管中吸取培養液2 mL,以1 cm比色皿比濁,以空載為參比,在 OD600下分別測定其吸光度 A值。同時,用Sartorius PB-10 pH濕度計測量發酵液pH值。
1.12 統計分析
實驗重復了4次,測量的數據用統計分析軟件SAS (1999)。平均數通過MEANS語句列出,分析結果± s表示。
2 結果
2.1 硬脂酰-輔酶 A 脫氫酶的克隆和載體pNZ8149-scd1的構建
從pCAGGS-scd1質粒PCR擴增得到1 100 bp的scd1基因片段,用NcoⅠ和XbaⅠ內切酶導入空載體 pNZ8149,構建成重組表達質粒pNZ8149-scd1,轉化乳酸乳球菌NZ3900后的陽性重組質粒如圖1所示,菌落PCR表明該重組質粒插入了1 100 bp的目標基因 (圖2),NcoⅠ和XbaⅠ雙酶切獲得2 515 bp和1 095 bp的條帶(圖 3),測序證明目的基因讀碼正確。上述鑒定都表明重組質粒 pNZ8149-scd1成功地轉入乳酸乳球菌NZ3900。
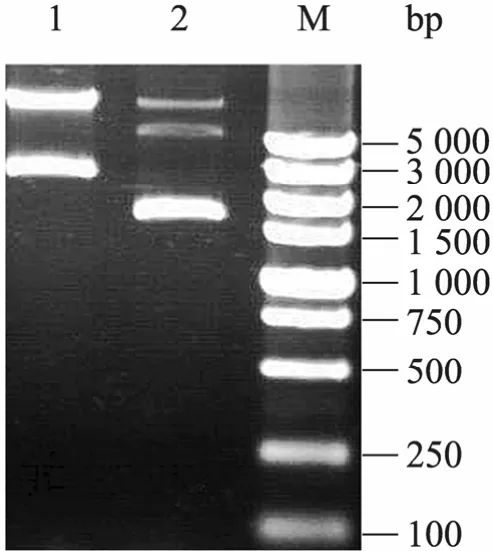
圖1 質粒pNZ8149-scd1的瓊脂糖凝膠電泳檢測Fig. 1 Agarose gel electrophoresis of the pNZ8149-scd1 gene. 1: plasmid pNZ8149-scd1; 2: plasmid pNZ8149; M: DNA marker DL5 000.
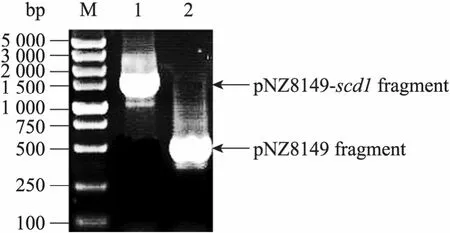
圖2 菌落PCR法鑒定重組表達質粒結果Fig. 2 Direct PCR of bacterial colonies for identification of recombinant expression plasmids. 1: PCR product of pNZ8149-scd1; 2: PCR product of pNZ8149; M: DNA marker DL5 000.
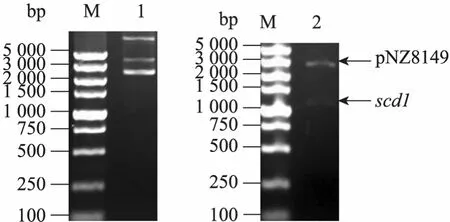
圖3 質粒pNZ8149-scd1酶切的瓊脂糖凝膠電泳Fig. 3 Agarose gel electrophoresis of the pNZ8149-scd1 digested with restriction enzymes. M: DNA marker DL5 000; 1: plasmid pNZ8149-scd1; 2: pNZ8149-scd1 digested with Nco I and Xba I.
2.2 SDS-PAGE分析硬脂酰CoA脫氫酶的表達
重組菌經Nisin誘導,則可高效表達SCD1,該重組菌全蛋白提取物經 10% SDS-PAGE,考馬斯亮藍染色后觀察到外源蛋白的表達,其表觀分子量約為37 kDa,與報道的SCD1表觀分子量結果一致。重組菌 pNZ8149-scd1和空載體pNZ8149的SDS-PAGE結果如圖4所示,空載體在 37 kDa位置未見明顯條帶,而重組菌pNZ8149-scd1在37 kDa有明顯的條帶,說明硬脂酰CoA脫氫酶在重組菌中表達成功。
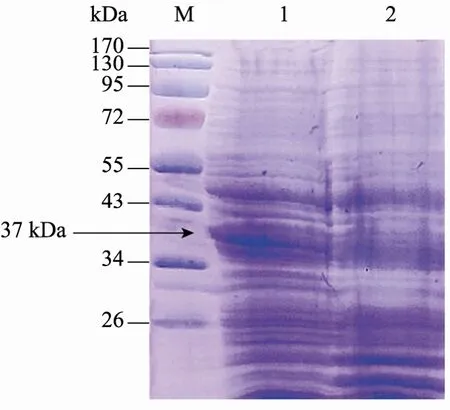
圖4 硬脂酰CoA脫氫酶的SDS-PAGE分析Fig. 4 SDS-PAGE analysis of stearoyl-CoA desaturase-1. M: protein marker; 1: pNZ8149-scd1/NZ3900; 2: pNZ8149/NZ3900.
2.3 硬脂酰-輔酶A脫氫酶的誘導表達和脂肪酸分析
將重組質粒 pNZ8149-scd1轉化至乳酸菌NZ3900,經50 mg/L Nisin誘導表達,同時添加0.5 g/L的t11-C18∶1、0.1 g/L的Fe2+和Fe3+分別添加到10 mL培養液中,孵化48 h。獲得的乳酸菌抽提脂肪酸,分析乳酸菌的脂肪酸組分。隨機選擇了A~C三株scd1轉化菌,檢驗scd1基因表達是否可以提高單不飽和脂肪酸的含量。轉化株產生的脂肪酸用氣相色譜分析 (圖4)。
結果表明 scd1轉化株的棕櫚油酸(C16∶1n-7) 和十八碳烯酸 (C18∶1n-7) 的含量提高了92%~169%和53%~127%,顯著地高于對照組 (P<0.05,表1),而c9,t11-CLA并沒有變化。以上結果表明scd1在乳酸菌中成功表達。
2.4 重組菌的生長曲線和pH值測量
以培養時間為橫坐標、600 nm處測定的OD值為縱坐標,繪制不同時間菌株濃度的生長曲線(圖 5)。統計結果分析表明:隨著時間的推移,對照組和重組菌培養15 h的生長速度和產酸能力相比無顯著變化 (表2~3),這有利于重組菌應用于食品工業。培養15 h后,乳酸菌生長將要達到平臺期,繼續檢測OD值和pH值差異無統計學意義。
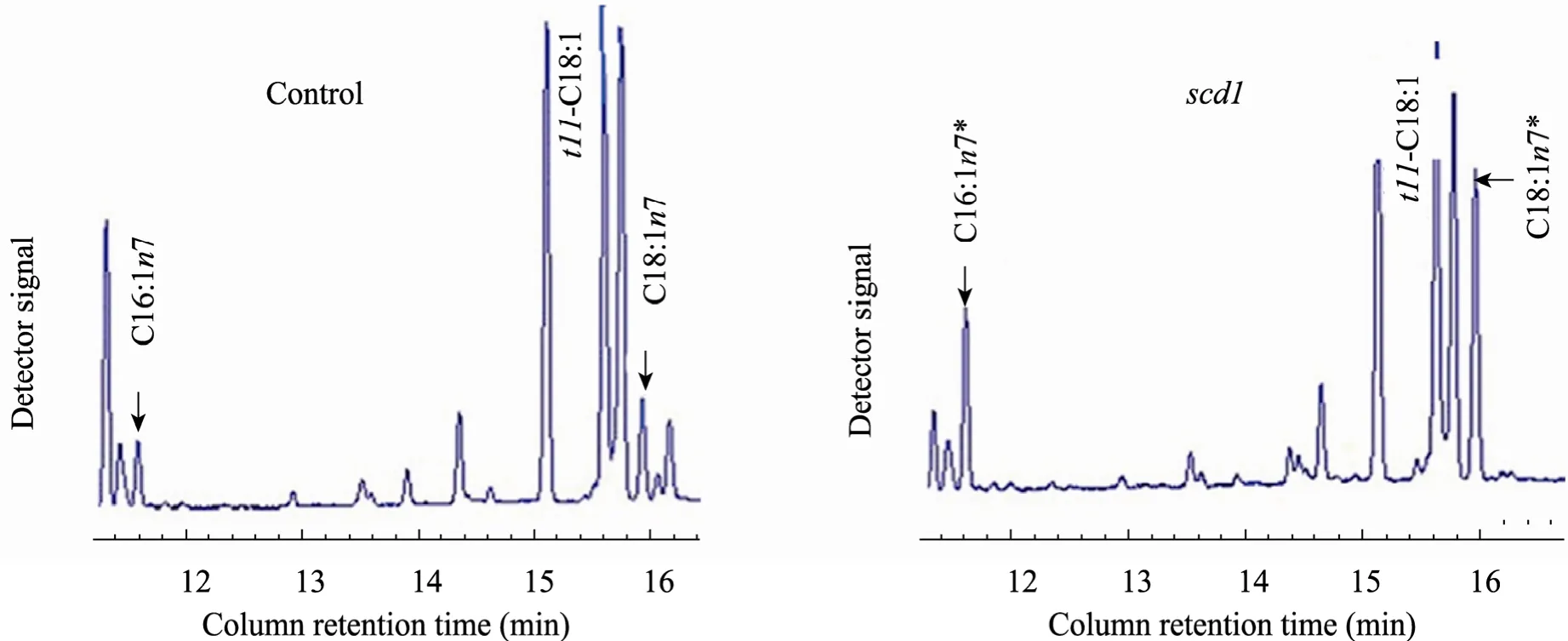
圖5 對照組和scd1轉化株抽提的總脂肪酸的部分氣相色譜圖 (*P<0.05)Fig. 5 Partial gas chromatogram traces showing fatty acid profiles of total lipids extracted from scd1-transformed and control. Both the control and scd1 line A are fed with 0.5 g/L t11-C18:1 for 48 h prior to fatty acid analysis. The lipid profiles show that the levels of palmitoleic acid (C16:1n-7), and cis-vaccenic acid (C18:1n-7) are markedly increased. (*P<0.05).
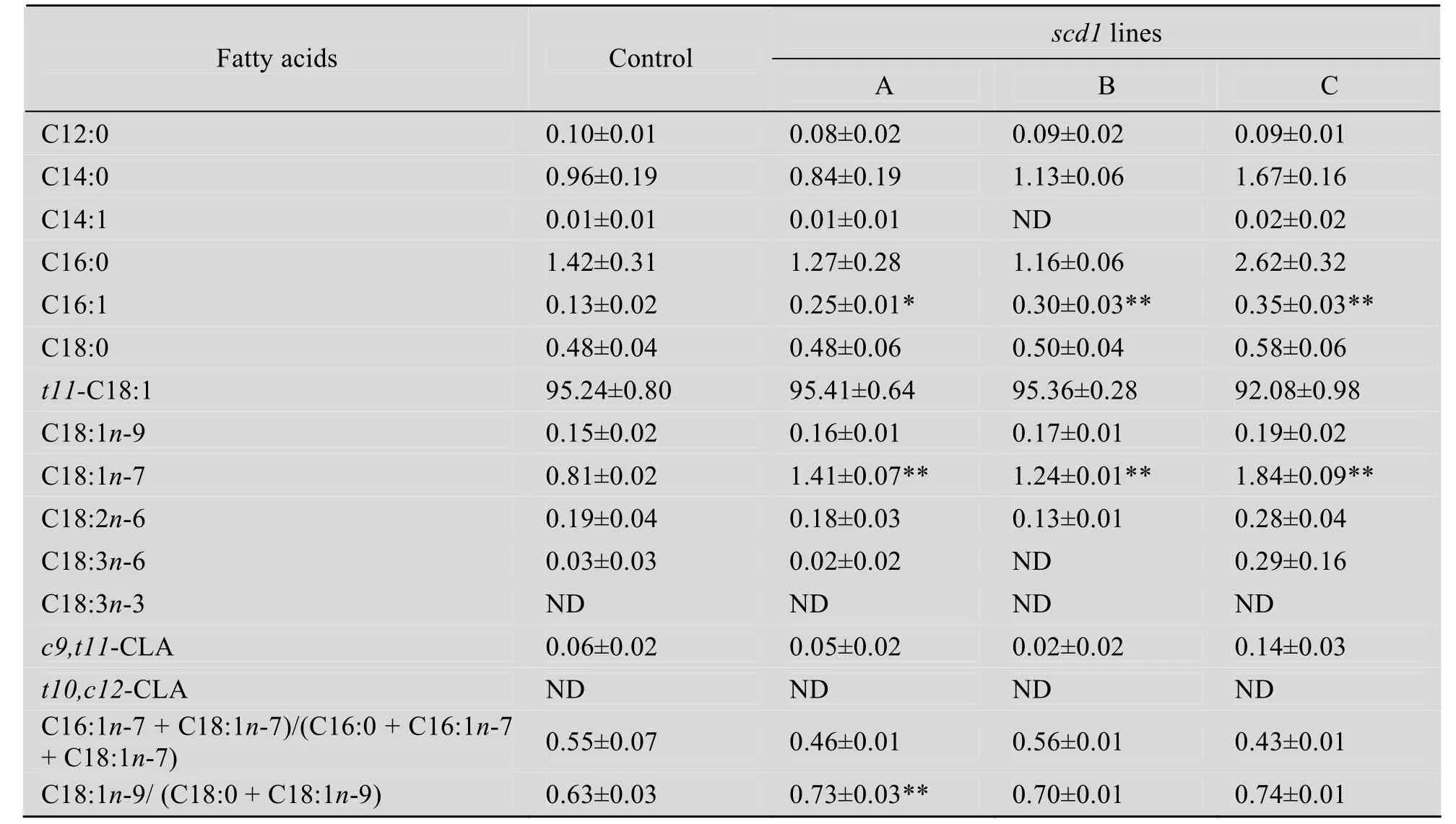
表1 對照組pNZ8149和轉化株pNZ8149-scd1在乳酸乳球菌NZ3900表達的n-7脂肪酸Table 1 n-7 fatty acid composition in Lactococcus lactis NZ3900 transfected with pNZ8149 control and pNZ8149-scd1
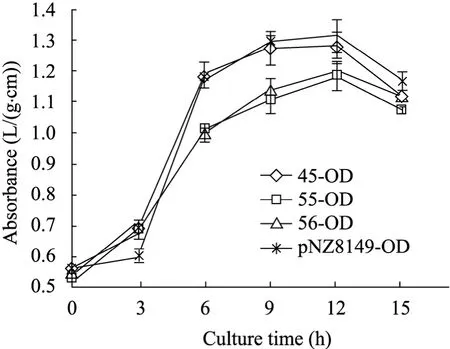
圖6 對照組和scd1轉化株生長曲線圖Fig. 6 Growth curve from scd1-transformed and control. NZ3900: the original strain; pNZ8149: load vector; 45, 55, 56: scd1-transformed.
3 討論
脂肪酸的生物活性越來越引起人們的興趣。高含量的單不飽和脂肪酸和癌細胞的轉化是呈正相關的,與對照組相比棕櫚油酸使 SCD缺失細胞對細胞凋亡更敏感[20]。SCD1的表達可以調控β-細胞、脂肪細胞、巨噬細胞、內皮細胞和肌細胞中炎癥和應激反應。SCD1完全缺失可以導致肝臟功能的紊亂和炎癥疾病[21]。但是,SCD1缺失的瘦素不足肥胖小鼠可以促進心臟的功能,人類胃癌的異種移植模型中 SCD抑制可以延遲腫瘤的生長[22-23],臨床研究發現,n-3脂肪酸可以顯著地影響scd1的mRNA在肝臟的表達和活性[24]。然而,SCD在食品級乳酸菌的表達尚未見報道。
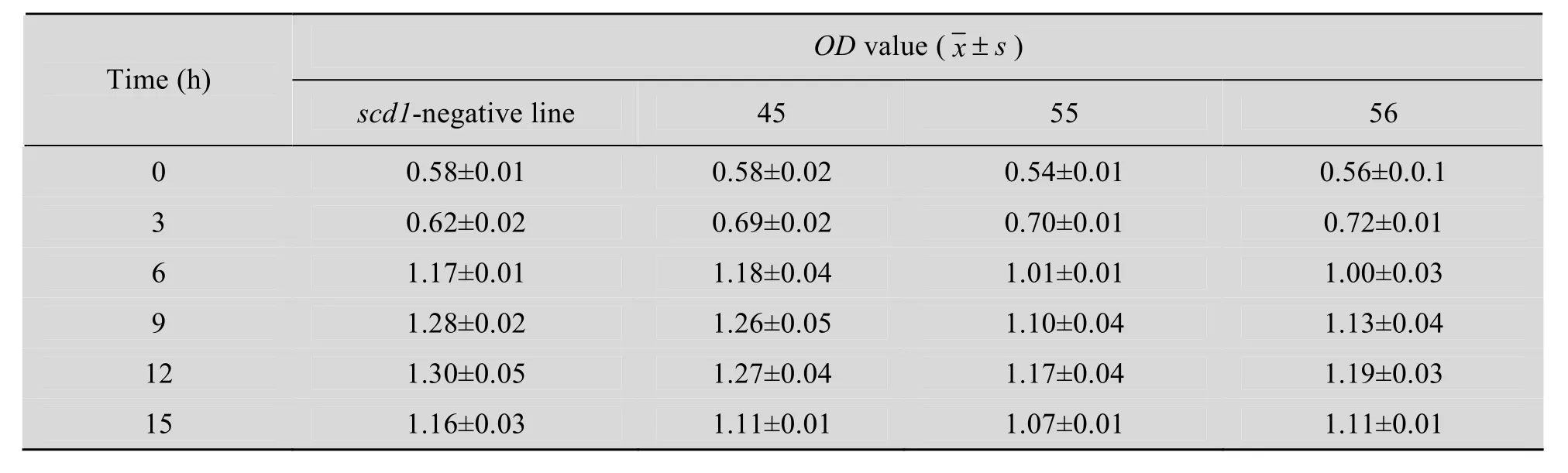
表2 對照組pNZ8149和轉化株pNZ8149-scd1的OD值分析Table 2 OD value analysis in pNZ8149 control and pNZ8149-scd1
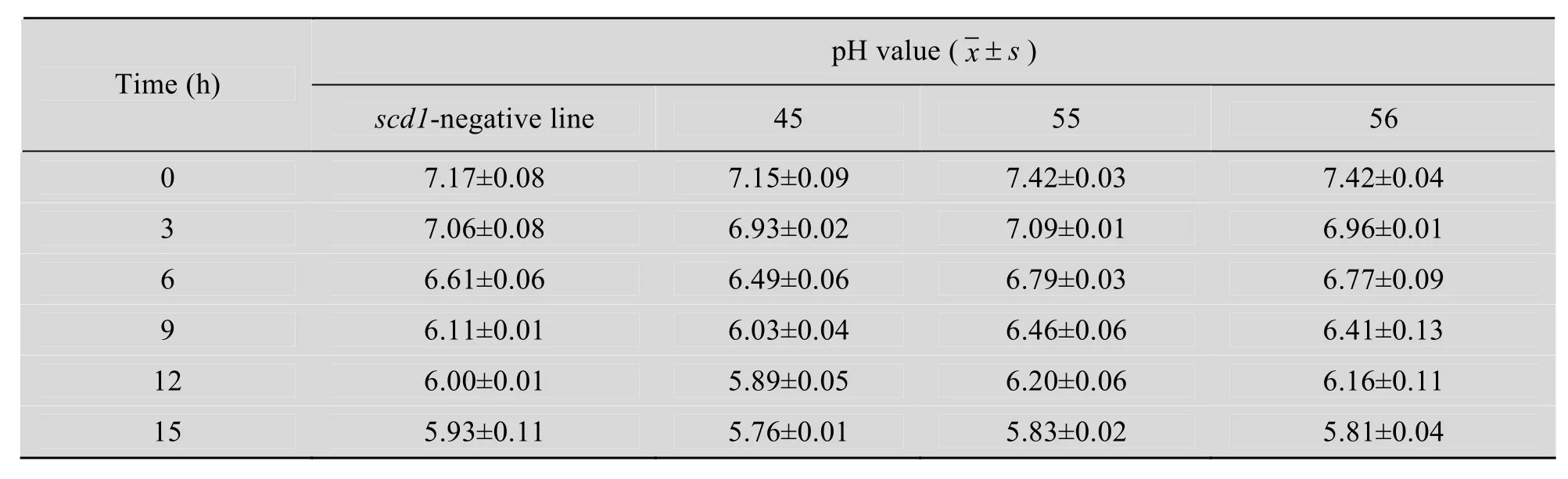
表3 對照組pNZ8149和轉化株pNZ8149-scd1的pH值分析Table 3 pH value analysis in pNZ8149 control and pNZ8149-scd1
本研究把 scd1基因轉入食品級乳酸乳球菌得到陽性表達系,實驗數據顯示添加的底物t11-C18∶1并沒有顯著地轉化為c9,t11-CLA。scd1的表達只引起了 n-7脂肪酸家族 (C16∶1n-7,C18∶1n-7) 的含量升高,C16∶1n-7和 C18∶1n-7脂肪酸的含量分別提高了92%~169%和53%~127%。這為調控scd1的合成和單不飽和脂肪酸在食品工業的利用提供了研究基礎。
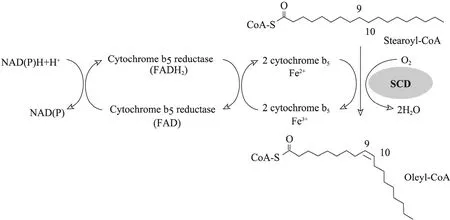
圖7 SCD對脂肪酸去飽和的電子傳遞途徑[6]Fig. 7 The pathway of electron transfer in the desaturation of fatty acids by stearoyl-CoA desaturase (SCD)[6].
SCD與所有的膜結合脂肪酸脫氫酶一樣,是一種氧依賴型含鐵的跨膜蛋白,結合乙酰輔酶A或甘油脂作為底物。該跨膜蛋白含有4次跨膜結構,并且有3個保守的組氨酸富集區,這3個組氨酸保守區與二價鐵離子結合參與形成酶的活性中心。在哺乳動物體中,SCD反應是一個需氧過程,需要分子氧和鐵離子的輔助作用,可以在長鏈脂肪酸△9,10位置引入一個雙鍵。因此,單不飽和脂肪酸的合成是由飽和脂肪酸前體經過一個有氧反應,3個復合物組成的酶系統催化形成[25]。這個復合物酶系統包括依靠黃素蛋白-NADH的細胞色素 b5還原酶、細胞色素 b5和SCD (圖6)。本實驗在乳酸乳球菌的菌液中加了0.1 g/L的鐵離子,而乳酸乳球菌NZ3900是革蘭氏陽性菌,它的生長壞境是厭氧,這對酶的活性有一定的影響。另外,乳酸菌不生產酶反應所需的細胞色素b5,這些都可能導致酶的活性降低,影響t11-C18∶1轉化為c9,t11-CLA。
本研究通過對 scd1進行原核表達,對重組體的脂肪酸組分進行了分析,表明 scd1基因在乳酸菌中成功表達。通過轉基因技術,Reh等把大鼠的 scd基因整合到奶山羊基因組中并在乳腺中進行表達,產生的轉基因山羊與對照組山羊乳脂肪酸組成相比,飽和脂肪酸含量降低,不飽和脂肪酸含量增加,c9,t11-CLA的含量在第7天時有顯著差異,但這種作用在泌乳第30天開始削弱[14]。Wu等把人的scd1基因轉到人腎胚 293細胞,得到穩定表達的細胞系,CLA含量顯著提升,底物 t11-C18∶1的轉化率達到16.49%~20.06%[15]。另外,乳酸乳球菌轉化株表達人的scd1基因,SCD作為內質網膜上的不飽和酶系統,它不會擾亂其他內源性多不飽和脂肪酸的正常代謝。與對照相比包括n-6和n-3系列與n-6/n-3的比值都不會改變。雖然scd1在人體的表達可能和家族的高血脂和人類的代謝病相關聯[26-27],但是,目前研究 scd1在乳酸乳球菌中的表達并沒有危害效應。
SCD1是脂肪生成的關鍵酶,它可以催化單不飽和脂肪酸的生成,主要是 C18∶1n-9和C16∶1n-7。因此,C18∶1n-9和C16∶1n-7增加2個碳原子分別延長n-9和n-7系列的長鏈脂肪酸。在最近的研究中,我們發現scd1的表達僅僅能夠顯著增加 n-7系列的脂肪酸,比如C16∶1n-7和 C18∶1n-7。相反的,在本實驗中預期的n-9產物,比如C18∶1n-9沒有增加。相應地,scd1菌株與對照組相比較n-7系列的產物顯著地增加。這樣的變化是SCD1的Δ-9脫氫酶功能所不能解釋的。C18∶1n-7的含量增加極有可能是由于C16∶1n-7脂肪酸含量升高后,體內的延長酶通過在碳鏈末端加入二碳原子單位引起的。已經有許多研究證實t10,c12-CLA能夠強烈抑制 SCD酶的活性[28-31],但具體的機制并不清楚。添加CLA的人肝癌細胞 (HepG2) 中棕櫚酸的合成不受影響,但油酸的合成顯著下降[32]。由此我們猜想在scd1菌株里可能是CLA抑制了C18∶1 n-9脂肪酸的合成。
乳酸乳球菌能在人小腸中短暫生活,對人體有益無害的食品級微生物。本實驗應用pNZ8149/NZ3900表達系統以lacF基因為選擇標記基因,利用以乳糖為唯一碳源的培養基進行篩選。受體菌、選擇標記基因以及誘導物Nisin均為食品級,因此,乳酸乳球菌的食品級表達系統pNZ8149-scd1/NZ3900表達有活性的SCD1,提升不飽和脂肪酸的含量。油酸可以調節人體血漿中高、低密度脂蛋白膽固醇的濃度比例,防止心血管疾病的發生。而且,重組菌的生長速度和產酸能力與對照組相比沒發生顯著變化,未來我們進一步把重組菌用于動物實驗,以期為功能性食品的研制和生產提供美好前景。
致謝:氣相色譜分析由中國農科院飼料研究所范志影老師協助完成。
REFERENCES
[1] Sampath H, Ntambi JM. The role of stearoyl-CoA desaturase in obesity, insulin resistance, and inflammation. Ann NY Acad Sci, 2011, 1243(1): 47?53.
[2] Strittmatter P, Spatz L, Corcoran D, et al. Purification and properties of rat liver microsomal stearyl coenzyme A desaturase. Proc Natl Acad Sci USA, 1974, 71(11): 4565?4569.
[3] Tocher DR, Leaver MJ, Hodgson PA. Recent advances in the biochemistry and molecular biology of fatty acyl desaturases. Prog Lipid Res, 1998, 37(2/3): 73?117.
[4] Sakuradani E, Kobayashi M, Shimizu S. Δ9-fatty acid desaturase from arachidonic acid-producing fungus. Unique gene sequence and its heterologous expression in a fungus, Aspergillus. Eur J Biochem, 1999, 260(1): 208?216.
[5] Laoteng K, Anjard C, Rachadawong S, et al. Mucor rouxii Δ9-desaturase gene is transcriptionally regulated during cell growth and by low temperature. Mol Cell Biol Res Commun, 1999, 1(1): 36?43.
[6] Paton CM, Ntambi JM. Biochemical and physiological function of stearoyl-CoA desaturase. Am J Physiol Endocrinol Metab, 2009, 297(1): E28–E37.
[7] Cohen P, Miyazaki M, Socci ND, et al. Role for stearoyl-CoA desaturase-1 in leptin-mediated weight loss. Science, 2002, 297(5579): 240–243.
[8] Ntambi JM, Miyazaki M, Stoehr JP, et al. Loss of stearoyl-CoA desaturase-1 function protects mice against adiposity. Proc Natl Acad Sci USA, 2002, 99(17): 11482–11486.
[9] Dobrzyn P, Dobrzyn A, Miyazaki M, et al. Stearoyl-CoA desaturase 1 deficiency increases fatty acid oxidation by activating AMP-activated protein kinase in liver. Proc Natl Acad Sci USA, 2004, 101(17): 6409–6414.
[10] Hulver MW, Berggren JR, Carper MJ, et al. Elevated stearoyl-CoA desaturase-1 expression in skeletal muscle contributes to abnormal fatty acid partitioning in obese humans. Cell Metab, 2005, 2(4): 251?260.
[11] Brown JM, Chung S, Sawyer JK, et al. Combined therapy of dietary fish oil and Stearoyl-CoA desaturase 1inhibition prevents the metabolic syndrome and atherosclerosis. Arterioscler Thromb Vasc Biol, 2010, 30(1): 24?30.
[12] Palmquist DL, Lock AL, Shingfield KJ, et al. Biosynthesis of conjugated linoleic acid in ruminants and humans. Adv Food Nutr Res, 2005, 50: 179?217.
[13] Santora JE, Palmquist DL, Roehrig KL. Trans-vaccenic acid is desaturated to conjugated linoleic acid in mice. J Nutr, 2000, 130(2): 208?215.
[14] Reh WA, Maga EA, Collette NMB, et al. Hot topic: using a stearoyl-CoA desaturase transgene to alter milk fatty acid composition. J Dairy Sci, 2004, 87(10): 3510–3514.
[15] Wu ZF, Li DF, Gou KM. Overexpression of stearoyl-CoA desaturase-1 results in an increase of conjugated linoleic acid (CLA) and n-7 fatty acids in 293 cells. Biochem Biophys Res Commun, 2010, 398(3): 473?476.
[16] Wei WZ, Xiang H, Tan HR. Food-grade expression of human Cu/Zn-superoxide dismutase gene in Lactococcus lactis. Acta Microbiol Sin, 2003, 43(3): 347?353.衛文仲, 向華, 譚華榮. 人銅鋅超氧化物歧化酶基因在乳酸乳球菌中的食品級表達. 微生物學報, 2003, 43(3): 347?353.
[17] Xu B, Cao YS, Chen Y, et al. Construction of NICE system food-grade vector prnb48 for Lactococcus lactis. Food Sci Technol, 2006(10): 22?26.徐波, 曹郁生, 陳燕, 等. 乳酸乳球菌NICE系統食品級載體 pRNB48的構建. 食品科技, 2006(10): 22?26.
[18] Molecular biotechnology GmbH. Vector-systems: NICE?Expression System for Lactococcus lactis [EB/OL]. [2012-02-20]. Molecular biotechnology website: http://www.mobitec.com/int/index.html.
[19] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 1989: 27?30.
[20] Scaglia N, Ariel Igal R. Stearoyl-CoA Desaturase is involved in the control of proliferation, Anchorageindependent growth, and survival in human transformed cells. J Biol Chem, 2005, 280(27): 25339?25349.
[21] Liu XQ, Strable MS, Ntambi JM. Stearoyl CoA desaturase 1: role in cellular inflammation and stress. Adv Nutr, 2011, 2: 15?22.
[22] Dobrzyn P, Dobrzyn A, Miyazaki M, et al. Loss of Stearoyl-CoA desaturase 1 rescues cardiac function in obese leptin-deficient mice. J Lipid Res, 2010, 51(8): 2202?2210.
[23] Roongta UV, Pabalan JG, Wang XY, et al. Cancer cell dependence on unsaturated fatty acids implicates Stearoyl-CoA desaturase as a target for cancer therapy. Mol Cancer Res, 2011, 9(11): 1551?1561.
[24] Hofacer R, Magrisso IJ, Jandacek R, et al. Omega-3 fatty acid deficiency increases Stearoyl-CoA desaturase expression and activity indices in rat liver: positive association with non-fasting plasma triglyceride levels. Prostag Leukot Essent Fatty Acids, 2012, 86(1/2): 71?77.
[25] Heinemann FS, Ozols J. Stearoyl-CoA desaturase, a short-lived protein of endoplasmic reticulum with multiple control mechanisms. Prostag Leukot Essent Fatty Acids, 2003, 68(2): 123?133.
[26] Mar-Heyming R, Miyazaki M, Weissglas-Volkov D, et al. Association of stearoyl-CoA desaturase 1 activity with familial combined hyperlipidemia. Arterioscler Thromb Vasc Biol, 2008, 28(6): 1193–1199.
[27] Popeijus HE, Saris WHM, Mensink RP. Role of stearoyl-CoA desaturases in obesity and the metabolic syndrome. Int J Obes, 2008, 32(7): 1076?1082.
[28] Park Y, Storkson JM, Ntambi JM, et al. Inhibition of hepatic stearoyl-CoA desaturase activity by trans-10, cis-12 conjugated linoleic acid and its derivatives. Biochim Biophys Acta, 2000, 1486(2-3): 285?292.
[29] Gervais R, McFadden JW, Lengi AJ, et al. Effects of intravenous infusion of trans-10, cis-12 18:2 on mammary lipid metabolism in lactating dairy cows. J Dairy Sci, 2009, 92(10): 5167?5177.
[30] Lin XB, Loor JJ, Herbein JH. Trans10, cis12-18: 2 is a more potent inhibitor of de novo fatty acid synthesis and desaturation than cis9, trans11-18: 2 in the mammary gland of lactating mice. J Nutr, 2004, 134(6): 1362?1368.
[31] Smith SB, Kawachi H, Choi CB, et al. Cellular regulation of bovine intramuscular adipose tissue development and composition. J Anim Sci, 2009, 87(14): E72?E82.
[32] Yee JK, Mao CS, Hummel HS, et al. Compartmentalization of stearoyl-coenzyme A desaturase 1 activity in HepG2 cells. J Lipid Res, 2008, 49(10): 2124–2134.

