谷氨酸棒桿菌NAD激酶的過表達對L-異亮氨酸合成的促進作用
還曉靜,李坤,史鋒,王小元
1 江南大學 食品科學與技術國家重點實驗室,江蘇 無錫 214122
2 江南大學生物工程學院 工業生物技術教育部重點實驗室,江蘇 無錫 214122
工業生物技術
谷氨酸棒桿菌NAD激酶的過表達對L-異亮氨酸合成的促進作用
還曉靜1,2,李坤1,2,史鋒1,2,王小元1,2
1 江南大學 食品科學與技術國家重點實驗室,江蘇 無錫 214122
2 江南大學生物工程學院 工業生物技術教育部重點實驗室,江蘇 無錫 214122
NAD激酶催化輔酶Ⅰ[NAD(H)]發生磷酸化,轉變成輔酶 Ⅱ[NADP(H)],而還原態輔酶Ⅱ (NADPH) 是L-異亮氨酸合成的必要輔因子。為了提高NADPH的供應,首先克隆了谷氨酸棒桿菌NAD激酶基因ppnK,并利用大腸桿菌-棒狀桿菌誘導型穿梭表達載體pDXW-8和組成型穿梭表達載體pDXW-9在L-異亮氨酸合成菌——乳糖發酵短桿菌JHI3-156中進行表達。搖瓶發酵后,ppnK誘導表達菌JHI3-156/pDXW-8-ppnK的NAD激酶酶活 (4.33±0.74 U/g) 比pDXW-8空載菌提高了83.5%,輔酶Ⅱ與輔酶Ⅰ的比例提高了63.8%,L-異亮氨酸產量 (3.86±0.12 g/L) 提高了82.9%;ppnK組成表達菌JHI3-156/pDXW-9-ppnK的NAD激酶酶活 (7.67±0. 65 U/g)比pDXW-9空載菌提高了2.20倍,輔酶Ⅱ與輔酶Ⅰ的比例提高了1.34倍,NADPH含量提高了21.7%,L-異亮氨酸產量 (2.99±0.18 g/L) 提高了41.7%。這說明NAD激酶有助于輔酶Ⅱ的供應和L-異亮氨酸的生物合成,這對于其他氨基酸的生產也有一定的參考依據。
L-異亮氨酸,NAD激酶,誘導型表達,組成型表達,乳糖發酵短桿菌
Abstract:NAD kinase catalyzes the phosphorylation of coenzyme Ⅰ [NAD(H)] to form coenzyme Ⅱ [NADP(H)], and NADPH is an important cofactor in L-isoleucine biosynthesis. In order to improve NADPH supply,ppnK, the gene encoding NAD kinase inCorynebacterium glutamicumwas cloned and separately expressed in an L-isoleucine synthetic strain,Brevibacterium lactofermentumJHI3-156, by an inducible expression vector pDXW-8 and a constitutive expression vector pDXW-9. Compared with the control strain JHI3-156/pDXW-8, NAD kinase activity of the inducibleppnK-expressing strain JHI3-156/pDXW-8-ppnKwas increased by 83.5%. NADP(H)/NAD(H) ratio was also increased by 63.8%. L-isoleucine biosynthesis was improved by 82.9%. Compared with the control strain JHI3-156/pDXW-9, NAD kinase activity of the constitutiveppnK-expressing strain JHI3-156/pDXW-9-ppnKwas increased by 220%. NADP(H)/NAD(H) ratio and NADPH concentration were increased by 134% and 21.7%, respectively. L-isoleucine biosynthesis was increased by 41.7%. These results demonstrate that NAD kinase can improve the coenzyme Ⅱ supply and L-isoleucine biosynthesis, which would also be useful for biosynthesis of other amino acids.
Keywords:L-isoleucine, NAD kinase, inducible expression, constitutive expression,Brevibacterium lactofermentum
L-異亮氨酸 (L-isoleucine,Ile) 是高等動物的8種必需氨基酸之一,世界衛生組織建議體重為70 kg的成年人每日攝取1.4 g。L-異亮氨酸在飼料[1]、食品、醫藥[2]行業的應用非常廣泛,用量逐年增長[3]。在國內,工業上大多采用誘變篩選獲得的菌株通過發酵生產L-異亮氨酸,產品得率及質量都難以參與國際競爭,生產水平遠遠不能滿足需求。
應用基因工程手段進行生產菌的定向育種,能打破種屬界限,集中不同菌株的優點,從而選育出高產、優質的基因工程菌[4-5]。L-異亮氨酸的合成從天冬氨酸開始,涉及 10步反應。除了可以通過改造合成途徑的關鍵酶[6-7]之外,還可以通過調節輔酶的供應來對 L-異亮氨酸的合成途徑進行分子改造。L-異亮氨酸合成所需的關鍵輔酶是 NADPH,它是天冬氨酸 β-半醛脫氫酶(ASD)、高絲氨酸脫氫酶 (HD) 和乙酰羥酸合酶(AHAIR) 的輔酶。NADPH還是細胞內最重要的還原力,在還原性生物合成中起到氫供體的作用,高效供應NADPH有利于發揮菌株的合成潛力[8-9],推動L-異亮氨酸的進一步積累。
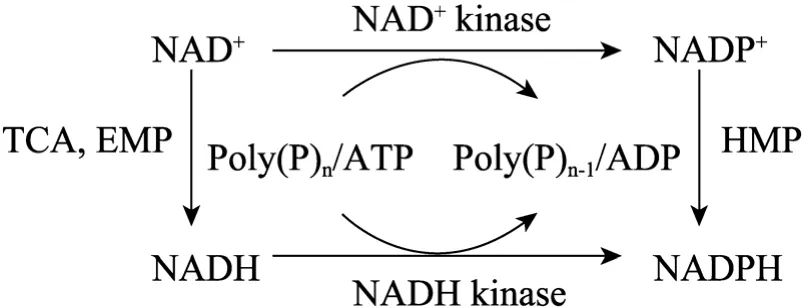
圖1 輔酶Ⅰ和輔酶Ⅱ的生物合成途徑Fig.1 Biosynthetic pathway of coenzyme Ⅰ and Ⅱ.
細胞內NADPH的主要供應渠道是HMP途徑和NAD激酶,其中HMP途徑利用氧化態輔酶Ⅱ(NADP+) 作為電子受體生成還原態輔酶Ⅱ(NADPH),NAD激酶則催化輔酶Ⅰ發生磷酸化生成輔酶Ⅱ(圖1)。HMP途徑在產生NADPH的同時,會消耗其他底物,如葡萄糖[10-11];而NAD激酶則只調節輔酶的轉變,不消耗其他碳源底物。NAD激酶包括NAD+激酶和NADH激酶,NAD+激酶利用 ATP或多聚磷酸鹽[poly(P)]作為磷酸供體,催化NAD+發生磷酸化,生成NADP+;而NADH激酶則催化NAD+和NADH發生磷酸化,生成NADP+和NADPH[12]。NAD激酶催化的反應構成了NADP+生物合成途徑的最后一步,是生物細胞內唯一一種催化 NAD(H) 生成NADP(H) 的反應。近年來,對NAD激酶的分子基礎研究表明絕大多數生物體內都存在NAD激酶[13],它具有重要的生理功能。在氨基酸的主要生產菌谷氨酸棒桿菌中,存在一種利用 ATP和poly(P) 作為磷酸供體,催化NAD+和NADH發生磷酸化的NAD激酶,即poly(P)/ATP-NAD激酶 (PpnK)。最近Lindner等在L-賴氨酸生成菌中表達PpnK,研究顯示其有利于L-賴氨酸積累[14]。
目前國內應用基因工程手段來選育 L-異亮氨酸生成菌的研究已初步開展,但還未研究利用輔酶調控技術來提高其產量。L-異亮氨酸的生產菌株多以親緣關系相近的谷氨酸棒桿菌Corynebacterium glutamicum[15]和乳糖發酵短桿菌Brevibacterium lactofermentum[16]為主。本文通過克隆谷氨酸棒桿菌的ppnK基因,并在一株L-異亮氨酸合成菌——乳糖發酵短桿菌 JHI3-156中表達,研究了它對胞內輔酶供應和對L-異亮氨酸積累的影響。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒
本實驗中所用到的菌株和質粒見表1。
1.1.2 主要培養基
LB培養基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH 7.0,相應的固體培養基中添加20 g/L的瓊脂粉,需要時,添加50 mg/L卡那霉素。
LBG培養基:在 LB 培養基中添加50 g/L葡萄糖,需要時,添加30 mg/L卡那霉素。
活化培養基:在LB培養基中添加50 g/L葡萄糖和50 g/L牛肉浸膏,相應的固體培養基中添加15 g/L的瓊脂粉,需要時,添加30 mg/L卡那霉素。
種子培養基:葡萄糖25 g/L,尿素1.25 g/L,玉米漿20 g/L,KH2PO41 g/L,MgSO40.5 g/L,pH 7.0,需要時,添加30 mg/L卡那霉素。
發酵培養基:葡萄糖100 g/L,(NH4)2SO420 g/L,玉米漿20 g/L,KH2PO41 g/L,MgSO40.5 g/L和CaCO320 g/L,pH 6.7,需要時,添加30 mg/L卡那霉素。攜帶誘導型表達載體的重組菌株,在發酵接種后10 h添加IPTG (終濃度為1 μmol/L) 誘導。
1.2 方法
1.2.1 引物的設計和ppnK基因的擴增
根據 NCBI中報道的谷氨酸棒桿菌ATCC13032的ppnK基因 (GenBank Accession No. Cg1601) 設計上游引物ppnK(F) 和下游引物ppnK(R),引物序列見表2。引物合成由上海捷瑞生物工程有限公司完成。
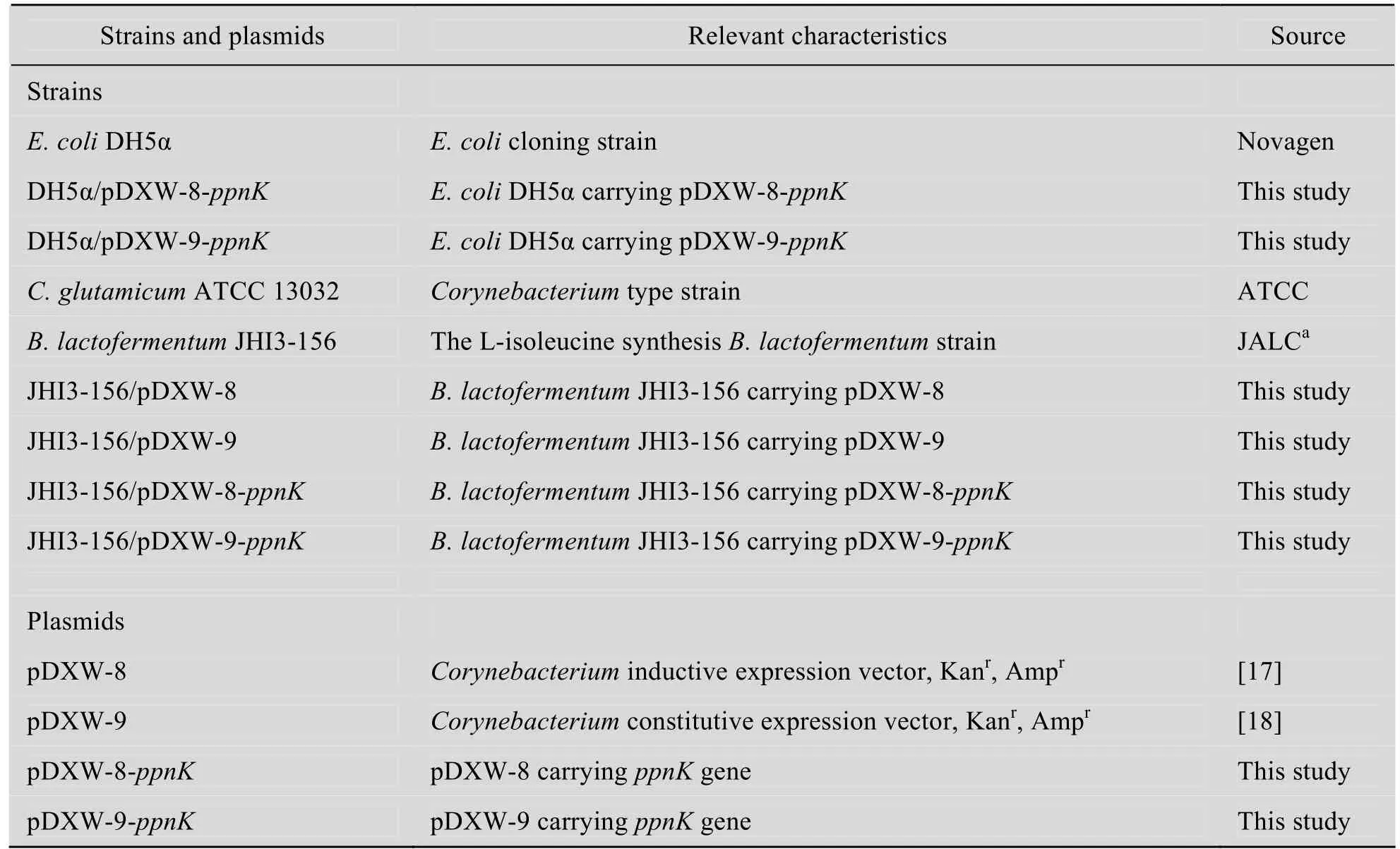
表1 本實驗所用菌株和質粒Table 1 Strains and plasmids used in this study
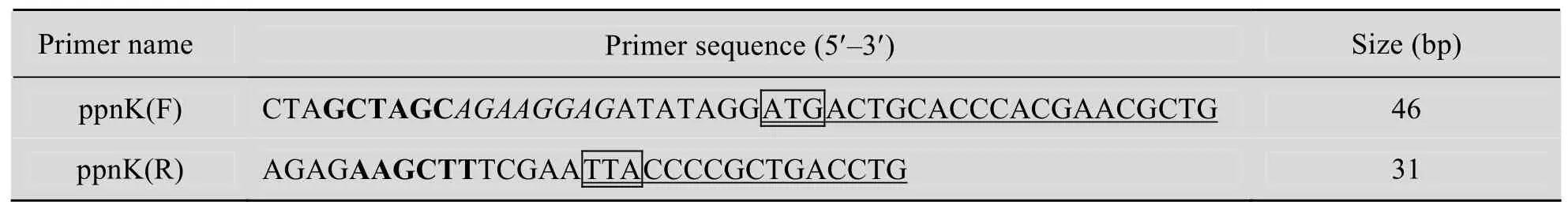
表2 本研究使用的PCR引物Table 2 PCR primers used in this study
將谷氨酸棒桿菌ATCC13032用LBG培養基在37 ℃、200 r/min培養過夜,收集3 mL細胞,提取其基因組。以該基因組 DNA為模板、ppnK(F) 和ppnK(R) 為引物,通過PCR擴增出NheⅠ-ppnK-Hind Ⅲ片段。
1.2.2 重組質粒和工程菌株的構建
純化后的PCR產物NheⅠ-ppnK-Hind Ⅲ用NheⅠ和Hind Ⅲ雙酶切后,分別定向連接至大腸桿菌/棒狀桿菌誘導型表達載體 pDXW-8[17]和組成型表達載體pDXW-9[18],并轉化至大腸桿菌DH5α感受態細胞,得到陽性轉化子 DH5α/pDXW-8-ppnK和 DH5α/pDXW-9-ppnK。將陽性轉化子提交上海生工生物工程有限公司測序。
參照文獻方法[17]制備乳糖發酵短桿菌JHI3-156感受態細胞。將驗證正確的質粒pDXW-8、pDXW-9、pDXW-8-ppnK和pDXW-9-ppnK用電轉化方法轉入JHI3-156感受態細胞,于LBHIS培養基[17]中培養72 h,挑取轉化子,得到ppnK表達菌株和空載菌株。
1.2.3 重組菌株的發酵
取出發菌株 JHI3-156和重組菌株在活化平板上劃線,于30 ℃培養24 h。挑一滿環活化平板上的菌體接種至50 mL種子培養基 (250 mL錐形瓶) 中,在30 ℃、200 r/min培養18 h。種子液按終濃度OD562=1.0的接種量轉接入50 mL發酵培養基(500 mL錐形瓶),在30 ℃、200 r/min發酵72 h。進行了兩批發酵,每批每株菌株設3個平行樣,所有結果為這2批發酵的平均值。
發酵開始后,每隔6 h取樣,測定發酵液菌體濃度和葡萄糖含量。測定葡萄糖含量時,取1 mL培養液,12 000 r/min離心5 min得到發酵上清液,稀釋100倍后,用山東省科學院生產的生物傳感分析儀測定葡萄糖含量。
1.2.4 NAD激酶酶活的測定
發酵結束后,收集菌體,用 KNDE緩沖液(1.0 mmol/L K2HPO4-KH2PO4,pH 7.0,0.1 mmol/L NAD+,0.5 mmol/L DTT,1 mmol/L EDTA) 洗滌3次,加入10 mL KNDE緩沖液重懸細胞,加入100 μL溶菌酶 (100 g/L) 處理后,在冰水里超聲波破碎2 h,在4 ℃、12 000 r/min離心10 min后,收集上清。上清中蛋白質含量用Bradford法在核酸-蛋白定量儀 (GeneQuant公司) 上測定。ATP-NAD+激酶的酶活測定方法參照文獻[19],測定吸光度值OD340變化。酶活定義為:在30 ℃、1 mL反應體系中,每分鐘催化得到1 μmol NADP+的酶量為1 U,比酶活用U/mg或U/g表示。
1.2.5 NAD(H)和NADP(H)濃度的測定
發酵24 h時,取1 mL發酵液2份,離心去上清,菌體置于液氮急速淬滅后存放于-70 ℃冰箱。測定輔酶含量時,取出菌體,置于冰水混合物中用冷的PBS (pH 7.5) 清洗1次,然后參照文獻方法[20]測定 4種輔酶 NAD+、NADH、NADP+、NADPH含量。細胞干重按經驗公式計算:Y (g/L DCW) =0.6495×OD562?2.7925;細胞體積按每mg DCW為1.6 μL計算。
1.2.6 氨基酸含量的測定
發酵過程中,每隔6 h取1 mL培養液,12 000 r/min離心5 min得到發酵上清液,用5%三氯乙酸稀釋50倍,靜置1 h,12 000 r/min離心10 min得到上清液,用0.22 μm濾膜過濾后,采用高效液相色譜系統 (Agilent公司1200series色譜儀) 自動柱前衍生化法測定氨基酸含量。色譜柱:Agilent Eclipse-AAA柱。流動相水相(1 L):4.52 g無水乙酸鈉、200 μL三乙胺、5 mL四氫呋喃、pH 7.2;有機相 (1 L):4.52 g無水乙酸鈉、400 mL甲醇、400 mL乙腈。色譜條件:柱溫40 ℃,流速1.0 mL/min,DAD檢測器。
2 結果與分析
2.1ppnK表達質粒和菌株的構建
以谷氨酸棒桿菌 ATCC13032基因組為模板,通過 PCR擴增得到 1 002 bp的NheⅠ-ppnK-Hind Ⅲ基因片段,分別連入 9 548 bp的pDXW-8和8 351 bp的pDXW-9表達載體中構建ppnK表達質粒。
pDXW-8為大腸桿菌-棒狀桿菌誘導型穿梭表達載體,該載體使用lacIPF104控制的tac啟動子和rrnBT1T2終止子來控制插入基因的表達[17]。pDXW-9是大腸桿菌-棒狀桿菌組成型穿梭表達載體,該載體使用tac啟動子和rrnBT1T2終止子來控制目的基因的表達[18]。
將基因片段NheⅠ-ppnK-Hind Ⅲ和表達載體pDXW-8或pDXW-9用限制性內切酶NheⅠ和Hind Ⅲ進行雙酶切,酶切產物純化后用 T4 DNA連接酶連接,轉化大腸桿菌,得到 DH5α/pDXW-8-ppnK和 DH5α/pDXW-9-ppnK轉化子。提取質粒,經過HindⅢ單酶切和ppnK基因擴增、測序,證明構建得到10 488 bp的pDXW-8-ppnK和9 291bp的pDXW-9-ppnK重組質粒。
將重組質粒pDXW-8-ppnK和pDXW-9-ppnK電轉化乳糖發酵短桿菌JHI3-156,得到JHI3-156/pDXW-8-ppnK和 JHI3-156/pDXW-9-ppnK轉化子,提取質粒,通過Hind Ⅲ單酶切和ppnK基因擴增,證明構建得到 JHI3-156/pDXW-8-ppnK和JHI3-156/pDXW-9-ppnK重組菌株。將空載體pDXW-8和 pDXW-9轉化 JHI3-156,得到JHI3-156/pDXW-8和 JHI3-156/pDXW-9空載菌株。
2.2 重組菌的搖瓶發酵
將構建的 4株重組菌 JHI3-156/pDXW-8、JHI3-156/pDXW-9、JHI3-156/pDXW-8-ppnK、JHI3-156/pDXW-9-ppnK與出發菌JHI3-156進行搖瓶發酵,測定發酵過程中菌體的生長狀況、NAD激酶表達情況和 ATP-NAD+激酶酶活、輔酶含量以及L-異亮氨酸產量。通過比較各菌株的發酵性能差異,分析誘導型和組成型表達 NAD激酶對L-異亮氨酸產量的影響。
2.2.1 重組菌的生長情況
搖瓶發酵72 h,各菌株的生長情況見圖2。發酵過程中ppnK表達菌和出發菌生長狀態良好,36 h后進入穩定期,之后菌體緩慢增長。出發菌 JHI3-156在無抗生素和誘導劑的條件下培養,生長最好,72 h時OD562值達到26.8±1.8,而pDXW-8和 pDXW-9空載菌則因攜帶了質粒生長減緩。ppnK的誘導表達對細胞生長無不良影響,72 h時OD562為 24.9±0.8,比空載菌株JHI3-156/pDXW-8 (18.9±0.3) 提高了 31.7%。ppnK組成型表達對菌體的生長也有促進作用,72 h時OD562為25.0±0.5,比空載菌株JHI3-156/pDXW-8 (20.4±0.2) 提高了 22.5%,說明 NAD激酶的表達有助于細胞生長。
2.2.2 重組菌的胞內NAD激酶酶活
谷氨酸棒桿菌的 PpnK是一種利用 ATP和poly(P) 作為磷酸供體,催化NAD+和NADH (輔酶Ⅰ) 發生磷酸化生成NADP+和NADPH (輔酶Ⅱ) 的NAD激酶。各菌株發酵72 h后細胞破碎液上清中ATP-NAD+激酶的活性如圖3所示。而它們的ATP-NADH激酶活性很低。
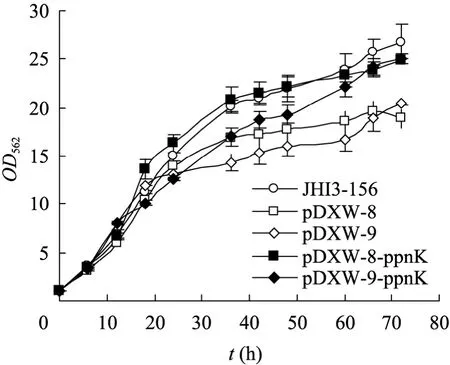
圖2 乳糖發酵短桿菌搖瓶發酵生長曲線Fig.2 Cell growth of fiveBrevibacterium lactofermentumstrains.
在出發菌和兩株空載菌中ATP-NAD+激酶的酶活力較低,而在ppnK表達菌中,酶活顯著提高,其中ppnK組成型表達菌的ATP-NAD+激酶酶活 (7.67±0.65 U/g) 比 pDXW-9空 載 菌(2.40±0.23 U/g) 提高了2.20倍,ppnK誘導型表達菌的酶活 (4.33±0.74 U/g) 比pDXW-8空載菌(2.36±0.72 U/g) 提高了83.5%,說明ppnK基因的表達提高了細胞內NAD激酶活力。
2.2.3 重組菌的胞內輔酶含量
由于6~36 h是菌體的快速生長期 (圖2),而JHI3-156/pDXW-8-ppnK在發酵10 h進行誘導表達,于是我們檢測了發酵24 h時各菌株胞內的4種輔酶含量,結果見表3。
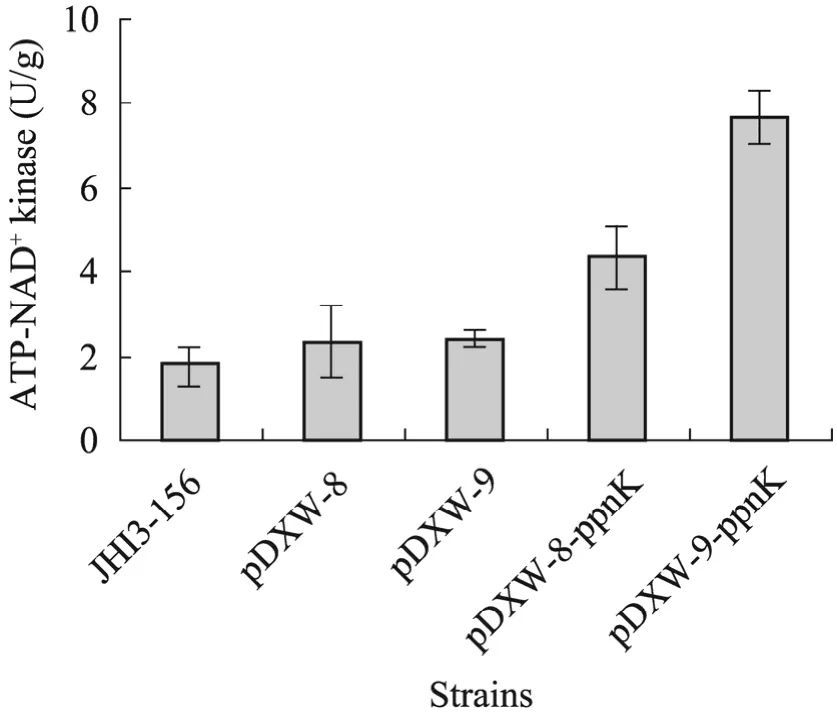
圖3 發酵菌株細胞內的ATP-NAD+激酶活性Fig.3 ATP-NAD+kinase activities of fiveBrevibacterium lactofermentumstrains.
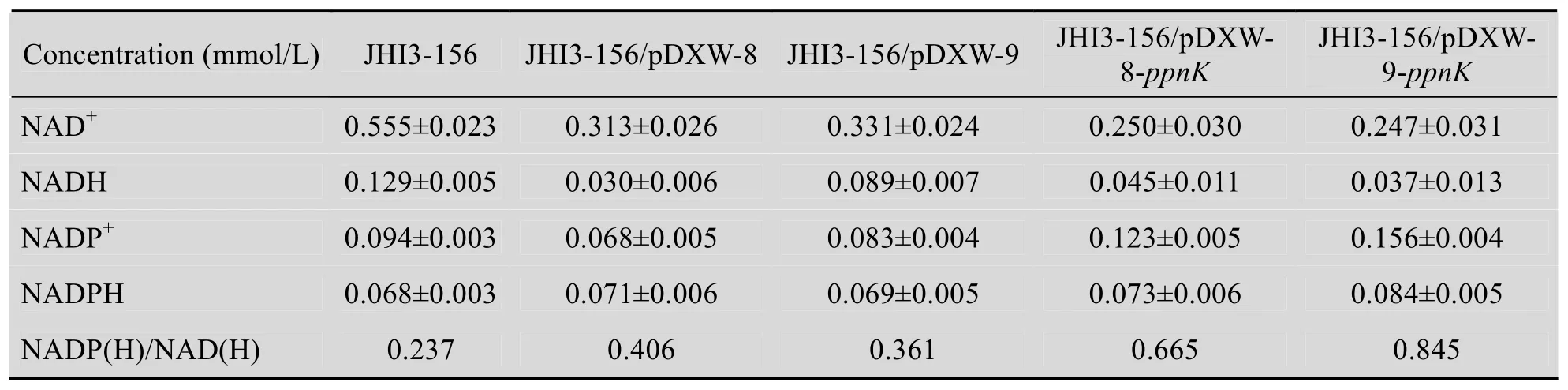
表3 乳糖發酵短桿菌發酵24 h時的細胞內輔酶含量Table 3 Intracellular NAD+, NADH, NADP+, and NADPH concentrations of fiveBrevibacterium lactofermentumstrains after fermentation for 24 h
由表3可知:發酵24 h,ppnK誘導表達菌的細胞內 NADP+濃度比 pDXW-8空載菌高80.9%,輔酶Ⅱ(NADP++NADPH) 與輔酶Ⅰ(NAD++NADH) 的比例比空載菌高63.8%,比出發菌JHI3-156高1.80倍;ppnK組成型表達菌的細胞內NADP+濃度比pDXW-9空載菌高88.0%,NADPH濃度比空載菌高21.7%,而輔酶Ⅱ與輔酶Ⅰ的比例比空載菌高1.34倍,比JHI3-156高2.56倍。說明在發酵24 h時,重組菌中ppnK基因的過量表達和NAD激酶酶活的提高促進了胞內輔酶Ⅱ的合成,其中ppnK基因的組成型表達更有利于提高細胞內NADP+與NADPH的供應。
2.2.4 重組菌發酵后的氨基酸含量
最后我們檢測了發酵過程中重組菌和出發菌的發酵液中葡萄糖和 L-異亮氨酸含量變化(圖 4)。
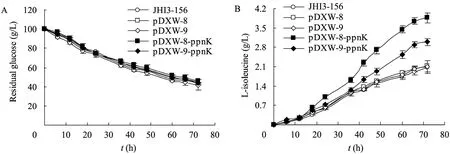
圖4 乳糖發酵短桿菌搖瓶發酵過程曲線Fig.4 Process curves of fiveBrevibacterium lactofermentumstrains. (A) Concentration of glucose. (B) Concentration of L-isoleucine.
從圖4中可以看出,5株菌株消耗葡萄糖的規律是基本一致的,在發酵過程的12~48 h快速消耗葡萄糖;5株菌株的L-異亮氨酸積累進程則存在較大差異,在發酵12 h前各個菌株僅合成少量的L-異亮氨酸,在18 h后,添加誘導劑的誘導表達菌的 L-異亮氨酸合成速率開始高于其他菌株,在24 h后產量開始明顯增加,而在36 h后組成型表達菌也開始以較快的速度積累 L-異亮氨酸。在發酵72 h后,ppnK誘導表達菌的L-異亮氨酸產量 (3.86±0.12 g/L) 比pDXW-8空載菌 (2.11±0.21 g/L) 提高了82.9%,而ppnK組成型表達菌的L-異亮氨酸產量 (2.99±0.18 g/L) 比pDXW-9空載菌 (2.11±0.23 g/L) 提高了41.7%,且分別比出發菌 JHI3-156 (2.08±0.20 g/L) 提高了85.6%和43.8%,說明通過表達ppnK基因來提高胞內NADP+和NADPH的供應有利于L-異亮氨酸的積累。與空載菌和出發菌相比,ppnK表達菌的糖酸轉化率也顯著提高,尤其是ppnK誘導表達菌 (0.0719 g/g) 比出發菌 (0.0377 g/g)和空載菌 (0.0370 g/g) 分別提高了 90.7%和94.3%,而ppnK組成表達菌 (0.0534 g/g) 比出發菌和空載菌 (0.0358 g/g) 分別提高了 41.6%和49.2%。ppnK表達菌的異亮氨酸產率 (異亮氨酸產量/細胞干重) 也得到一定程度的提高。ppnK誘導表達菌為 0.289 g/g,組成表達菌為0.222 g/g,都比出發菌JHI3-156 (0.142 g/g) 有了較大的提高,但與對應的空載菌 JHI3-156/pDXW-8 (0.223 g/g) 和 JHI3-156/pDXW-9(0.201 g/g) 相比,提高幅度分別降至 29.6%和10.4%,這與空載菌生長速率較慢有關。
3 結論
本研究構建了 2個重組質粒 pDXW-8-ppnK和pDXW-9-ppnK以及4株重組乳糖發酵短桿菌JHI3-156/pDXW-8,JHI3-156/pDXW-9,JHI3-156/pDXW-8-ppnK和JHI3-156/pDXW-9-ppnK。搖瓶發酵時,雖然2株空載菌的生長速率略微降低,但2株ppnK基因表達菌的菌體生長狀態良好,說明 NAD激酶的表達有利于細胞的生長。與JHI3-156/pDXW-8相比,ppnK誘導表達菌的胞內 ATP-NAD+激酶的酶活提高了 83.5%,發酵24 h時胞內NADP+濃度提高了80.9%,NADPH濃度提高了21.7%,輔酶Ⅱ與輔酶Ⅰ的比例提高了63.8%,最終L-異亮氨酸產量提高了82.9%。與JHI3-156/pDXW-9相比,ppnK組成型表達菌的胞內ATP-NAD+激酶的酶活提高了2.20倍,發酵24 h時胞內NADP+濃度提高了88.0%,輔酶Ⅱ與輔酶Ⅰ的比例提高了 1.34倍,最終 L-異亮氨酸產量提高了41.7%。2株重組菌的異亮氨酸產量、產率和得率都高于出發菌株。
這些結果表明,過量表達谷氨酸棒桿菌NAD激酶,能夠提高發酵細胞內輔酶Ⅱ的含量,為L-異亮氨酸的合成提供更為充足的必需還原力,推動L-異亮氨酸積累,同時也抵消了負荷載體對細胞生長的不利影響。與ppnK的誘導表達相比,雖然ppnK的組成型表達更有利于輔酶Ⅱ的合成,但對 L-異亮氨酸合成的促進作用卻不如前者,一部分原因可能在于外源基因的組成型表達對細胞正常代謝造成影響,因為菌體在不同的生長時期對輔酶Ⅱ的需求量是不同的,而輔酶Ⅱ與輔酶Ⅰ的比例也對發酵進程產生影響,組成型表達所產生的輔酶影響了菌體各個時期胞內輔酶含量平衡,影響了細胞內的代謝流向。
而本研究證明在細胞快速生長到一定程度后再過量表達NAD激酶,有助于產生的輔酶Ⅱ更多地被L-異亮氨酸合成途徑所利用,從而達到更好的輔酶供應調控效果。說明在L-異亮氨酸合成時,雖然輔酶Ⅱ的積累有利于產量提高,但也應根據代謝途徑對輔酶的形式和含量的動態需求,通過調整NAD激酶表達的強度和表達的階段性等方面,來滿足L-異亮氨酸積累時所需要的輔酶量。對此,未來將進行小試發酵罐的實驗,測定在良好的發酵環境下,兩株重組菌及對照菌株生長、糖耗和產酸的情況,并進行全面分析,希望能得到更有價值的結論。
本文報道了利用NAD激酶來提高乳糖發酵短桿菌的L-異亮氨酸產量。分析了誘導型和組成型表達NAD激酶對發酵菌株的生長,NAD激酶酶活,輔酶含量和氨基酸產量的影響。結果表明,通過過量表達輔酶Ⅱ合成關鍵酶,有助于提高NADP(H) 的供應,從而提高L-異亮氨酸產量,本研究為通過輔酶調控手段來提高合成途徑中NADPH的供應,進而運用于氨基酸生產提供了一定的參考。
REFERENCES
[1] Ahmed I, Khan MA. Dietary branched-chain amino acid valine, isoleucine and leucine requirements of fingerling Indian major carp,Cirrhinus mrigala(Hamilton). Br J Nutr, 2006, 96(3): 450?460.
[2] Murata K, Moriyama M. Isoleucine, an essential amino acid, prevents liver metastases of colon cancer by antiangiogenesis. Cancer Res, 2007,67(7): 3263?3268.
[3] Yoshizawa F. New therapeutic strategy for amino acid medicine: notable functions of branched chain amino acids as biological regulators. J Pharmacol Sci, 2012, 118(2): 149?155.
[4] Park JH, Lee SY. Fermentative production of branched chain amino acids: a focus on metabolic engineering. Appl Microbiol Biotechnol, 2010,85(3): 491?506.
[5] Guillouet S, Rodal AA, An G-H, et al. Expression of theEscherichia colicatabolic threonine dehydratase inCorynebacterium glutamicumand its effect on isoleucine production. Appl Environ Microbiol, 1999, 65(7): 3100-3107.
[6] Hashiguchi K, Takesada H, Suzuki E, et al.Construction of an L-isoleucine overproducing strain ofEscherichia coliK-12. Biosci Biotechnol Biochem, 1999, 63(4): 672?679.
[7] Guillouet S, Rodal AA, An GH, et al. Metabolic redirection of carbon flow toward isoleucine by expressing a catabolic threonine dehydratase in a threonine-overproducingCorynabacterium glutamicum. Appl Microbiol Biotechnol, 2001,57(5): 667–673.
[8] Takeno S, Murata R, Kobayashi R, et al.Engineering ofCorynebacterium glutamicumwith an NADPH-generating glycolytic pathway for L-lysine production. Appl Environ Microbiol,2010, 76(21): 7154–7160.
[9] Lee HC, Kim JS, Jang W, et al. High NADPH/NADP+ratio improves thymidine production by a metabolically engineeredEscherichia colistrain. J Biotechnol, 2010,149(1/2): 24?32.
[10] Bartek T, Blombach B, Z?nnchen E, et al.Importance of NADPH supply for improved L-valine formation inCorynebacterium glutamicum.Biotechnol Prog, 2010, 26(2): 361?371.
[11] Wang Z, Chen T, Ma X, et al. Enhancement of riboflavin production withBacillus subtilisby expression and site-directed mutagenesis ofzwfandgndgene fromCorynebacterium glutamicum.Bioresour Technol, 2011, 102(4): 3934?3940.
[12] Shi F, Li YF, Li Y, et al. Molecular properties,functions, and potential applications of NAD kinases. Acta Biochim Biophys Sin, 2009, 41(5):352?361.
[13] Kawai S, Fukuda C, Murata K. Function and structure of NAD kinase: the key enzyme for biosynthesis of NADP(H)]. Tanpakushitsu Kakusan Koso, 2007, 52(3): 243?248.
[14] Lindner SN, Niederholtmeyer H, Schmitz K, et al.Polyphosphate/ATP-dependent NAD kinase ofCorynebacteriumglutamicum: biochemical properties and impact ofppnKoverexpression on lysine production. Appl Microbiol Biotechnol,2010, 87(2): 583?593.
[15] Kr?mer JO, Heinzle E, Schr?der H, et al.Accumulation of homolanthionine and activation of a novel pathway for isoleucine biosynthesis inCorynebacterium glutamicumMcbR deletion strains. J Bacteriol, 2006, 188(2): 609?618.
[16] Peng ZJ, Fang J, Li JH, et al. Combined dissolved oxygen and pH control strategy to improve the fermentative production of L-isoleucine byBrevibacteriumlactofermentum. Bioprocess Biosyst Eng, 2010, 33(3): 339?345.
[17] Xu DQ, Tan YZ, Huan XJ, et al. Construction of a novel shuttle vector for use inBrevibacterium flavum, an industrial amino acid producer. J Microbiol Methods, 2010, 80(1): 86?92.
[18] Xu DQ, Tan YZ, Shi F, et al. An improved shuttle vector constructed for metabolic engineering research inCorynebacterium glutamicum. Plasmid,2010, 64(2): 85?91.
[19] Shi F, Kawai S, Mori S, et al. Identification of ATP-NADH kinase isozymes and their contribution to supply of NADP(H) inSaccharomyces cerevisiae. FEBS J, 2005, 272(13): 3337?3349.
[20] Li ZJ, Cai L, Wu Q, et al. Overexpression of NAD kinase in recombinantEscherichia coliharboring thephbCABoperon improves poly(3-hydroxybutyrate) production. Appl Microbiol Biotechnol, 2009, 83(5): 939?947.
Overexpression ofCorynebacterium glutamicumNAD kinase improves L-isoleucine biosynthesis
Xiaojing Huan1,2, Kun Li1,2, Feng Shi1,2, and Xiaoyuan Wang1,2
1State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi214122,Jiangsu,China
2Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi214122,Jiangsu,China
還曉靜, 李坤, 史鋒, 等. 谷氨酸棒桿菌 NAD 激酶的過表達對 L-異亮氨酸合成的促進作用. 生物工程學報, 2012, 28(9):1038?1047.
Huan XJ, Li K, Shi F, et al. Overexpression ofCorynebacterium glutamicumNAD kinase improves the L-isoleucine biosynthesis. Chin J Biotech, 2012, 28(9): 1038?1047.
Received:December 21, 2011;Accepted:March 15, 2012
Supported by:National Natural Science Foundation of China (No. 30870056).
Corresponding author:Feng Shi. Tel/Fax: +86-510-85329236; E-mail: shifeng@jiangnan.edu.cn
國家自然科學基金 (No. 30870056) 資助。

