轉錄因子Oct-4在胃癌中的表達及意義
曹夢苒,謝劍明,劉斐燁
(1解放軍第八一醫院,南京210002;2南方醫科大學南方醫院)
胃癌是我國最常見的惡性腫瘤之一,近年來其發病率和病死率有逐漸上升的趨勢。近年來,有學者認為,腫瘤干細胞是惡性腫瘤發生的起動細胞,其數量與腫瘤的發生、發展、生物學行為等密切相關[1,2]。因此,對胃癌中干細胞的鑒定,有助于進一步了解胃癌的發生機制,對胃癌的靶向治療也有一定的指導作用。轉錄因子Oct-4是一種干細胞相關標志物,是細胞分化全能性的標記。本研究應用免疫組化方法檢測Oct-4在胃癌組織中的表達,探討Oct-4表達對胃癌腫瘤干細胞的鑒定價值,并分析了Oct-4陽性表達程度與胃癌臨床及病理學特征的關系。
1 材料與方法
1.1 材料
1.1.1 標本 蠟塊標本均由解放軍第八一醫院病理科(2008年3月~2010年6月)提供。胃癌組:共42例,其中男27例、女15例,年齡45~71歲、中位年齡53歲。病理學類型包括乳頭狀腺癌8例、管狀腺癌28例、其他類型癌6例(其中黏液腺癌4例、印戒細胞癌2例);高分化腺癌8例、中分化腺癌15例、低分化腺癌19例。腫瘤臨床分期參照TNM國際分期(AJCC,2002年)標準,其中T14例、T215例、T316例和T47例,無淋巴結轉移者20例、有轉移者22例;手術時已有遠處轉移者共11例。癌旁組織:所有42例胃癌手術切除標本中均含癌旁正常組織。
1.1.2 主要試劑 兔抗人Oct-4多克隆抗體購自福州邁新公司;Envision檢測試劑盒(兔/鼠)購自上海基因公司。
1.2 Oct-4表達檢測 ①免疫組化:采用Envision兩步法,嚴格按照試劑盒說明書進行操作。②陽性表達判斷:Oct-4的免疫組化陽性產物為胞質和(或)胞膜內的棕黃色顆粒。每張切片隨機選取3~4個高倍視野觀察,計算陽性表達率。③陽性表達程度判斷:按照染色強度及陽性細胞數占腫瘤細胞總數的百分比綜合計分。染色強度:無色計為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分;陽性細胞數:小于總數的5%計為0分,5%~25%為1分,26%~50%為2分,50%以上為3分。染色強度評分與陽性細胞數評分相乘即為組織學評分,0分計為陰性(-),1~3分計為弱陽性(+),4~5分計為中度陽性(++),≥6分以上計為強陽性(++ +)。以組織學評分(+++)定義為陽性表達。
1.3 相關指標分析 分析腫瘤組織與癌旁正常組織中Oct-4表達的差異性;分析腫瘤組織Oct-4的表達與患者年齡、性別、腫瘤分期、分化程度、轉移情況等因素的相關性。
1.4 統計學方法 采用SPSS13.0軟件進行統計學處理。組間Oct-4陽性率比較、各臨床病理學指標與Oct-4陽性表達程度的比較均采用χ2檢驗;以P≤0.05為差異有統計學意義。
2 結果
2.1 胃癌組織及癌旁正常組織中Oct-4的表達情況 胃癌組織中,Oct-4免疫組化陽性產物定位于胞質和(或)胞膜,偶見細胞核染色(插頁Ⅲ圖12~13)。免疫組化檢測結果顯示,胃癌組織、癌旁正常組織中Oct-4的陽性表達率分別為71.4%和9.5%,P<0.05。
2.2 Oct-4陽性表達與腫瘤臨床病理特征的關系見表1。
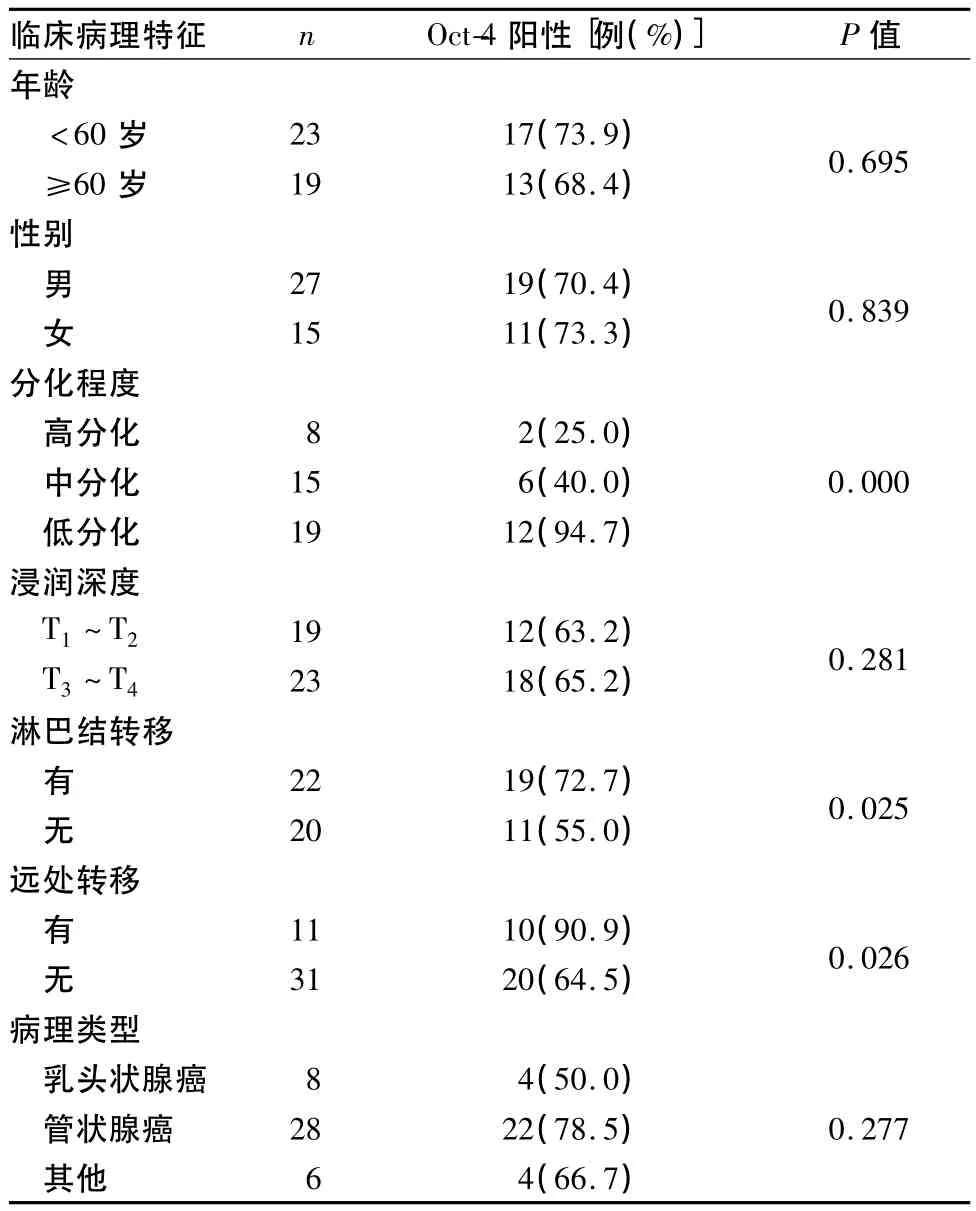
表1 Oct-4的表達與胃癌臨床病理特征的關系
3 討論
近年來,有學者提出了腫瘤干細胞的概念,認為腫瘤組織中可能存在一小群有干細胞特征的、具有自我更新和多向分化潛能的腫瘤干細胞,它們的不斷自我更新和擴增促成了腫瘤的生長、轉移和復發[3]。基于這種觀點,檢測調控干細胞自我更新的關鍵因素在腫瘤中的表達狀況具有非常重要的意義。
Oct-4是 POU結構域轉錄因子家族中的一員[4],它能夠維持干細胞的多能性和自我更新,通過結合靶基因調控區,選擇性地抑制分化基因表達或促進多能性基因表達[5]。Oct-4通常只在多能干細胞中表達,在分化細胞中的表達大幅下降或缺如[6],且它的表達水平直接影響了干細胞的分化方向[7]。Oct-4還通過調控下游靶基因而參與正常發育過程,尤其在早期胚胎發育中起重要作用。除此之外,Oct-4對特異性靶基因具有抑制作用,對轉錄也有激活作用。近年來,Oct-4成為腫瘤干細胞理論研究的一個熱點,被認為是全能性或多能性干細胞的標志物。
Oct-4不僅在生殖細胞腫瘤中表達,在膀胱癌、肺癌、視網膜母細胞瘤、前列腺癌、精原細胞瘤、中樞神經系統生殖細胞腫瘤及許多腫瘤細胞株內均檢測到其表達[8~11],這提示Oct-4在腫瘤形成和保持腫瘤干細胞特性方面具有重要的作用,似乎可作為檢測腫瘤干細胞或腫瘤起始細胞的重要標記物。近年來,有學者發現Oct-4的表達水平與一些上皮性惡性腫瘤如膀胱癌、胰腺癌等的發生密切相關,并影響這些惡性腫瘤的生物學行為、轉移、復發、治療及預后,Oct-4高表達者通常進展快、轉移率高、預后差[12]。
本研究顯示,Oct-4蛋白在胃癌組織中的表達高于癌旁組織,表明胃癌組織中可能含有腫瘤干細胞,進一步為腫瘤發生的腫瘤干細胞學說提供了證據。癌旁組織中Oct-4蛋白的表達與腫瘤干細胞的關系尚不明確,考慮可能與胃癌對周圍組織的高浸潤性有關。從本研究的結果中還可看出,Oct-4的表達水平與腫瘤的分化程度及遠處轉移情況有關,Oct-4在中—低分化腫瘤組織中的陽性表達率高于高分化者,這與國外學者的研究結果一致[13]。由此可見,Oct-4的陽性表達率隨著腫瘤分化程度的降低而升高,提示不同分化程度的胃癌組織中均存在數量不等腫瘤干細胞,且分化越低的腫瘤組織中存在的腫瘤干細胞越多,這些細胞通過自我更新和多向分化導致腫瘤的復發和轉移。同樣,我們也未能觀察到Oct-4的表達與淋巴結轉移情況、腫瘤浸潤深度(T分期)及腫瘤病理類型之間的相關性,提示Oct-4可能只是腫瘤發生的一個早期事件,一旦腫瘤發生開始啟動后可能會有更多的因素參與腫瘤的發生和發展。此外,在早期出現遠處轉移的患者中,Oct-4的陽性表達率也較無轉移者升高,說明Oct-4表達陽性的細胞具有更高的侵襲性,腫瘤的惡性程度更高、更易向遠處轉移,從而使患者的預后進一步轉差。因此,Oct-4的表達水平可能是評價胃癌發展和預后的有用指標。
綜上所述,Oct-4可能是一種新的原癌基因,可作為胃癌的新型分子標志之一,在診斷、預后判斷及療效預測方面都具有重要意義,值得進一步深入研究。
[1]Peacock CD,Wang Q,Gesell GS,et al.Hedgehog signaling maintains a tumor stem cell compartment in multiple myeloma[J].Proc Natl Acad Sci U S A,2007,104(10):4048-4053.
[2]Inagaki A,Soeda A,Oka N,et al.Long-term maintenance of brain tumor stem cell properties under at non-adherent and adherent cul-ture conditions[J].Biochem Biophys Res Commun,2007,361 (3):586-592.
[3]Al-Hajj M,Clarke MF.Self-renewal and solid tumor stem cells[J].Oncogene,2004,23(43):7274-7282.
[4]Trosko JE.From adult stem cells to cancer stem cells:Oct-4 Gene,cell-cell communication,and hormones during tumor promotion[J].Ann N Y Acad Sci,2006,1089:36-58.
[5]周一葉,曾凡一.維持胚胎干細胞多能性和自我更新的轉錄因子Oct-4/Nanog以及相關的調控網絡[J].遺傳,2008,30(5): 529-536.
[6]Yu H,Fang D,Kumar SM,et al.Isolation of a novel population of multipotent adult stem cells from human hair follicles[J].Am J Pathol,2006,168(6):1879-1888.
[7]Buitrago W,Roop DR.Oct-4:the almighty POUripotent regulator[J].J Invest Dermatol,2007,127(2):260-262.
[8]Atlasi Y,Mowla SJ,Ziaee SA,et al.OCT-4,an embryonic stem cell marker,is highly expressed in bladder cancer[J].Int J Cancer,2007,120(7):1598-1602.
[9]Karoubi G,Gugger M,Schmid R,et al.OCT4 expression in human non-small cell lung cancer:implications for therapeutic intervention[J].Interact Cardiovasc Thorac Surg,2009,8(4):393-397.
[10]Seigel GM,Hackam AS,Ganguly A,et al.Human embryonic and neuronal stem cell markers in retinoblastoma[J].Mol Vis,2007,13:823-832.
[11]Sotomayor P,Godoy A,Smith GJ,et al.Oct4A is expressed by a subpopulation of prostate neuroendocrine cells[J].Prostate,2009,69(4):401-410.
[12]Romano G.The role of adult stem cells in carcinogenesis[J].Drug News Perspect,2005,18(9):555-559.
[13]Chen Z,Xu WR,Qian H,et al.Oct4,a novel marker for human gastric cancer[J].J Surg Oncol,2009,99(7):414-419.

