吸煙2型糖尿病大鼠葡萄糖轉運子4的表達
王曉蕾 時藝珊 鞠 巍
(沈陽醫學院沈洲醫院內分泌科,遼寧 沈陽 110002)
目前,糖尿病和糖尿病前期在中國普通成年人群中高度流行,嚴重危害人民身體健康[1]。2007年中國糖尿病患者人數已達3980萬,預計2025年將達到5930萬[1]。對糖尿病易患因素及其發病機制的研究已經引起學者們的廣泛關注。目前認為,吸煙是導致人群多種疾病發生發展和死亡的重要影響因素。已有研究表明,吸煙與糖尿病(尤其2型糖尿病)的發病有明確關系[2]。本研究通過觀察吸煙2型糖尿病大鼠肌肉組織中葡萄糖轉運子4(glucose transporter 4,GLUT4)的表達情況,分析吸煙對2型糖尿病發病的影響。
表1 第8周及第12周時三組指標比較(±s)
注:1)與8周正常對照組相比,差別有統計學意義,P<0.05;2)與8周2型糖尿病非吸煙組相比,差別有統計學意義,P<0.05;3)與8周2型糖尿病吸煙組相比,差別有統計學意義,P<0.05;4)與12周正常對照組相比,差別有統計學意義,P<0.05;5)與12周2型糖尿病非吸煙組相比,差別有統計學意義,P<0.05
2型糖尿病吸煙組12周(n=20)空腹血糖(mmol/L) 5.00±0.02 9.48±0.071) 9.26±0.091) 5.03±0.03 9.22±0.041)4) 11.01±0.111)2)3)4)5)空腹胰島素(mU/L) 8.84±0.27 20.36±3.021) 19.77±2.681) 9.44±1.34 21.13±2.171)4) 25.65±3.531)2)3)4)5)胰島素抵抗指數 2.16±0.04 7.95±0.281) 7.92±1.211) 2.25±0.08 8.04±0.281)4) 12.53±1.561)2)3)4)5)GHbA1c(%) 4.29±0.34 8.01±0.241) 7.85±0.311) 4.76±0.32 8.12±0.421)4) 8.34±0.461)4)TC(mmol/L) 1.08±0.06 1.70±0.071) 1.69±0.121) 1.10±0.06 1.73±0.101)4) 1.79±0.031)4)TG(mmol/L) 0.48±0.05 1.21±0.071) 1.29±0.131) 0.56±0.02 1.31±0.111)4) 1.35±0.091)4)LDL-C(mmol/L) 0.45±0.03 0.76±0.041) 0.72±0.051) 0.48±0.01 0.81±0.041)4) 1.16±0.061)2)3)4)5)HDL-C(mmol/L) 0.98±0.01 0.76±0.06 0.79±0.05 0.86±0.04 0.68±0.051)4) 0.67±0.021)4)指標 正常對照組8周(n=20)2型糖尿病非吸煙組8周(n=20)2型糖尿病吸煙組8周(n=20)正常對照組12周(n=20)2型糖尿病非吸煙組12周(n=20)
1 材料與方法
1.1 材料
1.1.1 實驗動物及分組
取60只Wistar大鼠(購自中國醫科大學),8周齡,雄性,清潔級。體質量130~200g。去除體重差異較大的大鼠,隨機分配為3組。①正常對照組20只。②2型糖尿病非吸煙組20只。③2型糖尿病吸煙組20只。
1.1.2 主要設備及試劑
顆粒飼料(購自中國醫科大學);高糖高脂飼料(自配);鏈脲佐菌素(streptoztocin, STZ,美國Sigma公司);香煙為市售X牌香煙,尼古丁含量1mg/支,焦油含量18mg/支。RNA提取試劑盒、cDNA合成試劑盒及RT-PCR試劑盒(美國Ambion公司)。引物由大連寶生物工程有限公司合成。日立7170全自動生化儀(日本日立公司);PCR儀(德國Biometra公司);Chemi Imager 5500凝膠圖像系統(美國Alpha Innotech公司)。
1.2 方法
1.2.1 動物模型建立
①確定胰島素抵抗動物模型:三組大鼠均每籠3~4只,飼養7周,室溫21~26℃,濕度50~60oC,12h光照周期,動物室內每天清掃消毒。正常對照組予普通飼料喂養,2型糖尿病吸煙組及2型糖尿病非吸煙組給予高糖高脂飼料喂養。飲水為純凈水。三組均喂養7周。②小劑量STZ靜脈注射誘導2型糖尿病模型[3]:2型糖尿病吸煙組及2型糖尿病非吸煙組大鼠尾靜脈注射STZ 15 mg/kg(以pH值4.5的0.1 mmol/L枸櫞酸鈉緩沖液配成0.3%濃度),對照組僅注射枸櫞酸鈉緩沖液。三組繼續原飼料喂養1周后檢測血糖及胰島素等指標,根據隨機血糖>16.7 mmol/L確定2型糖尿病動物模型[4],2型糖尿病吸煙組及2型糖尿病非吸煙組共40只大鼠均造模成功。③將2型糖尿病吸煙組大鼠20只關進自制“被動吸煙箱”內。箱上方有通風口與外界相通,側壁有與香煙直徑相通的孔,點燃的香煙煙霧由側壁孔擴散至整個箱內。大鼠在此環境中吸煙,每天吸煙2次,兩次間隔4h,每次30min。2型糖尿病非吸煙組及對照組大鼠同時也被關進“吸煙箱”,相同時間,不輸入香煙煙霧。共4周后檢測三組血糖及胰島素等指標進行比較。整個實驗過程中各組大鼠均無死亡。
1.2.2 指標測定
空腹血糖及胰島素、糖化血紅蛋白、血脂檢查均為禁食水12h后尾靜脈采血測定。①血糖測定:第8周、第12周各測一次空腹血糖。②第8周、第12周各測一次空腹胰島素水平。計算胰島素抵抗指數。胰島素抵抗指數=空腹血漿血糖(mmol/L)×空腹血清胰島素(mU/L)/22.5[5]。③第8周、第12周各測一次糖化血紅蛋白(glycated hemoglobin A1c,GHbA1c)。④第8周、第12周各測一次血脂,包括血清總膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白膽固醇(low density lipoprotein cholesterin,LDL-C)、高密度脂蛋白(high density lipoprotein cholesterin,HDL-C)。
1.2.3 PCR法檢測GLUT4的表達
實驗12周時三組大鼠均處死。①取骨骼肌組織冷凍保存。②應用RNA提取液提取總RNA。按試劑盒說明合成cDNA。③設計GLUT4正向和反向引物:上游5'-GCGTGGGTTTCGTGCTTT-3',下游5'-GGTAGTTCCCGATGGCTC-3',擴增產物片斷長度為154 bp。④按試劑盒操作規程進行競爭性RT-PCR反應。采用競爭性引物混合物(primer∶competimer 比例 2∶8),在擴增目標基因的同時擴增rRNA(489 bp)作為內對照。PCR循環擴增條件為94oC預熱3min,94oC變性30s,56oC退火30s,72oC延伸60s。循環30個周期后72oC延伸4min。⑤2%瓊脂糖凝膠電泳,溴化乙錠染色。紫外燈下觀察, 拍照。應用密度測定系統測定分析電泳帶的密度。
1.3 統計學分析
數據統計應用SPSS17.0軟件對數據進行統計處理,數據以(±s)表示。多組間均數比較采用單因素方差分析,兩組間均數采用T檢驗,單因素相關分析應用Pearson相關分析,P<0.05有統計學差異。
2 結 果
2.1 第8周2型糖尿病造模成功,2型糖尿病吸煙組及2型糖尿病非吸煙組空腹血糖及胰島素水平、胰島素抵抗指數、GHbA1c、TC、TG、LDL-C均明顯高于對照組,結果有統計學意義,P<0.05。第12周2型糖尿病吸煙組及2型糖尿病非吸煙組空腹血糖及胰島素水平、胰島素抵抗指數、GHbA1c、TC、TG、LDL-C均明顯高于對照組,HDL-C明顯低于對照組結果有統計學意義,P<0.05;2型糖尿病吸煙組空腹血糖及胰島素水平、胰島素抵抗指數、LDL-C水平均明顯高于2型糖尿病非吸煙組,結果有統計學意義,P<0.05(表1)。
2.2 第12周時取三組大鼠骨骼肌組織,PCR法檢測GLUT4表達。2型糖尿病吸煙組及2型糖尿病非吸煙組GLUT4表達均明顯低于對照組,2型糖尿病吸煙組GLUT4表達明顯低于2型糖尿病非吸煙組。2型糖尿病非吸煙組較對照組下調3.4倍,2型糖尿病吸煙組較對照組下調9.8倍,結果有統計學意義,P<0.05。GLUT4表達與三組胰島素抵抗指數水平呈顯著負相關(相關系數為–0.825,P<0.01)。(見表2及圖1)。
表2 第12周時三組胰島素抵抗指數及GLUT4比較(±s)
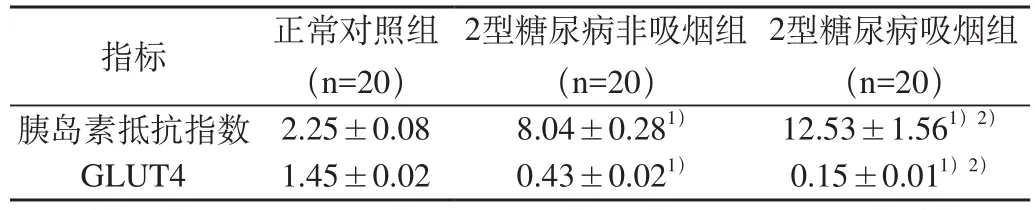
表2 第12周時三組胰島素抵抗指數及GLUT4比較(±s)
注:1)與正常對照組相比,差別有統計學意義,P<0.05;2)與2型糖尿病非吸煙組相比,差別有統計學意義,P<0.05
2型糖尿病吸煙組(n=20)胰島素抵抗指數 2.25±0.08 8.04±0.281) 12.53±1.561)2)GLUT4 1.45±0.02 0.43±0.021) 0.15±0.011)2)指標 正常對照組(n=20)2型糖尿病非吸煙組(n=20)
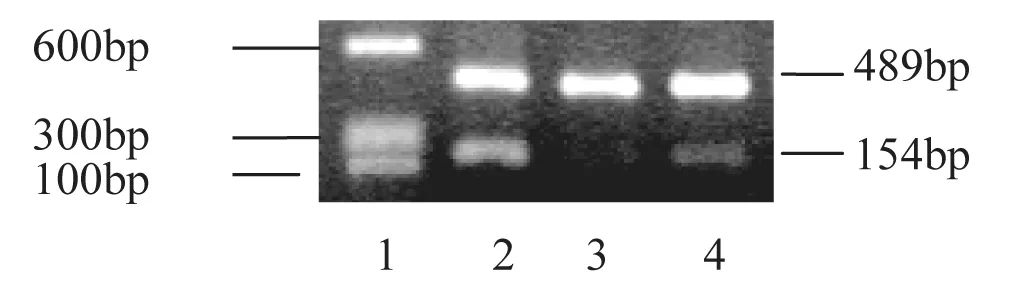
圖1 第12周時三組大鼠骨骼肌組織GLUT4表達比較
3 討 論
世界范圍內,吸煙是人類的一個重要死亡原因[6]。吸煙與腫瘤、心腦血管疾病、糖尿病等疾病發病均有重要關系[7,8]。流行病學調查顯示,戒煙成功可降低人群病死率,但既往吸煙史所帶來的不良影響仍會持續數年,糖尿病患者表現更為突出[8]。
吸煙通過多種機制影響糖尿病的發生發展,包括胰島素抵抗、胰島β細胞損傷等,其中胰島素抵抗為其主要方面[9],而胰島素抵抗是2型糖尿病的重要發病機制。本研究通過高糖高脂飼料喂養及靜脈注射STZ誘導方法成功制備出2型糖尿病大鼠模型,并通過計算胰島素抵抗指數對其胰島素抵抗程度進行評價。而后將2型糖尿病吸煙組大鼠置于吸煙箱內繼續觀察。研究發現,試驗12周時吸煙2型糖尿病大鼠的空腹血糖及胰島素水平均明顯高于2型糖尿病非吸煙組和對照組,胰島素抵抗指數明顯增高,說明吸煙確實能夠加重胰島素抵抗,促進2型糖尿病的發生發展。
胰島素抵抗主要表現為外周組織對葡萄糖的攝取利用下降。吸煙可通過多種途徑加重胰島素抵抗,包括脂代謝紊亂及肥胖;血管內膜損傷;胰島素受體敏感性受損等[10]。同時,尼古丁還可以通過興奮交感神經系統進而妨礙葡萄糖轉運[10]。葡萄糖轉運能力是葡萄糖利用的關鍵步驟,葡萄糖轉運系統的損傷可以導致胰島素抵抗[11]。本研究中第12周時取三組大鼠骨骼肌組織,PCR法檢測GLUT4表達。2型糖尿病吸煙組及2型糖尿病非吸煙組GLUT4表達均明顯低于對照組,而2型糖尿病吸煙組較2型糖尿病非吸煙組GLUT4表達減低更加明顯,且與三組胰島素抵抗指數水平呈顯著負相關,說明骨骼肌組織中GLUT4的表達與胰島素抵抗及2型糖尿病的發生發展密切相關。GLUT4是一種跨膜轉運蛋白,廣泛分布于對胰島素敏感的骨骼肌、心肌、脂肪及腎小球系膜細胞、入球小動脈平滑肌段的上皮細胞等細胞中[12,13]。研究表明,GLUT4在葡萄糖轉運的過程中起著重要作用[14],其表達水平與骨骼肌、脂肪組織等的胰島素抵抗情況密切相關,可影響2型糖尿病的發生和發展[15]。而本研究提示,長期吸煙可能通過減低骨骼肌組織中GLUT4的表達水平增加胰島素抵抗,促進2型糖尿病的進展。
通過本試驗研究我們得出結論,吸煙可通過降低骨骼肌GLUT4的表達增加胰島素抵抗,促進2型糖尿病的發生和發展,危害人類健康。因此,我們積極倡導廣泛戒煙,養成良好生活方式,對早期預防2型糖尿病具有積極意義。
[1]Yang SH,Dou KF,Song WJ.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(25):2425-2426.
[2]Sairenchi T,Iso H,Nishimura A,et al.Cigarette smoking and risk of type 2 diabetes mellitus among middle-aged and elderly Japanese men and women[J].Epidemiol,2004,160(2):158-162.
[3]Amin KA,Awad EM,Nagy MA.Effects of panax quinquefolium on streptozotocin-induced diabetic rats: role of C-peptide,nitric oxide and oxidative stress[J].Int J Clin Exp Med,2011,4(2):136-147.
[4]Park SH,Bahk JH,Oh AY,et al.Gender difference and change of α(1)-adrenoceptors in the distal mesenteric arteries of streptozotocininduced diabetic rats[J].Korean J Anesthesiol,2011,61(5):419-427.
[5]Zadeh-Vakili A,Ramezani Tehrani F,Hosseinpanah F.Waist circumference and insulin resistance: a community based cross sectional study on reproductive aged Iranian women[J].Diabetol Metab Syndr,2011,3(1):18.
[6]Karter AJ,Stevens MR,Gregg EW,et al.Educational disparities in rates of smoking among diabetic adults: the translating research into action for diabetes study[J].Am j public health,2008,98(2):365-370.
[7]Park SL,Bastani D,Goldstein BY,et al.Associations between NBS1 polymorphisms,haplotypes and smoking-related cancers[J].Carcin ogenesis,2010,31(7):1264-1271.
[8]Yeh HC,Duncan BB,Schmidt MI,et al.Smoking,smoking cessation,and risk for type 2 diabetes mellitus: a cohort study[J].Ann Intern Med,2010,152(1):10-17.
[9]Anan F,Takahashi N,Shinohara T,et al.Smoking is associated with insulin resistance and cardiovascular autonomic dysfunction in type 2 diabetic patients[J].Eur J Clin Invest,1992,42(5):1086-1092.
[10]Xie XT,Liu Q,Wu J,et al.Impact of cigarette smoking in type 2 diabetes development[J].Acta Pharmacol Sin,2009,30(6):784-787.
[11]Garvey WT,Birnbaum M.Cellular insulin action and insulin resistance[J].Baillieres Clin Endocrinol Metab,1993,7(4):785-873.
[12]Desrois M,Sidell RJ,Gauguier D,et al.Initial steps of insulin signaling and glucose transport are defective in the type 2 diabetic rat heart[J].Cardiovasc Res,2005,289(4):E551-561.
[13]Briggs JP,Marcus RG,Barac-Nieto M,et al.Insulin-responsive glucose transporter expression in renal microvessels and glomeruli[J].Kidney Int,1992,42(5):1086-1092.
[14]Lauro D,Kido Y,Castle AL,et al.Impaired glucose tolerance in mice with a targeted impairment of insulin action in muscle and adipose tissue[J].Nat Genet,1998,20(3):294-298.
[15]Michelle FL,Poon V,Klip A.GLUT4 activation: thoughts on possible mechanisms[J].Acta Physiol Scand,2003,178(4):287-296.

