軟肝升白顆粒對硫代乙酰胺誘發大鼠肝硬化模型的影響
郭爭榮,劉金霞,程 志,候艷寧,李兵順,李敏然,孫殿興*
(1石家莊白求恩和平醫院,石家莊050082;2石家莊市人民醫院;3承德醫學院)
目前臨床上還缺乏確切有效的逆轉肝硬化藥物,研究者逐步發現許多傳統中草藥具有比較好的抗肝纖維化療效,以小柴胡湯、復方861合劑、復方鱉甲軟肝片、冬蟲夏草、甘草、丹參、苦參等一大批具有活血化瘀、軟堅散節功效的單方、復方中藥制劑為代表。中藥組方防治肝纖維化有比較光明的發展前景,它們以其多環節、多層次及多靶點的綜合作用,具有廣闊的開發和應用前景。2010年1月~2011年12月,為深入研究軟肝升白顆粒的療效和作用機制,通過建立硫代乙酰胺(TAA)誘導的大鼠肝硬化模型,采取不同時間和不同劑量分別觀察軟肝升白顆粒對肝纖維化大鼠血清谷丙轉氨酶(ALT)、層黏連蛋白(LN)、透明質酸(HA)含量的影響及肝組織改變,為臨床尋找肝硬化治療方案開辟新的治療途徑和方法[1]。
1 材料與方法
1.1 材料 清潔級Wistar大鼠100只,雄性,(180 ±20)g,由河北醫科大學動物實驗中心提供;TAA購買于Sigma公司、軟肝升白顆粒由白求恩國際和平醫院制劑科配制、復方鱉甲軟肝片由解放軍302醫院研制,內蒙古集寧制藥廠饋贈,生產批號20060609;HA、LN檢測試劑盒購自上海海軍醫學研究所。
1.2 肝纖維化模型的建立 肝硬化模型的制作應用TAA誘導法,TAA用精確度為1/萬的電子天平稱取并用飲用水稀釋。用0.03%TAA誘導飼喂[1],每1~2 d更換1次飲用水,確保藥物濃度的穩定,誘導時間20周。
1.3 分組和給藥 80只大鼠造模成功后,隨機分為4組,每組20只,高劑量治療組(A組)大鼠給予軟肝升白顆粒8 g/(kg·d)灌胃,低劑量治療組(B組)大鼠給予軟肝升白顆粒4 g/(kg·d)灌胃,陽性藥物對照組(C組)大鼠給予鱉甲軟肝片0.8 g/(kg ·d)灌胃,模型對照組(D組);另設20只大鼠為正常對照組(E組)。D組和E組分別給予等體積的生理鹽水灌胃。于造模結束后,停用TAA 1周,開始給予上述藥物治療,1次/d,灌胃給藥[2]。
1.4 標本留取和指標檢測 分別在治療后第4周和8周處死大鼠,腹主動脈取血,分離血清,檢測肝功能及肝纖維化指標,取部分肝組織,0.5 cm×0.5 cm×1 cm,10%甲醛固定,進行HE染色和天狼猩紅特染。HE染色光學顯微鏡下觀察,并進行Knodell評分[3]。天狼猩紅染色用偏振光顯微鏡下觀察Ⅰ型膠原情況,每個標本供觀察10個視野,并采用Photoshop軟件的Histogram功能分析統計各組織內Ⅰ型膠原所占面積的百分數,經圖像分析。剩余肝組織-80℃凍存,備用。檢測肝組織內羥脯氨酸的含量,采用胃酶酸解法[4],根據測得的A560和標準曲線計算出每克肝組織的羥脯氨酸的含量。
1.5 統計學方法 應用SAS8.0統計分析軟件,組間比較采用單因素方差分析,以P≤0.05為差異有統計學意義。
2 結果
2.1 肝纖維化大鼠肝臟組織形態學變化
2.1.1 HE染色 光鏡下正常組大鼠肝組織有完整的肝小葉結構,肝細胞多為單核,肝板呈條索狀,圍繞中央靜脈呈放射狀排列,無變性、壞死、炎癥細胞浸潤和纖維組織增生。D組大鼠停用TAA后4周時,肝組織可見大量肝細胞脂肪變性,呈空泡狀,胞質著色亦深,偏嗜堿性。另有水樣變性甚至氣球樣變,部分細胞出現異型性,肝細胞核增大,著色深或雙核。近90%標本可見散在的不同程度的壞死細胞,正常肝小葉結構遭到破壞;可見明顯的纖維組織增生,纖維間隔占整個視野2/3以上,增寬至2.5 mm以上,由匯管區、小葉間進一步深入并分割肝小葉、假小葉形成。匯管區、肝竇及中央靜脈周圍可見多形核白細胞、淋巴細胞、單核細胞及嗜酸性細胞等炎性細胞浸潤;停用TAA后8周時,肝細胞脂肪變性和肝組織纖維化程度有所恢復,但與其他各組不同時間的肝組織學變化仍有顯著性差異。A組可見肝纖維化明顯減輕,纖維間隔變細,肝細胞大小、形態接近正常,僅有少量空泡和氣球樣變,僅見少量炎癥細胞浸潤。B組和C組病理改變相似,肝組織內可見不同程度的炎癥細胞浸潤,變性壞死以脂肪變為主,形成空泡,但纖維間隔變窄。總之,纖維組織增生、肝細胞變性及炎癥反應較D組明顯減輕,但較A組抗纖維化效果差,見插頁Ⅱ圖9。各組Knodell評分結果見表1。
表1 大鼠在治療4周和8周時肝組織Knodell評分(±s)

表1 大鼠在治療4周和8周時肝組織Knodell評分(±s)
注:與D組比較,*P<0.05;與C組比較,#P<0.05;與B組比較,△P<0.05
組別 4周 8周A組 11.0±1.2*#△ 7.3±1.4*#△315.46 220.65 B組 13.3±2.0* 9.5±1.0*# C組 14.9±1.4* 11.9±1.7* D組 24.8±2.3 19.1±2.3 E組 0* 0* F值
2.1.2 天狼猩紅染色 A組和B組與D組比較,肝小葉結構破壞減輕,肝臟膠原纖維增生亦明顯減輕,纖維條索變細變窄,肝小葉結構恢復,匯管區和中央靜脈周圍膠原顯著減少,見插頁Ⅲ圖10,各組Ⅰ型膠原面積百分比見表2。
表2 大鼠在治療4周和8周時Ⅰ型膠原面積百分比(%,±s)
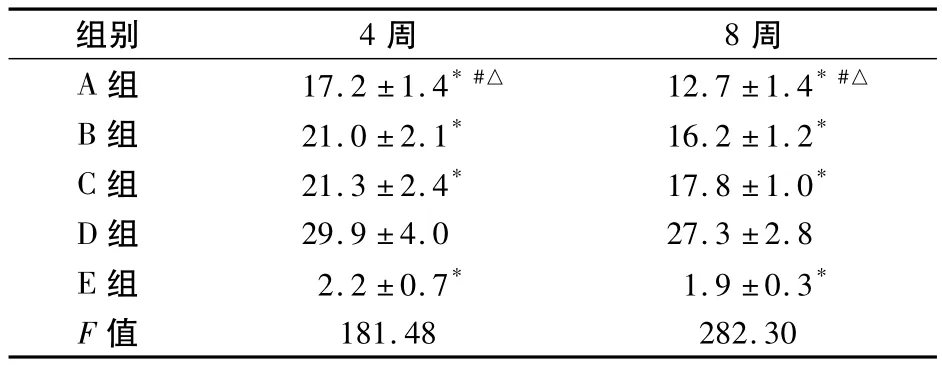
表2 大鼠在治療4周和8周時Ⅰ型膠原面積百分比(%,±s)
注:與D組比較,*P<0.05;與C組比較,#P<0.05;與B組比較,△P<0.05
組別 4周 8周A組 17.2±1.4*#△ 12.7±1.4*#△181.48 282.30 B組 21.0±2.1* 16.2±1.2* C組 21.3±2.4* 17.8±1.0* D組 29.9±4.0 27.3±2.8 E組 2.2±0.7* 1.9±0.3* F值
2.2 中藥對大鼠肝功能的影響 見表3。
表3 大鼠在治療4周和8周時血清ALT含量(U/L,±s)
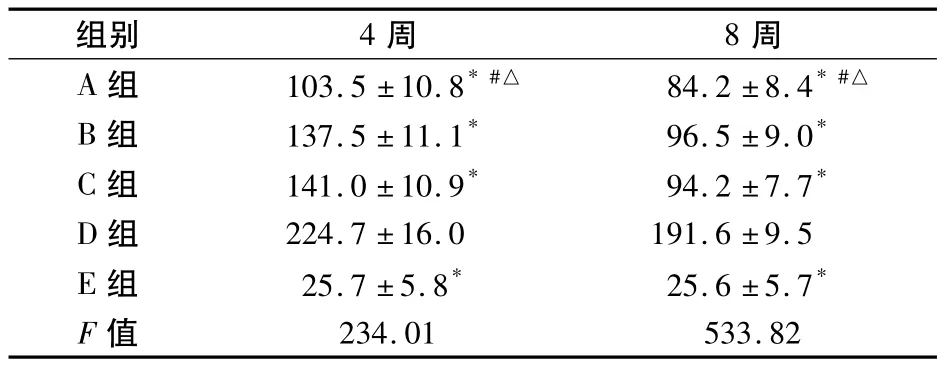
表3 大鼠在治療4周和8周時血清ALT含量(U/L,±s)
注:與D組比較,*P<0.05;與C組比較,#P<0.05;與B組比較,△P<0.05
組別 4周 8周A組 103.5±10.8*#△ 84.2±8.4*#△234.01 533.82 B組 137.5±11.1* 96.5±9.0* C組 141.0±10.9* 94.2±7.7* D組 224.7±16.0 191.6±9.5 E組 25.7±5.8* 25.6±5.7* F值
2.3 血清HA、LN的變化 見表4。
表4 各組不同時間血清HA、LN值(ng/mL,±s)

表4 各組不同時間血清HA、LN值(ng/mL,±s)
注:與D組比較,*P<0.05;與C組比較,#P<0.05;與B組比較,△P<0.05
組別HA 4周 8周LN 4周 8周A組 737.1±35.4*#△ 482.3±47.7*#△ 518.9±29.6*#△229.3±32.5*#△B組 1 047.0±84.8* 721.4±33.9* 776.2±38.0* 306.4±22.3* C組 1 001.9±78.2* 729.2±73.0* 822.5±39.7* 502.3±25.1* D組 1 328.9±80.4 1 028.4±69.9 1 014.8±79.5 797.8±57.4 E組 117.1±9.7* 116.2±12.8* 108.7±9.5* 109.8±8.8* F值498.07 418.29 593.45 652.99
2.4 中藥對肝組織中羥脯氨酸羥的影響 見表5。
表5 各組不同時間肝組織內羥脯氨酸含量(μg/g肝組織,±s)

表5 各組不同時間肝組織內羥脯氨酸含量(μg/g肝組織,±s)
注:與D組比較,*P<0.05;與C組比較,#P<0.05;與B組比較,△P<0.05
組別 4周 8周A組 69.1±6.2*#△ 34.4±3.3*#△425.45 459.13 B組 95.4±7.1* 57.7±6.9* C組 100.3±7.8* 61.6±3.9* D組 143.6±10.7 112.5±8.2 E組 14.1±1.9* 14.1±2.7* F值
3 討論
肝硬化屬于中醫學“瘤”、“痹”、“痞”、“積”等范疇,痰瘀互結,致使全身氣、血、津液運行不暢,陰陽失調,最終形成肝硬化。軟肝升白顆粒由黃芪、丹參、當歸、桃仁、白術、黨參、梔子、茵陳等16味中藥組成,具有活血軟堅、化痰除濕功效。丹參,常用的活血化瘀中藥,在臨床以及實驗研究中都被證實有較明確的抗肝硬化作用,抗肝硬化機制可能與其下調細胞因子、阻斷肝臟庫普弗細胞和肝星狀細胞(HSC)活化、減少膠原組織的合成及促進自由基清除和抗脂質過氧化作用有關[5]。黃芪具有補中益氣、升陽固表等功效,可以明顯減少總膠原及Ⅰ、Ⅲ、Ⅴ型膠原在大鼠肝臟的病理性沉積,降低膠原蛋白含量,對實驗性肝纖維化大鼠具有明顯的治療作用[3,6]。體外實驗表明,黃芪可明顯抑制體外激活的HSC增殖及膠原的產生[7]。臨床應用黃芪注射液可以改善肝纖維化患者的肝功能,降低血清ALT、AST,提高ALB水平,使血清HA、LN下降;并能降低慢性肝炎患者血清TGF-β1、HA的水平,明顯改善肝纖維化程度[8]。桃仁散瘀結積聚,當歸活血補血,對實驗性肝損害和中毒性肝炎,有保護肝細胞和恢復肝功能的作用,并可防止肝糖原降低,對體外培養肝細胞DNA、RNA的合成有促進作用[9]。桃仁還有抗炎、抗過敏、利膽及抗肝纖維化的作用。茵陳對實驗性肝損傷有保護作用,可減輕肝細胞腫脹、變性和壞死程度,改善臨床癥狀[10]。
本研究通過聯合上述藥物,從活血化瘀、抗炎和抗纖維化等方面配制軟肝升白顆粒,用于治療肝纖維化模型,與鱉甲軟肝片比較,從肝組織學和肝功能及纖維化指標等多方面證實,具有很好的療效。
[1]馬雪根,王秀文.硫代乙酰胺誘導大鼠肝纖維化模型的制備[J].抗感染藥學,2009,6(4):248-251.
[2]劉金霞,郭征榮,程志,等.軟肝升白顆粒對肝纖維化小鼠肝臟肝細胞生長因子及其C-Met mRNA表達的影響[J].北京中醫藥大學學報,2010,33(10):664-666.
[3]何瑤,陳白莉,楊榮萍,等.大鼠免疫性與淤膽性肝纖維化發病機制比較[J].南方醫科大學學報,2010,30(2):270-274.
[4]Okuyama H,Nakamura H,Shimahara Y,et al.Overexpression of thioredoxin prevents thioacetamide-induced hepatic fibrosis in mice[J].J Hepatol,2005,42(1):117-123.
[5]呂志平,劉曉燕,馬俊萍.黃芪抗肝纖維化的研究進展[J].陜西中醫,2003,24(7):652-654.
[6]陶艷艷,劉成海.丹參及其化學成分抗肝纖維化作用機制研究進展[J].中西醫結合學報,2004,2(2):145-148.
[7]張霄翔,楊雁,陳敏珠.黃芪多糖對HSC-T6細胞增殖及膠原產生的影響[J].中國臨床藥理學與治療學,2003,8(6):645-647.
[8]王迎霞,李慶相,張運巧,等.丹紅注射液、黃芪注射液對慢性乙型肝炎肝纖維化的影響[J].中醫雜志,2011,52(17): 1486-1488.
[10]仲雨,秦明珠.茵陳大孔樹脂提取物對CCl4所致肝損傷的影響[J].安徽醫藥,2007,11(1):13-14.

