醇析法結(jié)合離子交換法提取分離卵轉(zhuǎn)鐵蛋白
張晴晴,侯惠靜,劉愛(ài)國(guó),張佳慧,帖航,吳子健
(天津商業(yè)大學(xué)生物技術(shù)與食品科學(xué)學(xué)院,天津市食品生物技術(shù)重點(diǎn)實(shí)驗(yàn)室,天津300134)
卵轉(zhuǎn)鐵蛋白(Ovotransferrin,OVT)又稱(chēng)副卵白蛋白或卵伴白蛋白,是禽蛋清中一種含686 個(gè)氨基酸殘基的單肽鏈糖蛋白,其約占雞蛋蛋清蛋白總量的12%。該蛋白分子質(zhì)量為78 ku~80 ku,pI 為6.0,天然狀態(tài)下,其分子中所含的半胱氨酸殘基均參與形成穩(wěn)定蛋白結(jié)構(gòu)的二硫鍵,總共有15 個(gè)二硫橋鍵[1]。可結(jié)合鐵、銅、鋅等金屬離子,具抗細(xì)菌、抗真菌、抗病毒活性以及提高免疫力等生理功能。在制藥工業(yè)和食品工業(yè)極具有廣泛的應(yīng)用前景。
目前國(guó)內(nèi)外用于提取制備卵轉(zhuǎn)鐵蛋白方法有鹽沉淀法、膜分離技術(shù)法、陰陽(yáng)離子樹(shù)脂交換法以及乙醇析出法,但提取蛋白的純度較低;也有固定化金屬螯合親和色譜法產(chǎn)量雖有所提高,但過(guò)程較為復(fù)雜,且產(chǎn)量也較低。本文主要研究醇析法結(jié)合弱酸性陽(yáng)離子交換法提取分離卵轉(zhuǎn)鐵蛋白的工藝條件,目的在于既提高卵轉(zhuǎn)鐵蛋白制備的產(chǎn)量,又有效提高產(chǎn)品的純度。
1 材料與方法
1.1 卵轉(zhuǎn)鐵蛋白制備工藝路線(xiàn)
原蛋清→蛋清預(yù)處理→兩步醇析→兩步弱酸性陽(yáng)離子層析→透析除鹽→冷凍干燥→產(chǎn)品
1.2 材料及儀器
新鮮雞蛋:超市購(gòu)買(mǎi);其他試劑均為國(guó)產(chǎn)分析純;3-18K 低溫高速離心機(jī):德國(guó)Sigma 公司;FDU-810 型EYELA 冷凍干燥機(jī):日本東京理化公司;JY-SCZ2+型電泳槽、JY600 型電泳儀:北京君意東方電泳設(shè)備有限公司;WFZ800-D3B 紫外可見(jiàn)分光光度計(jì):北京瑞利分析儀器公司;AUW120D 電子天平:SHIMADZU 公司;Bio-rad 凝膠電泳成像儀:bio-rad laboratories-Segrate Milan ltaly。
1.3 方法
1.3.1 蛋白質(zhì)濃度的測(cè)定[2]
采用考馬斯亮藍(lán)法測(cè)定所提取樣品的蛋白質(zhì)濃度。
1.3.2 蛋白質(zhì)的SDS-PAGE 電泳[3]
SDS-PAGE 電泳檢測(cè)蛋白質(zhì)樣品條件:12%的分離膠和5 %的濃縮膠,上樣量10 μL,蛋白質(zhì)濃度為1 mg/mL,200 V 恒壓電泳1 h。
1.3.3 蛋清的預(yù)處理[4-5]
蛋清預(yù)處理參照2001年Thomas Croguennec 等和2005年C Guérin-Dubiard 等的方法并稍加改進(jìn)。取新鮮雞蛋,手工分離得到蛋清,加入3 倍去離子水混勻稀釋?zhuān)? 層紗布過(guò)濾除去不溶性物,濾液用1 mol/L HCl調(diào)pH 至6.0,4 ℃下攪拌過(guò)夜,之后置于4 ℃下3 000×g離心5 min。離心后,上清液即為“無(wú)黏蛋白”蛋清(“mucin-free”EW)。
1.3.4 乙醇析出法提取卵轉(zhuǎn)鐵蛋白粗品[6]
將經(jīng)1.3.3 法預(yù)處理后的蛋清的pH 調(diào)節(jié)至pH9.0,按照2008年K.Y.Ko 等的方法,采用乙醇析出法提取卵轉(zhuǎn)鐵蛋白粗品,方法簡(jiǎn)要如下:將經(jīng)1.3.3 法預(yù)處理好的蛋清溶液pH 調(diào)節(jié)至9.0,加入NaHCO3、NaCl 和FeCl3至終濃度分別為50 mmol/L、150 mmol/L和20 mmol/L,攪拌30 min 并加入乙醇至終濃度為43%(體積分?jǐn)?shù))后離心(4 ℃,3 220 g,20 min)取上清再滴加乙醇至終濃度為59 %,室溫下攪拌30 min 后離心(4 ℃,3 220 g,20 min)取沉淀復(fù)溶于檸檬酸鹽緩沖液(50 mmol/L)中并調(diào)節(jié)pH 至4.7,再加入已處理的pH 為4.7 的陽(yáng)離子樹(shù)脂并室溫下攪拌3 h,過(guò)濾出去樹(shù)脂,濾液凍干得OVT 粗品。
1.3.5 兩步弱酸性陽(yáng)離子交換層析法進(jìn)一步純化卵轉(zhuǎn)鐵蛋白[7]
參照2005年C Guérin-Dubiard 等的方法進(jìn)行離子交換層析,略有改進(jìn),具體如下:經(jīng)1.3.4 法提取的卵轉(zhuǎn)鐵蛋白粗品用磷酸緩沖液(pH8.0、20 mmol/L)溶解,至終濃度50 mg/mL,并用NaOH(1.0 mol/L)調(diào)節(jié)pH 至8.0,蛋白溶液經(jīng)低溫離心(4 ℃、6 000 g、30 min)得到蛋白濾液再經(jīng)兩步離子交換層析:第一步為pH8.0 弱酸性陽(yáng)離子樹(shù)脂去除堿性蛋白(緩沖液為:pH8.0 20 mmol/L 磷酸緩沖液;洗脫液為:0.5 mol/L NaClpH8.0 20 mmol/L 磷酸緩沖液;流速為20 mL/min;柱子25 cm×3 cm)收集峰1 組分;第二步為pH5.2 弱酸性陽(yáng)離子樹(shù)脂提取卵轉(zhuǎn)鐵蛋白粗品(緩沖液為:pH5.2 10 mmol/L 檸檬酸鹽緩沖液;洗脫液為:0.5 mol/L NaCl-pH5.2 10 mmol/L 檸檬酸鹽緩沖液;流速為20 mL/min;柱子25 cm×3 cm),收集峰2 組分含有卵轉(zhuǎn)鐵蛋白,再經(jīng)透析除鹽(4 ℃,24 h)就會(huì)得到高純度的產(chǎn)品,最后進(jìn)行電泳檢測(cè)。
2 結(jié)果與分析
2.1 乙醇析出法提取卵轉(zhuǎn)鐵蛋白粗品的結(jié)果
堿性條件下(pH=9.0)并有伴陰離子(HCO3-)的存在下,OVT 可通過(guò)HCO3-與Fe3+形成三元復(fù)合體,即Fe3+2-HCO3-OVT 復(fù)合物,呈橙紅色。OVT 蛋白分子中的N-端瓣和C-端瓣各含有一個(gè)金屬結(jié)合位點(diǎn)[8],其中N-端瓣中的4 個(gè)氨基酸殘基(即Asp60、Tyr191、Tyr92和His250)與來(lái)自伴陰離子的HCO3-共擁有6 個(gè)可與Fe3+結(jié)合的配位鍵,同樣C-端瓣的Asp395、Tyr524、Tyr431 和His592 也與來(lái)自一個(gè)HCO3-離子擁有6 個(gè)可與Fe3+結(jié)合的配位鍵,從而形成了2 個(gè)金屬結(jié)合位點(diǎn)。OVT 蛋白與HCO3-以及Fe3+相互結(jié)合后會(huì)使整個(gè)蛋白分子結(jié)構(gòu)變得更緊密、封閉、穩(wěn)定,并且提高了其對(duì)乙醇沉淀作用的耐受性。
方法1.3.4 先形成了OVT-HCO3--Fe3+三元復(fù)合體,后在43%乙醇濃度下,稀釋后的蛋清液中幾乎除了OVT 蛋白的其他蛋白都會(huì)沉淀,經(jīng)4 ℃離心(3 220×g,20 min)后可除去大部分除了轉(zhuǎn)鐵蛋白雜蛋白,而大部分形成三元復(fù)合體的OVT 則存在于呈亮橙紅色的上清液中,但當(dāng)乙醇終濃度到了59%時(shí),溶液中橙紅色物質(zhì),即OVT 三元復(fù)合體會(huì)發(fā)生沉淀,沉淀再用去離子水復(fù)溶成為亮橙紅色溶液,調(diào)節(jié)此溶液pH 至4.7,此時(shí)三元復(fù)合體在酸性條件下穩(wěn)定性下降,HCO3-和Fe3+會(huì)游離出來(lái),溶液顏色會(huì)由亮橙紅色逐漸變?yōu)槿榘咨偌尤腙庪x子交換樹(shù)脂并經(jīng)攪拌,HCO3-被陰離子交換樹(shù)脂吸附,經(jīng)過(guò)濾后,結(jié)合了HCO3-的樹(shù)脂可被除去,此時(shí),脫輔基蛋白就不會(huì)再結(jié)合Fe3+。得到溶液經(jīng)透析,凍干,得到脫輔基的卵轉(zhuǎn)鐵蛋白。SDS-PAGE電泳得到的電泳圖如圖1 所示。表明,此時(shí)蛋白的純度較高,經(jīng)凝膠成像系統(tǒng)的軟件分析表明該蛋白的純度高于96%。
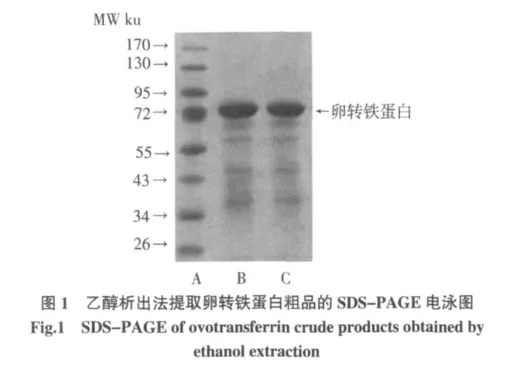
注:5%濃縮膠、12%分離膠;A 電泳道為Marker(PageRuler Prestained Protein Ladder#Sm0672,F(xiàn)ermentas 公司),上樣量5 μL;B 和C 電泳道分別為2 次提取的OVT 樣品,濃度為1 mg/mL、上樣量10 μL。
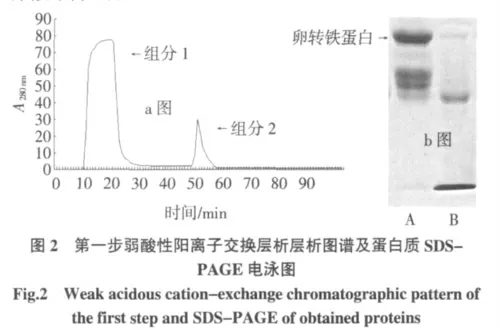
注:a 圖中,層析柱:2.0 cm×4 cm、平衡緩沖液:pH5.2,0.05 mol/L 檸檬酸-檸檬酸鈉緩沖液、流速:1 mL/min、洗脫液:0.05 mol/L 檸檬酸-檸檬酸鈉緩沖液pH5.2 并含0.5 mol/L NaCl;b 圖中,A 電泳道為組分1的圖譜,B 電泳道為組分2 的圖譜,C 電泳道為蛋白質(zhì)marker。
從電泳圖譜的結(jié)果來(lái)看,由方法1.3.4 提取的OVT 蛋白粗品仍含有其他蛋白質(zhì),特別是分子量在72 ku~34 ku 范圍內(nèi)的其他蛋白。
2.2 兩步弱酸性陽(yáng)離子交換層析進(jìn)一步純化卵轉(zhuǎn)鐵蛋白的結(jié)果
第一步弱酸性陽(yáng)離子交換層析過(guò)程如圖2a 所示,峰1 處所收集的蛋白液含有OVT 蛋白的組分1,峰2處所收集的為含有溶菌酶以及抗生素蛋白的組分2,經(jīng)SDS-PAGE 電泳的檢測(cè)結(jié)果如圖2b 所示,經(jīng)過(guò)這一步離子交換步驟,可有效地將等電點(diǎn)≥8.0 雜蛋白從樣液中除去。
3 結(jié)論
雞蛋原蛋清經(jīng)過(guò)蛋清預(yù)處理后可以得到“無(wú)黏蛋白”被稀釋的蛋清液,再經(jīng)過(guò)兩步醇析法可以得到純度較高的卵轉(zhuǎn)鐵蛋白,最后的兩步弱酸性陽(yáng)離子層析法以及相應(yīng)的冷凍干燥可是得到純度高于96%的卵轉(zhuǎn)鐵蛋白產(chǎn)品。
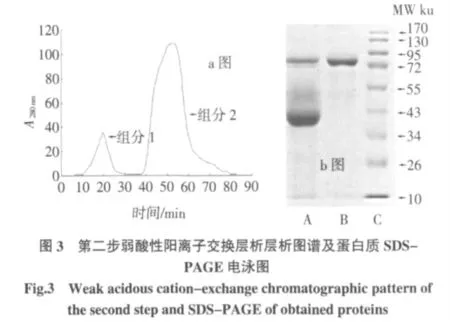
注:a 圖中,層析柱:2.0 cm×4 cm、平衡緩沖液:pH8.0,0.05 mol/L 磷酸鹽緩沖液、流速:1 ml/min、洗脫液:0.05 mol/L 磷酸鹽緩沖液pH8.0 并含0.5 mol/LNaCl;b 圖中,A 電泳道為組分1 圖譜,B 電泳道為組分2圖譜。
第二步弱酸性陽(yáng)離子交換層析過(guò)程如圖3 所示,峰1 處所收集的組分1 蛋白液所含的大多數(shù)蛋白質(zhì)的等電點(diǎn)小于pH5.2,而峰2 處所收集的組分2 蛋白液為OVT 蛋白組分,經(jīng)SDS-PAGE 電泳的檢測(cè)結(jié)果如圖2b 所示,經(jīng)過(guò)第二步離子交換后,B 電泳道的圖譜
[1] Spik G,Coddeville B,Montreuil J.Comparative study of the primary structures of sero-,lacto-and ovotransferrin glycans from different species[J].Biochimie,1988,70(11):1459-1469
[2] 陳慶森,龐光昌,吳子健.實(shí)用生物化學(xué)實(shí)驗(yàn)技術(shù)指導(dǎo)[M].天津:天津科學(xué)技術(shù)出版社,2006:40-41
[3] 理查德J 辛普森.蛋白質(zhì)與蛋白質(zhì)組學(xué)實(shí)驗(yàn)指南[M].何大澄,譯.北京:化學(xué)工業(yè)出版社,2006:35-79
[4] Guérin-Dubiard C,Pasco M,Hietanen A.Hen egg white fractionation by ion-exchange chromatography [J].Journal of Chromatography A,2005(6):58-67
[5] Thomas Croguennec,Fran?oise Nau,Stéphane Pezennec,et al.Twostep chromatographic procedure for the preparation of hen egg white ovotransferrin[J].Eur Food Res Technol,2001,212(15):296-301
[6] Ko K Y,Ahn D U.An Economic and Simple Purification Procedure for the Large-Scale Production of Ovotransferrin from Egg White[J].Poultry Science,2008(87):1441-1450
[7] C Guérin-Dubiard,M Pasco,A Hietanen.Hen egg white fractionation by ion-exchange chromatography[J].Journal of Chromatography A,2005,1090(1-2):58-67
[8] Hirofumi Kurokawa, Bunzo Mikami, Masaaki Hirose. Crystal Structure of Diferric Hen Ovotransferrin at 2.4?Resolution[J].J Mol Biol,1995,254(2):196-207

